传统毛霉型豆豉中苯甲酸形成机理的研究
2013-03-07沈祥森阚建全冯铄涵谢德芳曾凡玉
沈祥森,阚建全,*,冯铄涵,李 帅,谢德芳,曾凡玉
(1.西南大学食品科学学院,重庆 400715;2.重庆市农产品加工及贮藏重点实验室,重庆 400715;3.永川豆豉食品有限公司,重庆 402160)
传统毛霉型豆豉中苯甲酸形成机理的研究
沈祥森1,2,阚建全1,2,*,冯铄涵1,2,李 帅1,2,谢德芳3,曾凡玉3
(1.西南大学食品科学学院,重庆 400715;2.重庆市农产品加工及贮藏重点实验室,重庆 400715;3.永川豆豉食品有限公司,重庆 402160)
通过高效液相色谱(HPLC)方法分析测定传统毛霉型豆豉在不同发酵时期的苯甲酸、苯丙氨酸和β-苯丙烯酸(肉桂酸)的含量以及苯丙氨酸解氨酶酶活性的变化趋势,以研究苯甲酸在传统毛霉型豆豉的发酵生产中的形成机理,揭示传统毛霉型豆豉中苯甲酸在非人为添加情况下自然存在的原因。结果表明:在制曲2d(S3)时,苯甲酸含量为2.43mg/kg,随后其含量不断增加,到后发酵215d(S14)时,达到37.23mg/kg;而苯丙氨酸含量也由原料大豆的4.89mg/100g增加到了S14(后发酵第215天)中的272.23mg/100g;中间产物β-苯丙烯酸在制曲阶段含量较高,在后发酵阶段逐渐减少,并且其在制曲阶段含量较大时苯甲酸增加趋势明显,在后发酵阶段含量较小时苯甲酸含量增加趋势不明显;同时催化苯丙氨酸转化为β-苯丙烯酸(肉桂酸)这一反应的苯丙氨酸解氨酶(PAL)酶活性在制曲阶段较强,在后发酵阶段逐渐减弱。在后发酵阶段人为添加β-苯丙烯酸后通过动态检测得出苯甲酸、β-苯丙烯酸含量呈现一升一降的结果。因此可以得出,传统毛霉型豆豉中苯甲酸形成的机理可能为:大豆中的蛋白质首先部分水解为氨基酸,其中的苯丙氨酸在PAL的催化下转变为β-苯丙烯酸,β-苯丙烯酸在一定条件下最终氧化形成苯甲酸。
传统毛霉型豆豉;苯甲酸;苯丙氨酸;β-苯丙烯酸;苯丙氨酸解氨酶;形成机理
豆豉(douchi),古名 幽菽,是一种以黑豆、黄豆为主要原料,利用微生物发酵制成的一种调味食品。豆豉在加工过程中破坏了胰蛋白酶抑制剂,产生的纤维素酶使纤维素水解生成单糖,蛋白酶使蛋白质水解生成多肽、氨基酸等,这些多肽具有促进能量代谢及减肥效果、提高免疫力、调节胰岛素、降低血压、血脂和胆固醇、抑制肿瘤及抗氧化等多种生物活性[1]。同时豆豉中,不仅含有大豆中原有的营养素,而且通过微生物的发酵作用又产生了很多对人体有保健作用的活性物质,如含有人体所需的多种氨基酸和维生素等。豆豉以其独特的滋味使人增加食欲,不仅是佐餐佳品,并且可以入药。豆豉中含有很高的尿激酶,尿激酶具有溶解血栓的功能。豆豉中含有的营养素可以改善胃肠道菌群,因此常吃豆豉可起到帮助消化、预防疾病、延缓衰老、增强脑力、降低血压、消除疲劳、减轻病痛、预防癌症和提高肝脏解毒(包括酒精毒)的作用[2]。因此,豆豉深受广大群众所喜爱,是纯天然的黑色食品。
按制曲微生物不同,豆豉可分为细菌性豆豉(如四川水豆豉、日本纳豆)、毛霉型豆豉(如永川豆豉、潼川豆豉)、根霉型豆豉(如印尼丹贝)和曲霉型豆豉(如广东阳江豆豉、湖南浏阳豆豉);按发酵时间是否加食盐,分为咸豉、淡豉;按成品含水量多少,分为干豉、湿豉和水豉。我国主要生产毛霉、曲霉型豆豉及少量细菌性豆豉(俗称水豆豉),国外以丹贝Tempeh(印度尼西亚根霉型豆豉)和纳豆Natto(日本细菌型豆豉)最为著名[3]。我国的毛霉型豆豉在实际生产中遇到这样一个问题:产品中检出了不应检出的苯甲酸[4],生产企业很困惑。对于此,国内外没有相关文献的直接报道,但有一些间接报道,例如,1966年,Ogata等[5]在研究芳香族氨基酸的微生物代谢时发现,红酵母属中的某些种能以L-苯丙氨酸为唯一碳、氮源生长,并在培养基中积累肉桂酸。有研究[6]报道在研究生物体苯丙氨酸代谢时发现短杆菌(Brevibacterium flavum)、诺卡菌(Nocardia farcinica)、中高温放线菌(Actinomycete)、微杆菌属(Microbacterium Orla-Jensen)菌株及一些霉菌菌株细胞破碎后的粗提液中可测到一种能作用于芳香族氨基酸的脱氢酶即苯丙氨酸脱氢酶(PAL)。这种酶是苯丙氨酸代谢的关键酶,它能够催化L-苯丙氨酸转化为肉桂酸。Nakushima等[7]通过电镜技术对细胞亚显微结构进行研究显示,PAL分散在细胞的基质,存在于高尔基体囊泡和次生壁加厚层中。随后,该酶相继在其他微生物中被发现,主要属于霉菌与酵母菌。如链霉菌属(Streptomyces)、枝孢霉属(Cladosporium)、共头霉(Symcephalasilrum)、内孢霉属(Endomuces)、曲霉属(Asperhillus)、地霉属(Geotrlcum)、从梗孢属(Monilella)、小丛壳属(Glomerella)、卵孢酵母属(Oosporidium)、类酵母属(Saccharomycodes)、掷酵母属(Sporidlobolus)。肉桂酸通过自然氧化后,其氧化终产物即是苯甲酸。本实验通过对苯甲酸化学结构、物理性质的分析,发现从苯丙氨酸形成苯甲酸的可能途径为:苯丙氨酸在微生物苯丙氨酸解氨酶的催化下首先转变为肉桂酸和氨,肉桂酸在一定条件下最终形成苯甲酸[8-9]。本实验通过HPLC方法检测传统毛霉型豆豉在不同发酵时期的苯甲酸、苯丙氨酸和β-苯丙烯酸(肉桂酸)的含量以及苯丙氨酸解氨酶酶活性的变化趋势,以研究并验证苯甲酸在传统毛霉型豆豉发酵生产中的形成机理是否是该条途径,从而揭示传统毛霉型豆豉中苯甲酸在非人为添加情况下自然存在的原因。
1 材料与方法
1.1 材料
所用的材料均为2010年12月10日于重庆市永川豆豉食品有限公司按随机方法抽取所得,属于不同加工阶段的毛霉型豆豉,原料大豆产地为吉林省。所有豆豉样品取回后,部分样品立即进行苯丙氨酸解氨酶酶活性的测定,其余样品放入密闭的坛子中在自然环境下进行后发酵到规定的时间取出进行测定。
永川传统毛霉型豆豉生产工艺流程如下:大豆筛选→浸泡→沥干→常压蒸料→冷却→自然发酵制曲→翻曲→拌料(15%食盐、醪糟、白酒等)→入罐发酵后熟→成品
表1中S1~S14分别代表了在不同生产时期按随机方法抽取所得的豆豉样品。

表 1 不同加工时期按随机方法抽取所得的豆豉样品的状态及其编号Table 1 Sampling and sample designation
1.2 试剂与仪器
苯甲酸标准品、β-苯丙烯酸标准品、苯丙氨酸标准品、2,4-二硝基氟苯(DNFB)、甲醇、乙腈均为色谱纯;磷酸二氢钾、硼酸、碳酸氢钠、碳酸钙、乙二胺四乙酸、盐酸、乙醚、石油醚均为分析纯。
UV-2450紫外分光光度计、LC-20A高效液相色谱仪日本岛津公司;5810台式高速离心机 德国Eppendorf公司;ALPAAI-4LSC冷冻干燥机 美国Christ公司;SIMF140AY65制冰机 日本三洋公司;微孔过滤器(滤膜0.45µm)。
1.3 方法
1.3.1 样品预处理
将取自不同发酵时期的豆豉样品在—15℃冷冻干燥3d以去除水分,再用研磨机粉碎成粉,过80目,置于低温冰箱(—18℃)中冷冻保藏(酶活力实验的样品除外)。
1.3.2 苯丙氨酸含量的HPLC法测定[10-12]
1.3.2.1 溶液的配制
DNFB溶液的配制:精密量取0.25mL DNFB,置于25mL棕色容量瓶中,用乙腈溶解并定容,用塞子塞好,并用封口膜密封,即得0.1g/L的DNFB溶液,置于4℃冰箱保存。
苯丙氨酸标准溶液的配制:精确称取苯丙氨酸标准品1.0000g,用超纯水溶解并稀释制成质量浓度60、120、150、240、300µg/mL的苯丙氨酸标准品溶液。
1.3.2.2 样品制备及测定
称取2.50g豆豉样品,用去离子水充分溶解并稀释至25mL,摇匀,放入超声波仪器中30℃超声1h,使样品充分溶解。再转入50mL离心管中,11000r/min离心10min。精密吸取上清液1.0mL置于10mL棕色容量瓶中,加入0.5mol/L pH值为9.0的碳酸氢钠溶液1.0mL,再加入DNFB溶液1.0mL,混匀,用塞子塞好,放入恒温水浴锅中,暗处避光于60℃反应60min后取出,水浴避光冷至室温。用磷酸盐缓冲溶液(pH7.0)定容,放置15min,0.45µm极性滤膜过滤后供液相色谱分析。
1.3.2.3 HPLC色谱分析条件
色谱柱为Inertsil ODS-SP(250mmh4.6mm,5µm);流动相:A相为0.05mol/L醋酸钠缓冲溶液,pH6.50;B相为乙腈-水溶液(1:1,V/V);流速1.0mL/min;柱温23℃;检测波长360nm;进样量10µL。
1.3.2.4 苯丙氨酸含量的计算
分别准确吸取样品处理液和标准液10µL,注入高效液相色谱仪进行分析,以其标准溶液峰的保留时间定性,以其峰面积计算出样液中被测物质的含量。

式中:X为样品中苯丙氨酸含量/(mg/100g);S1为样品峰面积;ρ为标准溶液质量浓度/(mg/mL);S2为标准溶液的峰面积;V为样品定容体积/mL;m为试样质量/g。
1.3.3 β-苯丙烯酸含量的测定[13]
1.3.3.1 样品制备
称取2.00g豆豉待测样品,加5%盐酸溶液1mL酸化,置于具塞锥形瓶中,精密加入三氯甲烷-甲醇(2:1,V/V)溶液20mL,室温下浸泡30min,过滤,精密吸取滤液10mL,室温下挥干,残渣用甲醇溶解并定容至5mL,即得供试品溶液,经0.45µm极性滤膜过滤后供液相色谱分析。
1.3.3.2 HPLC色谱分析条件
色谱柱为Agilent HC-C18(250mmh4.6mm,5µm);流动相:甲醇(A相):0.1%磷酸(B相)=49:51;流速1.0mL/min;检测波长280nm;进样量10µL;柱温25℃。
1.3.3.3 β-苯丙烯酸含量的计算
准确吸取样品处理液和标准液10µL,注入高效液相色谱仪进行分析,以其标准溶液峰的保留时间定性,以其峰面积计算出样液中被测物质的含量。

式中:X为样品中β-苯丙烯酸含量/(mg/kg);S1为样品峰面积;ρ为标准溶液质量浓度/(mg/mL);S2标准溶液的峰面积;V为样品定容体积/mL;m为试样质量/g。
1.3.4 苯甲酸含量的测定[14-16]
1.3.4.1 溶液的配制
苯甲酸标准溶液的配制:精密称取苯甲酸0.500g置于25mL容量瓶中,用超纯水溶解并稀释至刻度,混匀,即得混合标准液,质量浓度为20mg/mL。
乙酸铵溶液(0.02mol/L):称取1.54g乙酸铵,加超纯水溶解并定容至1000mL,经0.45µm滤膜过滤即得。
1.3.4.2 样品的制备及处理
称取2.50g均匀粉碎冷冻干燥后的豆豉,置于25mL离心管中。加入1.0mol/L盐酸0.5mL,用10mL乙醚提取2次,每次振摇2min,将上层乙醚提取液移入另一个25mL离心管中,合并乙醚提取液。用3mL氯化钠酸性溶液(4.0g/L)洗涤2次,静置15min,用滴管将乙醚层通过无水硫酸钠滤入25mL容量瓶中。加乙醚至刻度,混匀。准确吸取5mL乙醚提取液于10mL离心管中,置40℃水浴上氮吹至干,加入1.00mL流动相(甲醇、0.02mo1/L乙酸铵体积比5:95),经0.45µm极性滤膜过滤后供液相色谱分析。
1.3.4.3 色谱分离条件
色谱柱为Agilent HC-C18(250mmh4.6mm,5µm);流动相:乙酸铵(A相):甲醇(B相)=10:90;流速:1.0mL/min;进样量:10µL;检测波长:230nm;柱温:35℃。
1.3.4.4 苯甲酸含量的计算
准确吸取样品处理液和标准液10µL,注入高效液相色谱仪进行分析,以其标准溶液峰的保留时间定性,以其峰面积计算出样液中被测物质的含量。

式中:X为样品中苯甲酸含量/(mg/kg);S1为样品峰面积;ρ为标准溶液质量浓度/(mg/mL);S2标准溶液峰面积;V为样品定容体积/mL;m为试样质量/g。
1.3.5 苯丙氨酸解氨酶酶活力的测定[17]
1.3.5.1 样品制备及测定
准确称取不同时期豆豉5.00g,加0.50g乙二胺四乙酸(EDTA)、少许石英砂、适量冰块,研磨成匀浆。加入pH 8.8硼酸缓冲液15mL,4℃、6000r/min离心10min,上清液为酶粗提取液。取1mL酶粗提取液,加0.02mol/L苯丙氨酸溶液4mL,加入pH 8.8硼酸缓冲液5mL,40℃水浴30min后,加入6mol/L盐酸1.0mL终止反应。测定1min内290nm波长处吸光度变化,以吸光度变化0.001为1个酶活力单位(U),酶活力表示为U/(mingg)。
1.3.5.2 PAL活力计算

式中:X为PAL活力/(U/(mingg));ΔA为吸光度变化;t为反应时间/min;m为样品质量/g。
1.3.6 后发酵阶段添加β-苯丙烯酸后苯甲酸、β-苯丙烯酸含量动态变化研究
于后发酵阶段豆豉(S14,约10kg)中人为定量添加50mL配制成5.0g/L的β-苯丙烯酸,于0、2、4、6、8、10d连续动态检测豆豉中β-苯丙烯酸、苯甲酸含量。
1.3.7 数据分析
以上实验数据均是3次平行实验得到的数据,并利用SPSS 11.0、Excel 2007对实验数据进行统计分析处理。
2 结果与分析
2.1 传统毛霉型豆豉中苯丙氨酸含量的变化
经HPLC法测定经衍生后的苯丙氨酸含量灵敏准确,测得不同质量浓度的样品峰面积(Y)与苯丙氨酸质量浓度(X)进行线性回归,得回归方程Y = 377.96X—5909.1(R2= 0.9994)。结果表明:苯丙氨酸衍生物质量浓度在60~300µg/mL范围内,线性关系良好。

图 1 豆豉在发酵过程中苯丙氨酸含量的变化Fig.1 Change in phenylalanine content in douchi during fermentation
由图1可知,豆豉在制曲过程中,由于微生物生长繁殖而分泌出蛋白酶、肽酶等,大豆蛋白质在这些酶的作用下将水解生成氨基酸和肽类,所以其中苯丙氨酸的含量越来越多,尤其在制曲阶段增长较快。总的含量由原料大豆(S1)的4.89mg/100g增加到后发酵第215天(S14)的272.23mg/100g。
2.2 传统毛霉型豆豉中β-苯丙烯酸含量的变化
以β-苯丙烯酸质量浓度为横坐标(X,mg/L),峰面积为纵坐标(Y)绘制标准曲线,得到标准曲线的回归方程为Y=278.67X—88.958(R2= 0.9997)。结果表明:β-苯丙烯酸质量浓度在1~40mg/L范围内,线性关系良好。
由图2可知,在制曲的第2天(S3),即有β-苯丙烯酸的出现。随着制曲时间的延长,β-苯丙烯酸含量逐渐增加,在制曲第5天附近(S5)即达到最大值,之后含量基本保持稳定,并维持到制曲第10天(S8)。进入后发酵阶段后,β-苯丙烯酸含量呈下降趋势。由此可以推测,β-苯丙烯酸是某个代谢途径的中间产物,它在不断生成也在不断消耗。

β-苯丙烯酸含量的变化Fig.2 Change in β-cinnamic acid content in douchi during fermentation图 2 豆豉加工过程中
2.3 传统毛霉型豆豉中苯甲酸含量的变化
HPLC法测定苯甲酸含量简单并且灵敏,测得不同质量浓度苯甲酸对照品的峰面积。以峰面积(Y)与苯甲酸质量浓度(X)进行线性回归,得回归方程:Y = 364.57X—1052.6(R2=0.9995)。结果表明:苯甲酸质量浓度在10~200mg/L范围内,线性关系良好。
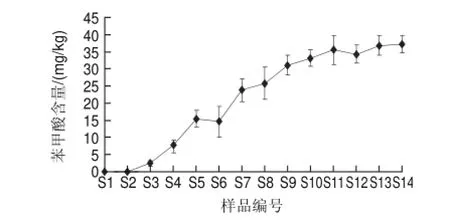
图 3 豆豉加工过程中苯甲酸含量的变化Fig.3 Change in benzoic acid content in douchi during fermentation
由图3可知,在制曲2d(S3)时,苯甲酸含量为2.43mg/kg,随后其含量不断增加,到S14(后发酵215d)时,达到37.23mg/kg,以后就增加很缓慢了。
2.4 传统毛霉型豆豉中苯丙氨酸解氨酶活力的变化

图 4 豆豉加工过程中PAL酶活力Fig.4 Change in PAL activity in douchi during fermentation
由图4可知,原料大豆PAL酶活力较低,经过蒸煮后PAL失活。随着大豆制曲阶段时间的延长,在微生物作用下产生的微生物PAL酶活力增强,在制曲第10天(S8)附近达到最大值,这是制曲的最后阶段。而在豆豉后发酵阶段,由于加盐和厌氧等的环境,微生物受到抑制,PAL酶活力也减弱。
2.5 后发酵阶段(S14)豆豉中人为添加β-苯丙烯酸后苯甲酸、β-苯丙烯酸动态含量变化
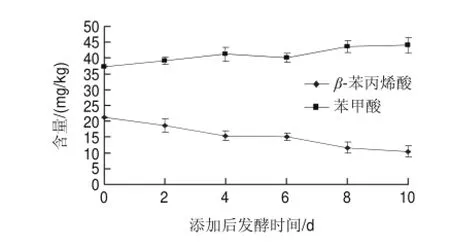
图 5 后发酵阶段添加β-苯丙烯酸后苯甲酸、β-苯丙烯酸动态含量的变化Fig.5 Change in benzoic acid and β-cinnamic acid contents in douchi during post-fermentation with the addition of β-cinnamic acid
由图5可知,在后发酵阶段豆豉中(S14)人为添加β-苯丙烯酸后,苯甲酸的含量呈现增长趋势,从37.23mg/kg增加到了10d后的44.01mg/kg,β-苯丙烯酸则从刚添加时的21.32mg/kg下降到了10d后的10.46mg/kg。两种物质的含量一升一降,但该比例并不是1:1的对应关系,这是因为β-苯丙烯酸的氧化产物不仅有苯甲酸还有苯乙酮,所以两者数量并不是一一对应的,但是可以得出β-苯丙烯酸和苯甲酸二者是存在相应的相关关系的。
3 讨论与结论
在制曲前的原料大豆中,苯甲酸并未检出。在制曲的第4天(S4),开始检出苯甲酸。随着制曲时间的延长,苯甲酸含量呈上升趋势。说明豆豉在整个发酵生产过程中,是有物质转化生成苯甲酸。
在制曲阶段,苯丙氨酸含量增加明显,在制曲的第2天(S3)也检出了中间产物β-苯丙烯酸,且在这一阶段苯甲酸含量增加明显,苯丙氨酸解氨酶酶活性也强,随着制曲时间的结束,豆豉生产进入后发酵阶段,β-苯丙烯酸含量降低,苯甲酸的增加趋势趋缓。当β-苯丙烯酸含量在几乎低于检测值时,苯甲酸含量维持在37mg/kg左右不再增加。在后发酵阶段人为添加β-苯丙烯酸后通过动态检测得出苯甲酸、β-苯丙烯酸含量一升一降的结果,由于β-苯丙烯酸的氧化产物不仅有苯甲酸还有苯乙酮,所以两者的数量关系并不是1:1的对应关系,但可以说明β-苯丙烯酸与苯甲酸是存在着对应的相关关系。由于苯甲酸是β-苯丙烯酸的氧化物,所以可能性结论为:豆豉在加工过程中由于微生物发酵所产生的蛋白酶使蛋白质水解生成多肽、氨基酸等,其中就包括苯丙氨酸;苯丙氨酸在微生物(主要为霉菌)所产的苯丙氨酸解氨酶催化下脱掉氨基生成了β-苯丙烯酸,β-苯丙烯酸经过代谢,最终氧化生成苯甲酸。
[1] 汪孟娟, 陈廷涛. 豆豉发酵中的微生物和功能性组分研究动态[J].中国微生态学杂志, 2010, 22(1): 81-84.
[2] 牛天骄, 马莺. 中国传统发酵豆制品中微生物的发掘与利用[J]. 中国酿造, 2005(2): 1-5.
[3] 梁恒宇, 程建军. 中国传统大豆发酵食品中微生物的分布[J]. 食品科学, 2004, 25(11): 401-403.
[4] 籍保平, 李博. 豆制品安全生产与品质控制[M]. 北京: 化学工业出版社, 2005: 216-244.
[5] OGATA K, UCHIYAMA K, YAMADA H. Microbial formation of cinnamic acid from phenylalanine[J]. J Agri Biol Chem, 1966, 30(3): 311-312.
[6] 崔建东, 李艳. 苯丙氨酸解氨酶(PAL)的研究进展[J]. 食品工业科技, 2008(7): 306-307.
[7] NAKASHIMA J. Immunocytochemical localization of phenylalanine arm-monialyase and cinnamyl alcohol dehydrogenase in differentiating tracheary elements derived from Zinnia mersophyll cells[J]. Plant Cell Physiology, 1997, 38(2): 113-123.
[8] 杨顺楷, 杨亚力. 苯丙氨酸解氨酶(PAL, EC4.3.1.5)反应机理研究新进展[J]. 生物加工过程, 2005, 2(4): 1-5.
[9] 张必弦, 李炜. 大豆苯丙氨酸解氨酶及其基因的研究进展[J]. 大豆科学, 2008, 27(6): 1058-1061.
[10] 王敏, 张敬书. HPLC法测定玉米浆中游离氨基酸的含量[J]. 中国酿造, 2010(5): 156-159.
[11] 唐涛. 氨基酸柱前衍生化HPLC方法发展及应用[D]. 南京: 南京理工大学, 2006.
[12] SHEN Zhong, SUN Zhen, WU Li. Rapid method for the determination of amino acids in serum by capillary electrophoresis[J]. J Chromatogr A, 2002, 979: 227-232.
[13] 张洪娟, 张妍妍. 不同产地独角莲药材中β-苯丙烯酸的含量测定[J].时珍国医国药, 2009, 20(5): 1143-1146.
[14] 程盛华, 丁丽. 高效液相色谱法同时测定月饼中的苯甲酸、山梨酸和糖精钠[J]. 食品科学, 2008, 29(6): 376-378.
[15] 黄慧芬, 彭方. 高效液相色谱法测定肉制品中苯甲酸和山梨酸[J].中国卫生检验杂志, 2010(9): 1687-1690.
[16] 陈亚成, 贾彩凤. 牛乳中苯甲酸的HPLC测定及来源分析[J]. 食品工业科技, 2010(6): 94-99.
[17] 张福平, 李秋红. 温度对黄皮果实PAL、POD和PPO活性的影响[J].食品与发酵工业, 2008(11): 69-71.
Benzoic Acid Formation Mechanism in Traditional Fermented Douchi
SHEN Xiang-sen1,2,KAN Jian-quan1,2,*,FENG Shuo-han1,2,LI Shuai1,2,XIE De-fang3,ZENG Fan-yu3
(1. College of Food Science, Southwest University, Chongqing 400715, China;2. Chongqing Key Laboratory of Produce Processing and Storage, Chongqing 400715, China;3. Yongchuan Douchi Food Co. Ltd., Chongqing 402160, China)
To explore the mechanism of benzoic acid formation during production of traditional fermented douchi and discover the reason for natural existence of benzoic acid without adding it, changes in the contents of benzoic acid, phenylalanine and β-cinnamic acid and phenylalanine ammonia lyase (PAL) activity were determined by HPLC at different stages of fermentation. After 2 days of incubation, the benzoic acid content of the koji was 2.43 mg/kg and then gradually increased with increasing incubation time, reaching 37.23 mg/kg after 215 days of post-fermentation. Similarly, the phenylalanine content of the starting raw material (soybean) was 4.89 mg/100 g and increased to 272.23 mg/100 g after 215 days of post-fermentation. β-cinnamic acid showed a high level during the koji making stage, resulting in an obvious increase in benzoic acid level, but gradually declined during the post-fermentation stage, without considerably increasing benzoic acid level. Moreover, the PAL activity, which catalyzes the transformation of phenylalanine into β-cinnamic acid, was stronger during the koji making stage, but gradually became weaker during the post-fermentation stage. The contents of benzoic acid and β-cinnamic acid increased and decreased, respectively, due to addition of β-cinnamic acid during the post-fermentation stage. Hence, we conclude that the mechanism of benzoic acid formation during production of traditional fermented douchi may partial hydrolysis of proteins into peptides in the staring raw material, subsequent PAL-catalyzed transformation of phenylalanine into β-cinnamic acid and fi nal oxidization of β-cinnamic acid into benzoic acid under required conditions.
traditional fermented douchi;benzoic acid;phenylalanine;β-cinnamic acid;phenylalanine ammonia lyase;formation mechanism
TS201.3
A
1002-6630(2013)01-0150-05
2011-09-26
沈祥森(1986ü),男,硕士研究生,研究方向为食品化学与营养学。E-mail:122171120@qq.com
*通信作者:阚建全(1965ü),男,教授,博士,研究方向为食品化学与营养学,食品生物技术。E-mail:ganjq1965@163.com
