米糠4种蛋白质的提取与功能性质
2013-03-07王长远
张 敏,周 梅,王长远,3
(1.北京工商大学食品学院,北京 100037;2.东北农业大学食品学院,黑龙江 哈尔滨 150030;3.黑龙江八一农垦大学食品学院,黑龙江 大庆 163000)
米糠4种蛋白质的提取与功能性质
张 敏1,2,周 梅2,王长远2,3
(1.北京工商大学食品学院,北京 100037;2.东北农业大学食品学院,黑龙江 哈尔滨 150030;3.黑龙江八一农垦大学食品学院,黑龙江 大庆 163000)
按照Osbron法提取米糠中的清蛋白、球蛋白、醇蛋白、谷蛋白,并对4种蛋白进行功能性质评价。结果表明:米糠中清蛋白、球蛋白、醇蛋白、谷蛋白占米糠蛋白总量依次是56.93%、20.84%、3.167%、19.06%;等电点依次是pH4.0、4.0、5.0、4.6。4种蛋白的功能性质对比评价表明:清蛋白的持水性最大,醇蛋白的乳化性最高,清蛋白在等电点处的起泡性最差。SDS-PAGE凝胶电泳分析表明:清蛋白分子的亚基组成分子质量为95.43、76.51、52.85kD;球蛋白的亚基组成分子质量为103.12、76.51kD;醇蛋白的亚基组成分子质量为14.00kD;谷蛋白的亚基组成分子质量为36.29、20.00、14.00kD。
谷物蛋白;提取工艺;功能性质;亚基组成
米糠是稻谷加工过程中产生的重要副产品,稻谷碾米时通常先去掉稻壳得到糙米,糙米再经碾白碾去米糠得到精白米。米糠中的蛋白质是米糠的主要营养成分,米糠蛋白质中必需氨基酸的含量和相互比值也符合人体的需要,米糠蛋白质还有一个最大的优点即低过敏性,尤其适合于生长速度快以及胃消化功能尚不完全的婴儿,其所含丰富的组氨酸、精氨酸和半胱氨酸等也是出生时体质量较轻的婴儿的必需氨基酸,因此米糠蛋白可作为婴儿食品的主要蛋白原料[1]。
米糠蛋白具有较高的营养价值,其组成主要为清蛋白、球蛋白、谷蛋白及醇溶蛋白,这4种蛋白质的质量比例为37:36:22:5,其中可溶性蛋白质约占70%,与大豆蛋白相近[2]。
尽管米糠蛋白的营养潜力和经济价值已经被公认,但由于米糠含有大量纤维、半纤维和植酸等,它们对蛋白质有较强束缚作用,普通溶剂无法使这些蛋白溶解出来;且米糠脂肪含量较高,易氧化酸败,往往需要先经加热稳定化处理,经这些处理后更增加蛋白质提取难度[3]。
目前,食品级的米糠蛋白产品在国内仍然缺乏生产和应用。国内外对大豆球蛋白、玉米醇蛋白等进行了大量的基础和应用研究,市场前景极为可观。而对米糠清蛋白、球蛋白、醇蛋白、谷蛋白的研究还比较薄弱。
1 材料与方法
1.1 材料与试剂
脱脂米糠(蛋白质含量19.06%):黑龙江省北大荒米业有限公司。
牛血清白蛋白、丙烯酰胺、N,N-甲叉双丙烯酰胺、Tris、甘氨酸、考马斯亮蓝R-250 美国Sigma公司;蛋白质Marker 上海润成生物科技有限公司;其他所用试剂均为国产分析纯。
1.2 方法
1.2.1 清蛋白、球蛋白、醇蛋白、谷蛋白提取工艺
采用Osbron法[4-5]提取米糠中的清蛋白、球蛋白、醇蛋白、谷蛋白,实验工艺流程如图1所示。

图 1 Osbron法提取米糠中的清蛋白、球蛋白、醇蛋白、谷蛋白工艺流程Fig.1 Procedure for Osbron extraction of albumin, globulin, gliadin and glutenin from rice bran
1.2.2 蛋白含量的测定
采用凯氏定氮法[6]测定米糠及其清蛋白、球蛋白、醇蛋白、谷蛋白中的蛋白质含量。
1.2.3 等电点的确定
采用福林酚法[7-8],根据蛋白质在等电点处蛋白溶解性最低的原理,通过测蛋白质的浓度来测定米糠蛋白的等电点。
1.2.4 蛋白功能性质测定
1.2.4.1 持水性测定[9]
取5.0g样品分散于95mL水中,不同温度条件下搅拌15min后静置2h,500r/min离心15min,弃去上清液,称沉淀质量,按式(1)计算持水性。
1.2.4.2 乳化性能测定[10]
用0.2mol/L pH7.0的磷酸缓冲溶液配制1g/100mL的蛋白溶液并用浓度为0.1mol/L的HCl或浓度为0.1mol/L的NaOH分别调pH值,然后加入大豆油比例为4:1,最高转速10000r/min均质1min,之后立即于容器底部取样100μL,用质量分数为0.1%的SDS溶液稀释10倍,混匀后于500nm波长处测定吸光度,以SDS溶液作为空白。乳化活性(EAI)按式(2)计算。
式中:A0为均质后迅速被稀释的乳化液的吸光度;ρ为蛋白质的质量浓度/(g/mL);N为稀释倍数;Φ为乳化液中油的体积分数(本实验是0.25)。
1.2.4.3 米糠蛋白起泡性(FA)[11]
取一定量的米糠蛋白样品,用25mL水溶液制备成一定浓度、pH值、温度和氯化钠浓度梯度的蛋白质分散系,移入50mL的离心管中,使用电动分散均质机在12000r/min搅拌2min,以产生的气泡的顶端与液面的距离为高,容器的横截面积为底面积,立即读取泡沫体积,按式(3)计算起泡性。
式中:V0为溶解样品水溶液的体积/mL;V为搅拌停止时泡沫的体积/mL。
1.2.5 SDS-PAGE凝胶电泳
采用14%分离胶、4%浓缩胶对清蛋白、球蛋白、醇蛋白、谷蛋白等蛋白质进行SDS-PAGE电泳分析[12]。先恒流电压80V,40min后将电压调节到120V。固定液固定30min,R-250染色,染色30min,用脱色液脱色。用Alphalmager HP凝胶成像系统拍照。
2 结果与分析
2.1 4种蛋白含量测定结果
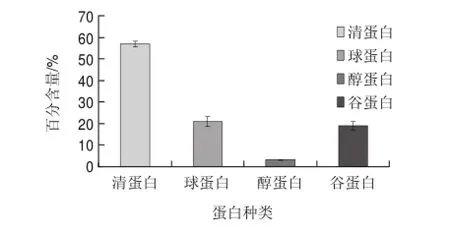
图 2 米糠Osboren方法提取后各蛋白质组分的百分含量Fig.2Contents of albumin, globulin, gliadin and glutenin in total proteins from rice bran
采用Osboren方法提取清蛋白、球蛋白、醇蛋白、谷蛋白,测定各蛋白质组分含量,求得各蛋白质组分占总提取蛋白质含量的百分比,结果如图2所示。提取出的米糠蛋白中清蛋白含量最多,占提取蛋白总量的56.93%,球蛋白、谷蛋白次之,分别占20.84%和19.06%,醇溶蛋白含量最少,占3.167%。采用Osboren方法提取米糠中的4种蛋白质,大约只能提取11%左右米糠中的蛋白,在残渣和废液中仍残留约占原料8%左右的蛋白质。
2.2 米糠蛋白等电点的确定
采用福林-酚法,根据蛋白质在等电点处蛋白溶解性最低的原理,通过测定沉淀离心后上清液的蛋白质的质量浓度来测定米糠蛋白的等电点,如图3所示。

图 3 不同pH值缓冲溶液体系离心沉淀后上清液的蛋白含量Fig.3Effect of buffer solution pH on protein content in the centrifugal supernatants of different rice bran proteins
由图3可知,4种蛋白在不同pH值缓冲溶液体系中,经过沉淀离心后上清液的蛋白含量。清蛋白、球蛋白、醇蛋白、谷蛋白分别在pH 4.0、4.0、5.0、4.6处上清液中的蛋白含量最低,可以说明清蛋白、球蛋白、醇蛋白、谷蛋白的等电点分别是pH 4.0、4.0、5.0、4.6,从图中也可以间接的反应出4种蛋白的在不同pH值缓冲溶液体系中的溶解特性。
清蛋白在pH≥9.0的缓冲溶液体系中,溶解性突然增大,由于清蛋白在pH≥9.0的碱性体系中,清蛋白发生了可逆变性导致的。谷蛋白在pH≥9.0的碱性体系中,溶解性也有所增加。谷蛋白也发生了可逆变性而导致的。pH值离蛋白质的等电点越远,水化作用越弱,蛋白质分子的分散性越好,溶解度越大,这与其他蛋白性质一样。
2.3 米糠蛋白的持水性

图 4 温度对米糠蛋白持水性的影响Fig.4Effect of temperature on the water-binding capacity of rice bran proteins
由图4可知,温度20~90℃之间,随着温度的升高,蛋白质的吸水性呈现先增加后降低的趋势。可能是随着温度的继续升高,氢键作用和离子化基团结合水的能力下降,从而导致蛋白质结合水的能力下降。同时,也可能蛋白质受热变性导致溶解度降低,从而影响了蛋白质结合水的能力[13]。从图中还可以看出,清蛋白的持水性最大,其次是谷蛋白,再次是球蛋白和醇蛋白,可能由于清蛋白是水溶性蛋白,其他3种蛋白的溶解度由于受到溶解介质的离子强度和溶液pH值的影响,其结合水的能力发生变化。
2.4 米糠蛋白的乳化性
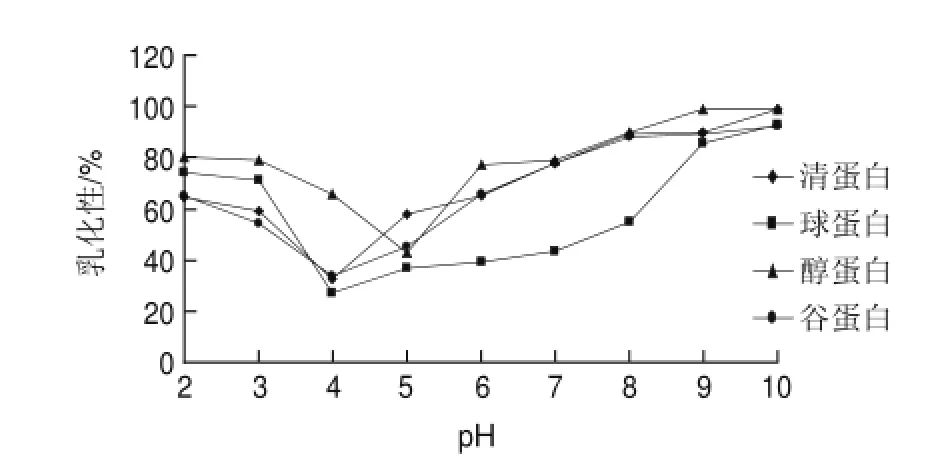
图 5 pH值对米糠蛋白乳化性的影响Fig.5Effect of pH on the emulsibility of rice bran proteins
表面疏水性是影响蛋白乳化性的重要因素,米糠蛋白的疏水基少,使其与油脂的结合性比较低。由图5可知,清蛋白、球蛋白、谷蛋白的乳化性在pH4的时候最低,pH值小于4的时候,乳化性随pH值的降低而升高,pH值大于4时乳化性逐渐升高;醇蛋白的乳化性pH5的时候最低,pH值小于5的时候乳化性随pH值的降低而升高,pH值大于5时乳化性逐渐升高。在pH10时乳化性都达到最大。醇蛋白在不同pH值的条件下乳化性都略高于其他3种蛋白,可能是醇蛋白中疏水性的氨基酸略高的原因[13]。pH4.0~5.0时蛋白质溶解度低,蛋白质在油水界面吸附扩散受到控制。然而,pH6.0~11.0范围内蛋白质溶解度增加,活化能阻碍不让蛋白迁移发散。蛋白质溶解度的初步增加推动了油相和水相的交互作用。然而,由于溶解度增加,造成蛋白质质量浓度的进一步增加导致了在水相蛋白的积累。pH值高时溶解度的进一步增加导致乳化性不在有明显的升高甚至会有所降低。
2.5 米糠蛋白的起泡性
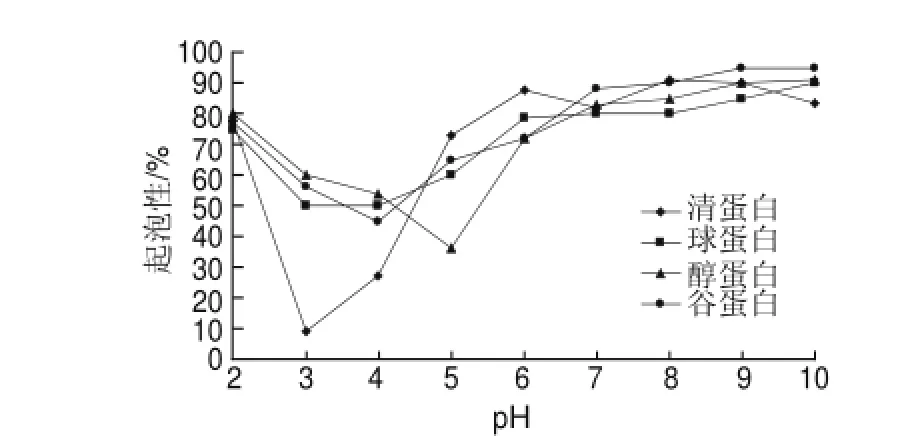
图 6 pH值对米糠蛋白起泡性的影响Fig.6Effect of pH on the foaming capacity of rice bran proteins
蛋白水解物的起泡方法的测定是在有大量气体存在时搅打蛋白溶液,搅打能产生较为激烈的机械应力和剪切作用,使气体卷入液体形成气泡并使其分散的更为均匀。较高的溶解性、亲水性分子可以提高界面的交互作用,从而影响起泡能力。
由图6可知,在pH值接近4种蛋白等电点时,其起泡性差。4种蛋白在碱性环境下和在酸性条件下的起泡性要好。这是由于蛋白分子在酸性或碱性条件下带净正或净负电荷,导致分子间静电斥力增加并削弱了分子的疏水相互作用,分子柔性增大,有利于其更快地吸附至气液界面从而增强了起泡能力[14]。
2.6 4种米糠蛋白的SDS-PAGE电泳分析

图 7 米糠蛋白SDS-PAGE电泳图谱Fig.7SDS-PAGE of protein isolates from rice bran
采用14%分离胶、4%浓缩胶对4种蛋白进行SDSPAGE电泳分析,用Alphalmager HP凝胶成像系统拍照得到的电泳图谱如图7所示,清蛋白和球蛋白为代谢活性物质,是由低分子质量的蛋白亚基构成,清蛋白的亚基分子质量分布大概在95.43、76.51、52.85kD、球蛋白亚基的分子质量大概分布在103.12、76.51kD;醇蛋白和谷蛋白是贮藏蛋白质,醇蛋白是由一条肽链通过分子间的二硫键连接而成的,谷蛋白是由多肽链彼此通过二硫键连接而成的大分子组成[15]。醇蛋白亚基的分子质量大概分布在14kD,谷蛋白亚基的分子质量大概分布在36.29、20.00、14.00kD。
3 结 论
3.1 米糠中清蛋白、球蛋白、醇蛋白、谷蛋白占米糠蛋白总量依次是56.93%、20.84%、3.167%、19.06%。
3.2 清蛋白、球蛋白、醇蛋白、谷蛋白的等电点依次是pH4.0、4.0、5.0、4.6。
3.3 米糠蛋白的持水性随温度的升高而增加,清蛋白的持水性最大,其次是谷蛋白,再次是球蛋白和醇蛋白。3种蛋白乳化性在等电点处比较低,醇蛋白的乳化性最高。4种蛋白的起泡性在等电点附近最差,清蛋白的起泡性尤其不佳。
3.4 米糠蛋白中清蛋白主要由分子质量95.43、76.51、52.85kD的亚基构成,球蛋白由分子质量103.12、76.51kD亚基构成,醇蛋白由分子质量14kD亚基构成,谷蛋白由分子质量36.29、20.00、14.00kD的亚基构成。
[1] 姚惠源, 周素梅, 王立, 等. 米糠与米糠蛋白质的开发与利用[J]. 无锡轻工大学学报, 2005(3): 312-317.
[2] HERNANDEZ N, RODRIGUEZ-ALEGRIA M E, GONZALEZ F. Lopez-munguia A[J]. J Am Oil Chem Soc, 2000, 77(2): 177-180.
[3] MORITA T. Mass production method for rice protein isolate and nutritional evaluation[J]. J Food Sci, 1993, 58(3): 1393-1396.
[4] 冯明珠, 何聪芬, 赵华, 等. 燕麦麸蛋白质的Osboren分类及SDSPAGE电泳分析[J]. 食品工业科技, 2007, 28(1): 77-79.
[5] ADEBIYI A P, ADEBIYI A O, HASEGAWA Y, et al. Isolation and characterization of protein fractions from deoiled rice bran[J]. Eur Food Res Technol, 2009, 228(3): 391-401.
[6] 黄晓钰, 刘邻渭. 食品化学综合实验[M]. 北京: 中国农业大学出版社, 2002.
[7] 王雪飞. 酶法制备分离蛋白的研究[D]. 哈尔滨: 东北农业大学, 2003.
[8] 刘杨. 张占雄. 多肽含量的测定方法的比较[J]. 内蒙古石油化工, 2008(5): 65.
[9] 刁静静, 孔保华, 彭新颜, 等. 乳清蛋白水解物功能性质的研究[J].食品科技, 2010(8): 89-93.
[10] PEARCE K N, KINSELLA J E. Emulsifying properties of proteins: evaluation of a turbidimetric technique[J]. J Agric Food Chem, 1978, 26(3): 716-723.
[11] GUAN Xiao, YAO Huiyuan, CHEN Zhengxing, et al. Some functional properties of oat bran protein concentrate modif i ed by trypsin[J]. Food Chemistry, 2007, 101(3): 163-170.
[12] 郭尧君. 蛋白质电泳实验技术[M]. 北京: 科学出版社, 1999: 132-140.
[13] 范三红, 刘艳荣, 原超. 南瓜籽蛋白质的制备及其功能性质研究[J].食品科学, 2010, 31(16): 97-99.
[14] 曲晓婷, 张名位, 温其标, 等. 米糠蛋白提取工艺的优化及其特性研究[J]. 中国农业科学, 2008, 41(2): 525-532.
[15] HAMADA J S. Characterization and functionl propeties of rice bran proteins modifed by commercial exoproteases and endoprleasea[J]. J Food Science, 65(2): 305-310.
Extraction and Functional Properties of Four Proteins from Rice Bran
ZHANG Min1,2,ZHOU Mei2,WANG Chang-yuan2,3
(1. School of Food and Chemical Engineering, Beijing Technology and Business University, Beijing 100037, China;2. College of Food Science, Northeast Agricultural University, Harbin 150030, China;3. College of Food Science, Heilongjiang Bayi Agricultural University, Daqing 163000, China)
Four protein isolates including albumin, globulin, gliadin and glutenin were extracted from rice bran using the Osbron method and their functional properties were evaluated. Albumin, globulin, gliadin and glutenin accounted for 56.93%, 20.84%, 3.167% and 19.06% of total proteins in rice bran, respectively, and their isoelectric points were 4.0, 4.0, 5.0 and 4.6, respectively. Comparative evaluation of functional properties showed that albumin possessed the highest waterbinding capacity but the weakest foaming capacity at the isoelectric point, and glutenin had the highest emulsibility. SDSPAGE suggested that the subunit molecular weights were 95.43, 76.51 kD and 52.85 kD for albumin, 103.12 kD and 76.51 kD for globulin, 14 kD for gliadin, and 36.29, 20.00 kD and 14.00 kD for glutenin, respectively.
rice bran proteins;extraction;functional properties;subunit
TS201.4;TS210.9
A
1002-6630(2013)01-0018-04
2011-12-28
国家自然科学基金项目(31101387);十二五国家科技支撑计划项目(2012BAD34B00)
张敏(1972ü),女,教授,博士,研究方向为农产品贮藏与加工。E-mail:xzm7777@sina.com
