基于Teflon/纳米金的新型NO微传感器制备及性能分析*
2013-03-04吴汪泽卢忠心
吴汪泽,熊 涛,甘 甜,卢忠心,乔 治△
(1.湖北省武汉市中心医院检验科 430014;2.武汉大学医学院微生物教研室,武汉430071;3.信阳师范学院化学化工学院,河南信阳464000)
一氧化氮(nitric oxide,NO)是生物机体中一种重要的生物信息分子和效应分子[1]。它在舒张血管平滑肌、传递神经间信息、抑制血小板聚集、介导炎症和免疫反应等生理和病理过程均发挥着重要的作用[2]。因此其准确检测对NO作用机制的研究具有重要的意义。电化学方法是目前惟一能够对生物体内NO释放过程进行直接、实时、连续检测的方法[3]。本实验采用原位化学种子-生长技术,制备了一种基于纳米金柱电极的NO电化学微传感器,并通过修饰高分子材料Teflon膜,极大地提高了传感器的选择性和稳定性,现报道如下。
1 材料与方法
1.1 仪器与试剂 MonoStat电化学工作站(美国DTI公司),AB204-E分析天平(瑞士 Mettler Toledo公司),QB-206旋转摇床(海门其林贝尔仪器制造有限公司),DHG-9023A干燥箱(上海精宏仪器有限公司)。直径为150μm的玻璃纤维(美国WPI公司),Teflon AF2400(美国DuPont公司),氯金酸、盐酸羟胺、硼氢化钾和柠檬酸钠均购于中国医药集团上海化学试剂公司,其他试剂均为国产分析纯,实验用水为双蒸水。
1.2 方法
1.2.1 NO标准溶液的制备 如文献[4]所述。
1.2.2 纳米金溶液的制备 将1mL 1%氯金酸溶于90mL双蒸水中,搅拌1min后加入2mL 38.8mmol/L柠檬酸钠溶液,搅拌1min。再加入1mL现配的0.075%硼氢化钾溶液,搅拌5min,4℃避光保存[5]。
1.2.3 纳米金柱的制备 将长度为1.5cm的玻璃纤维依次置于10mmol/L十六烷基三甲基溴化铵(CTAB)溶液30℃浸泡1h、纳米金溶液中4℃过夜;然后置于1.5mL双蒸水中,加入20mL 0.2mol/L 氯金酸和10μL 0.2mol/L盐酸羟胺,于摇床上旋转30min后洗涤;重复以上操作4次后自然晾干,玻璃纤维表面呈金黄色,即制得纳米金柱。
1.2.4 修饰电极的制备 用银导电胶将细铜丝粘连到纳米金柱的一端,然后用10μL移液器枪头对其加以固定,并用环氧树脂胶将两端粘结封闭。将露出的纳米金柱剪至长度为5 mm,即制得纳米金修饰玻璃纤维电极。将电极在1%Teflon溶液中浸泡10s后,100℃烘烤2h,即制得NO微传感器。
1.2.5 检测方法 采用三电极系统:Ag/AgCl为参比电极,铂丝为对电极和所制备的电极为工作电极。0.01mol/L磷酸盐缓冲液(PBS)(pH 7.2)作为底液,利用安培响应法对NO进行测定,考察该NO微传感器对NO的电化学响应及其灵敏度、线性范围、重现性和稳定性等。
2 结 果
2.1 纳米金柱微电极上NO的电化学响应 加入360nmol/L的NO标准溶液,纳米金柱微电极上的氧化峰电流很大(图1曲线a),Teflon修饰后电极上的氧化峰电流减小(图1曲线b);Teflon修饰后电极的背景噪声明显减小,且背景基线显著降低。由于纳米金柱具有较大的有效表面积,为NO的电化学氧化提供更多的活性位点,因此纳米金柱对NO的氧化有优异的电催化作用,见图1。
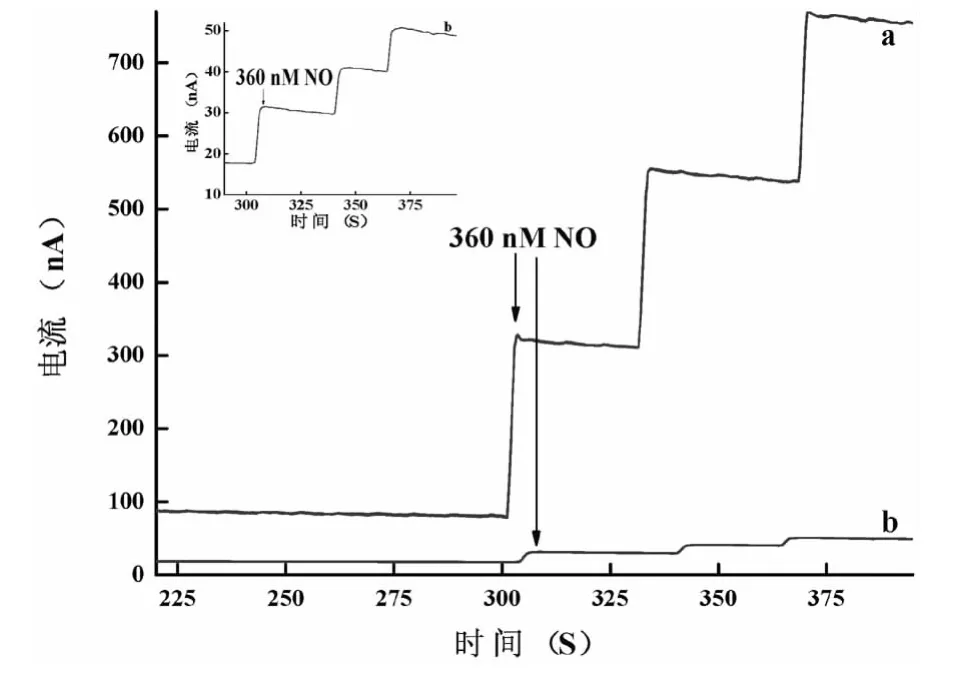
图1 不同修饰电极上NO的安培响应
2.2 NO微传感器的性能分析 在10mL半密闭电解池中以5mL PBS作为底液,插入电极,在氮气保护下,加入一定体积的NO标准溶液到底液中,利用安培响应法对NO进行测定。随着NO标准溶液的连续加入,其氧化峰电流迅速增加并很快达到稳态,并与加入NO标准溶液的量呈正相关。在7.2 nmol/L至 11.7μmol/L范围内呈良好的线性关系(r=0.998),线性方程是I/nA=15.028+0.036CNO,检出限是3.6nmol/L(S/N=3)。同一支 NO微传感器连续5次相同检测,相对标准差(RSD)为2.4%,将同批制备的5支NO微传感器在相同条件下检测,RSD为4.6%,表明该传感器具有良好的重现性。将传感器在室温下放置7d,其响应电流是放置前的95%,提示其稳定性优异。干扰试验的结果显示:2 μmol/L的 NO2-、多巴胺(DA)、抗坏血酸(AA)和 NH4+,或20μmol/L的NO3-、尿酸(UA)、葡萄糖等物质对NO的检测不产生干扰(信号变化小于5%)。因此,该传感器具有良好的选择性,可用于检测生物样品中NO含量。
3 讨 论
硝酸甘油作为治疗突发性心绞痛的特效药已沿用了100多年,其药理作用是硝酸甘油在生理条件下释放出的NO可以舒张心血管平滑肌,近年逐渐发现NO在生物体内发挥着更多重要的作用。NO作为一种重要的生物信使分子,参与血管调节、神经传递、炎症与免疫等过程,其广泛分布在脑、血管、肺、生殖器等多种组织器官中,且与高血压、心肌缺血、动脉硬化和哮喘等系统性疾病有关[6-8]。对NO的认识首先要归功于微量分析技术的发展,因为NO在机体内的浓度通常处于纳摩尔级水平,且NO半衰期为5s,因而直接检测难度极大[9]。因此,准确地分析NO在生物机体中的浓度变化,已成为进一步揭示NO功能的必要手段。
建立准确、简便、快速、灵敏的NO检测方法成为医学界普遍关心的问题,重氮反应法是目前应用最为广泛的方法之一,其原理是通过检测NO的代谢终产物NO2-和NO3-来间接推算出NO的浓度。但机体中NO2-和NO3-不完全来源于NO代谢,这就造成该方法存在较大误差[10]。电化学方法能够直接、实时、连续检测生物体内释放的NO,其特点是灵敏度高、响应快、操作简单、选择性好、仪器设备成本低[11]。安培响应法是在工作电极和参比电极间施加一个固定电位,通过检测NO氧化时所产生的微小的氧化峰电流,氧化峰电流与NO的浓度呈成正相关。其具有灵敏度高和响应时间快等优点,可用于检测生物体内NO浓度随时间变化的情况[12]。
纳米金具有良好的生物兼容性和优异的电催化性能[13],本研究选择直径为150μm的柱状玻璃纤维为基底材料,采用原位化学种子-生长技术,制备了一种基于纳米金柱的NO电化学微传感器。采用快速化学还原法制备纳米金晶核,并将晶核作为种子吸附在玻璃纤维表面;然后在稳定的生长溶液中将氯金酸还原为金单质,随着金单质在纳米金晶核上不断析出,纳米金颗粒逐渐变大,从而实现纳米金颗粒的可控生长。Teflon是目前已知所有聚合物中透气性最高的高分子化合物[14],允许NO以与样品中的NO浓度成比例的速度通过Teflon膜达到电极表面并被氧化,大大加快了传感器的响应时间。Teflon膜还可以防止蛋白质等一些生物分子在电极表面的非特异性吸附而引起的电极表面钝化,从而提高电极的稳定性和电极的使用寿命。本研究还考察了体内存在的一些电活性强的物质对微传感器检测的影响,发现微传感器不受高浓度的亚硝酸盐、硝酸盐、多巴胺、抗坏血酸、铵盐和L-精氨酸等生物小分子的干扰,信号变化均小于5%,且干扰实验前后加入同浓度的NO标准溶液,其安培响应无显著差别。因此,本方法制备的微传感器表现出灵敏度高、线性范围宽、重现性好和抗干扰能力强等优点。
综上所述,NO电化学微传感器的使用为NO的实时检测和生物样品的检测提供了一种实用、简便的方法,不仅能够从本质上揭示某些生理现象,也为探索相关疾病的监控和病理研究提供了技术保障。
[1]赵保路.一氧化氮自由基[M].北京:科学出版社,2008:15.
[2]Bogdan C.Nitric oxide and the immune response[J].Nat Immunol,2001,2(10):907-916.
[3]陈晓霞,易洪潮,王颖,等.一氧化氮电化学传感器及其在生物医学中的应用[J].现代科学仪器,2006,6(3):17-20.
[4]Zheng DY,Hu CG,Peng YF,et al.A carbon nanotube/polyvanillin composite film as an electrocatalyst for the electrochemical oxidation of nitrite and its application as a nitrite sensor[J].Electrochim Acta,2009,54(21):4910-4915.
[5]Brown KR,Walter DG,Natan MJ.Seeding of colloidal au nanoparticle solutions improved control of particle size and shape[J].Chem Mater,2000,12(2):306-313.
[6]武宇阳,明钰,姚尚龙.吸入一氧化氮对内毒素性急性肺损伤大鼠的作用[J].华中科技大学学报:医学版,2012,41(1):41-44.
[7]王立生,潘令嘉,施理,等.苏州市1 453名女性血清一氧化氮与高血压关系的研究[J].中华流行病学杂志,2011,32(8):4-6.
[8]张诗卉,丁建松,焦阳,等.双歧杆菌的完整肽聚糖对LPS激活裸鼠腹腔巨噬细胞的影响[J].中华微生物学和免疫学杂志,2000,20(1):760-763.
[9]Hall CN,Garthwaite J.What is the real physiological NO concentration in vivo[J].Nitric Oxide,2009,21(2):92-103.
[10]Sun J,Zhang XJ,Broderick M,et al.Measurement of nitric oxide production in biological systems by using Griess Reaction assay[J].Sensors,2003,3(8):276-284.
[11]Bryan NS,Grisham MB.Methods to detect nitric oxide and its metabolites in biological samples[J].Free Radic Bioc Biol Med,2007,43(5):645-657.
[12]杜富滢,黄卫华,吴文展,等.新型微盘传感器的研制及用于单细胞释放NO监测[J].高等学校化学学报,2007,28(6):1069-1071.
[13]陈静,胡文成,杜凯,等.纳米多孔金属的制备方法研究进展[J].材料导报,2010,24(16):24-27.
[14]Cha W,Meyerhoff ME.Enhancing the selectivity of amperometric nitric oxide sensor over ammonia and nitrite by modifying gas-permeable membrane with teflon AF[J].Chem Analityczna,2006,51(6):36-44.
[15]Kamei K,Mie M,Yanagida Y,et al.Construction and use of an electrochemical NO sensor in a cell-based assessing system[J].Sensors and Actuators B,2004,99(1):106-112.
