肾动脉各级血流多普勒参数反映肝硬化病程
2013-03-03楼丽萍徐晓飞
楼丽萍,徐晓飞,王 洁,方 蕾
(浙江省诸暨市人民医院超声科,浙江诸暨311800)
·论 著·
肾动脉各级血流多普勒参数反映肝硬化病程
楼丽萍,徐晓飞,王 洁,方 蕾
(浙江省诸暨市人民医院超声科,浙江诸暨311800)
目的应用彩色多普勒超声分析肾动脉血流动力学信息,了解肝硬化病情的发展。方法选择肝硬化患者60例为肝硬化组,根据病程进展分为Ⅰ、Ⅱ、Ⅲ组。同期20位健康体检者为对照组,运用彩色多普勒超声进行肾动脉检查,并记录血流参数。结果随着肝硬化病情的逐渐发展,肾主动脉(main renal artery,MRA)、段动脉(segmental renalartery,SRA)、叶间动脉(interlobar renal artery,IRA)的阻力指数(resistance index,RI)逐渐增加,差异均有统计学意义(FMRA=41.34,PMRA=0.000;FSRA=26.41,PSRA=0.000;FIRA=71.95,PIRA=0.000);MRA、SRA、IRA的搏动指数(pulsatility index,PI)逐渐增加,差异均有统计学意义(FMRA=51.90,PMRA=0.000;FSRA=72.45,PSRA=0.000;FIRA=125.31,PIRA=0.000)。血流量均显著降低,差异有统计学意义(F=18.66,P=0.000)。结论通过监测肝硬化进程中肾动脉血流参数,可以为临床监护病情、客观评估病情和预后提供有力证据。
肝硬化;肾动脉;超声检查,多普勒,彩色
肝硬化是一种由于肝细胞弥漫性损伤、坏死,纤维组织增生,假小叶形成的慢性进行性疾病。肝硬化初期肝功能代偿较强,无明显临床症状,而当肝功能失代偿时,会出现门脉高压,腹腔积液压迫血管,继而引起全身循环血液变化和多系统受累[1]。根据Child-Pugh改良分级法,肝硬化的发展可分为Ⅲ期,肝功能代偿期,肝功能失代偿期,肝肾综合征[2]。病毒性肝炎是导致肝硬化的主要原因,随着病毒性肝炎的广泛传播,肝硬化的患病率也逐渐增加[3]。肝硬化虽为常见病,却无法治愈。虽然病理检查对于肝硬化分期的准确率较高,但是病理活组织检查作为一种有创性检查难以让患者接受,因此,应寻找一种新型的确定肝硬化分期的方法[4]。由于肾脏是过滤全身血液的主要器官,肝硬化病程的不断发展可能会引起肾动脉血流参数的改变。故本研究运用彩色多普勒超声对肝硬化患者的肾主动脉(main renal artery,MRA)、段动脉(segmental renal artery,SRA)、叶间动脉(interlobar renal artery,IRA)的血流参数进行分析,旨在为临床诊断肝硬化分期和治疗提供有效信息。
1 资料与方法
1.1 一般资料:选择我院于2011年3月—2012年 3月确诊的不同程度肝硬化患者60例作为研究对象,排除高血压、糖尿病和肾源性疾病和严重心肺疾病,男性33例,女性27例,年龄36~50岁,平均(43.5±4.1)岁。根据Child-Pugh改良分级法分为Ⅰ~Ⅲ组,Ⅰ组(肝功能代偿期)20例,Ⅱ组(肝功能失代偿期)20例,Ⅲ组(肝肾综合征期)20例[1]。同期选择健康体检者20例为正常组,男性12例,女性8例,年龄40~52岁,平均(46.5±3.7)岁。各组一般资料差异无统计学意义(P>0.05),具有可比性。
1.2 仪器与方法:使用GE LOGIQ 7和SIEMENS Sequoia 512超声诊断仪,探头频率3.5~4.5MHz,多普勒夹角<45°。检查者仰卧位,部分取侧卧位,静息状态下,进行MRA,SRA,IRA的血管超声检查。同时描记MRA、SRA、IRA的血流频谱,测量阻力指数(resistance index,RI)和搏动指数(pulsatility index,PI);根据血流量公式Q=Ⅱ×D2/4×Vm× 60(D为主干肾血管的腔径,Vm为血流速度均值)计算血流量,所有数据均取3个心动周期计算平均值。
1.3 统计学方法:应用SPSS17.0统计学分析软件进行数据处理,计量资料以±s表示,组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
由于左右二侧肾脏血管的血流变化相差不明显,故合并二侧肾动脉的血流参数并取其均值计算。
2.1 Ⅰ~Ⅲ组与正常组MRA、SRA和IRA的RI比较:随着肝硬化病程的逐渐严重,MRA、SRA、IRA的RI逐渐增加,差异均有统计学意义(FMRA=41.34,PMRA=0.000;FSRA=26.41,PSRA=0.000;FIRA= 71.95,PIRA=0.000)。进一步两两分析显示,除正常组和I组间的MRA、SRA和IRA数值近似,差异无统计学意义(PMRA=0.584;PSRA=0.633;PIRA= 0.853),Ⅰ组和Ⅱ组MRA、SRA的RI数值近似,差异无统计学意义(PMRA=0.071;PSRA=0.232)之外,其余两两间比较差异均具有统计学意义(P<0.05)。肾脏MRA血流典型频谱可以看出Ⅲ组RMRA血管的RI、PI明显大于Ⅰ组。见表1,图1。2.2 Ⅰ~Ⅲ组与正常组MRA、SRA和IRA的PI比较:随着肝硬化病程的逐渐严重,MRA、SRA、IRA的PI逐渐增加,差异均有统计学意义(FMRA=51.90,PMRA=0.000;FSRA=72.45,PSRA=0.000;FIRA= 125.31,PIRA=0.000)。进一步两两分析显示,除正常组和I组间的MRA、SRA和IRA数值近似,差异无统计学意义(PMRA=0.062;PSRA=0.592;PIRA= 1.000)之外,其余两两间比较,差异有统计学意义(P<0.05)。见表2。
2.3 Ⅰ~Ⅲ组与正常组MRA、SRA和IRA的Q比较:随着肝硬化病程的逐渐严重,Q均显著降低,经方差分析,差异均具有统计学意义(F=18.66,P= 0.000)。见表3。
表1 Ⅰ~Ⅲ组与正常组各级肾动脉RI比较 (±s)
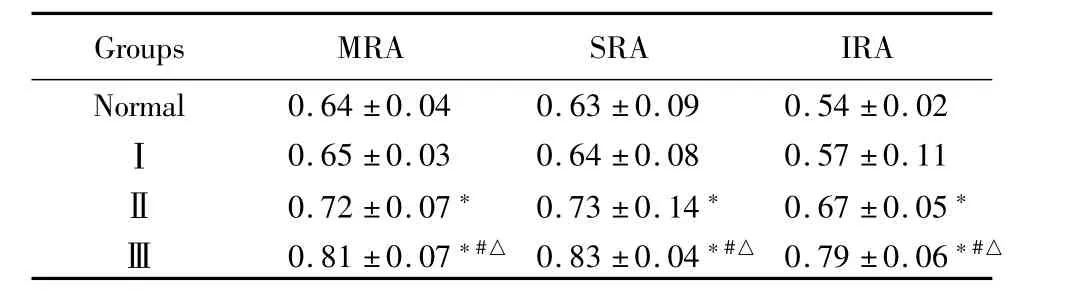
表1 Ⅰ~Ⅲ组与正常组各级肾动脉RI比较 (±s)
*P<0.05 vs normal group #P<0.05 vs groupⅠ △P<0.05 vs groupⅡby ANOVA
Groups MRA SRA IRA Normal 0.64±0.04 0.63±0.09 0.54±0.02Ⅰ0.65±0.03 0.64±0.08 0.57±0.11Ⅱ0.72±0.07*0.73±0.14*0.67±0.05*Ⅲ0.81±0.07*#△0.83±0.04*#△0.79±0.06*#△
表2 Ⅰ~Ⅲ组与正常组各级肾动脉PI比较 (±s)

表2 Ⅰ~Ⅲ组与正常组各级肾动脉PI比较 (±s)
*P<0.05 vs normal group #P<0.05 vs groupⅠ △P<0.05 vs groupⅡby ANOVA
Groups MRA SRA IRA Normal 1.04±0.22 1.02±0.08 0.81±0.12Ⅰ1.07±0.17 1.05±0.14 0.83±0.15Ⅱ1.37±0.21*#1.30±0.22*#1.32±0.10*#Ⅲ1.76±0.33*#△1.58±0.24*#△1.43±0.16*#△
表3 Ⅰ~Ⅲ组与对照组Q参数比较 (±s)
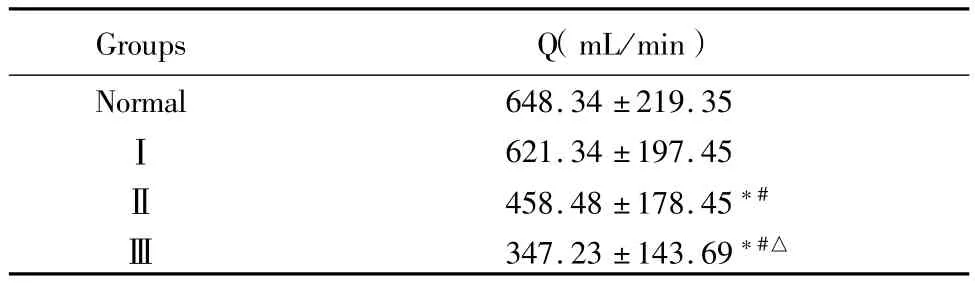
表3 Ⅰ~Ⅲ组与对照组Q参数比较 (±s)
*P<0.05 vs normal group #P<0.05 vs groupⅠ △P<0.05 vs groupⅡby ANOVA
Groups Q(mL/min)Normal 648.34±219.35Ⅰ621.34±197.45Ⅱ458.48±178.45*#Ⅲ347.23±143.69*#△

图1 肾脏MRA血流典型频谱A.Ⅰ组的肾脏MRA血流频谱;B.Ⅲ组的肾脏MRA血流频谱
3 讨 论
肝硬化从肝功能代偿期发展到肝功能减退和肝肾综合征,其间经历着一系列较长的病理生理的变化。目前肝硬化从代偿发展为肝肾综合征的具体机制尚不明确,但有学者认为与肾交感神经张力增高和肾素-血管紧张素-醛固酮系统激活有很大关系[5]。一方面,肝硬化失代偿形成门脉高压后,腹腔积液形成和肝功能减低引起的激素灭活减少均造成血管扩张,促使大量的血液瘀积在周围血管床,有效循环血量减少[6-7]。循环血量的减少引起肾内血流量的减少,则进一步促进肾素血管紧张素的释放,肾血管收缩[8]。另一方面,随着肝功能的逐渐衰退,灭活激素和排泄毒物的减少,损害肾脏和加重肾血管收缩的毒性物质增加,血流量减少,血管阻力增加,肾的排泄和代谢能力下降,甚至可能导致肾衰竭[9]。
目前,学者们在肝炎发展为肝硬化的病理生理的过程研究颇多,并且已经取得了比较系统全面的认识,建立在肝硬化的病理生理基础知识上,本文想进一步利用影像学技术对肝硬化的分期进行研
究[10]。虽然,肝硬化的活组织病理学检查是目前诊断肝硬化分期最准确的方法,然而由于其方法对人体带来的创伤使得其使用具有一定的局限性,因此在无创的领域里对其早期准确分期并及时给予相应的治疗还是一大难题[11]。随着影像学的普及,其简单、方便、无创的特点已深入人心[12]。从肝硬化的病理生理学可知,肝硬化疾病主要是通过激素、神经等途径改变全身血流状态[13]。由于肾脏是过滤全身血液的主要器官,肾动脉对肝硬化病变导致的血流动力学的改变相对于其他动脉更为敏感[14]。故本文采用彩色多普勒超声采集肝硬化3期肾动脉的血流参数,通过对其参数的分析,比较随疾病发展肾脏血流动力学发生的相应变化。
本研究结果显示,对照组的各级肾血管血流参数正常[(Q=(648.34±219.35)mL/min)];肝硬化Ⅰ组肾的血流频谱和血流参数尚正常[(Q=(621.34±197.45)mL/min,RI=0.64±0.04)],全身的血液循环发生微小改变;而Ⅱ~Ⅲ组,肝功能失代偿,血流动力学发生较大的变化,肾血流量Q明显减少[(347.23±143.69)mL/min)],血管的RI增加0.81±0.07。提示当肝硬化发展到Ⅱ~Ⅲ期时,肾动脉血流灌注损伤,呈“低流高阻”型。肝硬化Ⅰ~Ⅲ组间的RI和PI均显著增加,Q显著降低,提示随着肝硬化病程进展,易引起肾血流动力学的改变,进而造成全身微血管的损伤。这种微血管的损伤造成的血管阻力的增加也进一步可以引起较大的血管出现低灌高阻的现象[15]。然而彩色多普勒测得血流参数还可能受高血压、年龄等其他因素的影响。本研究仅显示了肝硬化不同分组中肾动脉的血流参数随肝硬化病情发展的变化情况,肾动脉血流参数的进一步研究需要待扩大样本数后进行分析。
综上所述,通过对肝硬化组和对照组肾血流动力学参数的监测和分析,发现随着肝硬化的发展逐渐严重,各级肾动脉的血流量逐渐降低,而PI和RI逐渐升高。这将为临床准确分期、治疗、客观地评价肾功能和评估预后提供较大帮助。
[1]LUTZ HH,GASSLER N,TISCHENDORF FW,et al.Doppler ultrasound of hepatic blood flow for noninvasive evaluation of liver fibrosis compared with liver biopsy and transient elastography[J].Dig Dis Sci,2012,57(8):2222-2230.
[2]韦虹,刘连娟.肝硬化患者血浆尾加压素水平与肾动脉阻力的变化[J].实用临床医药杂志,2010,14(6):25-27.
[3]ANDERSEN PE.Patient selection and preparation strategies for the use of contrastmaterial in patientswith chronic kidney disease[J].World JRadiol,2012,4(6):253-257.
[4]沈惠芬.超声用于诊断早期肝硬化的临床分析[J].北方药学,2012,9(2):57.
[5]汤红,唐德萍.彩色多普勒超声检查肝硬化患者肾动脉血流参数的价值[J].实用临床医药杂志,2010,13(4):280-281.
[6]金丽,王淑影,张桂香,等.超声对Budd-Chiari综合征与肝硬化的诊断及鉴别诊断[J].中国社区医师,2012,14(2):285-286.
[7]冯建丽,周敏,张丽君,等.彩色多普勒超声诊断肝硬化的价值[J].中国基层医药,2010,17(7):927-928.
[8]FRANCOZ C,GLOTZ D,MOREAU R,et al.The evaluation of renal function and disease in patients with cirrhosis[J].J Hepatol,2010 52(4):605-613.
[9]王丽萍,张新力.组织多普勒与脉冲多普勒Tei指数对肝硬化患者左心功能改变的对比研究[J].临床超声医学杂志,2010,12(10):676-679.
[10]YILMAZ S,KAYAALP C,BATTALOGLU B,et al.Hepatic vein stenosis developed during living donor hepatectomy and corrected with peritoneal patch technique:a case report[J].Transplant Proc,2012,44(6):1754-1756.
[11]ESPINOSA MD,NOGUERAS F,OLMEDO C,et al. Hepatopulmonary syndrome among cirrhotic candidates for liver transplantation[J].Transplant Proc,2012,44(6):1508-1509.
[12]HAN JY,CHO JH,KWON HJ,et al.Predicting portal hypertension as assessed by acoustic radiation force impulse:correlations with the Doppler ultrasound[J].Br JRadiol,2012,85(1016):e404-409.
[13]POPOV D,KRASTEVA R,IVANOVA R,et al.Doppler parameters of hepatic and renal hemodynamics in patients with liver cirrhosis[J].Int JNephrol,2012,6(3):961-965.
[14]LAIW,LU SC,LIGY,et al.Anticoagulation therapy prevents portal-splenic vein thrombosis after splenectomy with gastroesophageal devascularization[J].World J Gastroenterol,2012,18(26):3443-3450.
[15]TRAN WT,IRADJI S,SOFRONI E,et al.Microbubble and ultrasound radioenhancement of bladder cancer[J].Br JCancer,2012,107(3):469-476.
(本文编辑:赵丽洁)
R657.31
B
1007-3205(2013)06-0716-03
2012-08-06;
2012-09-10
楼丽萍(1978-),女,浙江诸暨人,浙江省诸暨市人民医院主治医师,从事医学超声诊断研究。
10.3969/j.issn.1007-3205.2013.06.036
