树突状细胞在部分乳腺癌中的表达及意义
2013-03-03罗文彦王翀奎
成 媛,罗文彦,王翀奎,王 荣,张 梁,赵 松
(1.河北医科大学西山校区护理基础部病理教学组,河北石家庄050228;2.河北医科大学西山校区教务处,河北石家庄050228;3.河北医科大学西山校区护理基础部护理教研组,河北石家庄050228;
4.河北医科大学基础医学院病理学教研室,河北石家庄050017)
·论 著·
树突状细胞在部分乳腺癌中的表达及意义
成 媛1,罗文彦1,王翀奎2,王 荣3,张 梁1,赵 松4*
(1.河北医科大学西山校区护理基础部病理教学组,河北石家庄050228;2.河北医科大学西山校区教务处,河北石家庄050228;3.河北医科大学西山校区护理基础部护理教研组,河北石家庄050228;
4.河北医科大学基础医学院病理学教研室,河北石家庄050017)
目的通过测定乳腺癌组织中树突状细胞的计数,探讨其与乳腺癌临床病理特征(病理分类、组织分化程度、腋窝淋巴结转移、患者年龄、月经状况)的关系,阐明乳腺癌中树突状细胞的分布表达与其临床预后的相关性。方法应用免疫组织化学(immunohistochemistry,IHC)方法检测60例乳腺癌组织中树突状细胞的表达。结果树突状细胞主要分布于肿瘤间质中,少量散布于肿瘤细胞之间,呈卵圆形或不规则形,胞浆丰富,细胞表面突起较短或无突起,与淋巴细胞相伴浸润。树突状细胞计数随着乳腺癌组织分化程度增高而增多,高分化与中分化、低分化之间树突状细胞计数差异有统计学意义(P<0.05);树突状细胞计数在患者年龄、月经状况、病理学分类及淋巴结是否转移差异均无统计学意义(P>0.05)。乳腺癌患者树突状细胞数目与预后呈正相关(r=0.280,P<0.05)。结论树突状细胞的计数随着乳腺癌组织分化程度增高而增多,其数目与乳腺癌患者生存期呈正相关。
乳腺肿瘤;树突细胞;免疫组织化学
乳腺癌是危害女性健康常见的恶性肿瘤。肿瘤微环境中的免疫状态比外周血免疫状态更能反映出宿主的抗瘤免疫状态。乳腺癌的免疫应答反应以细胞免疫为主,肿瘤间质中免疫细胞的表达和浸润程度与乳腺癌的发生、发展及转移关系更为密切。树突状细胞(dentric cells,DC)是参与乳腺癌局部免疫的细胞之一,其在机体的抗肿瘤免疫应答中发挥了重要作用。本研究采用免疫组织化学(immunohistochemistry,IHC)染色方法,分析乳腺癌组织中DC的表达情况,探讨其在乳腺癌组织浸润过程中的分布特点及与乳腺癌的临床病理特征的关系,旨在阐明DC的表达与预后的关系。
1 资料与方法
1.1 一般资料:选取河北医科大学第二医院病理科2005年7月—2006年7月病历资料完整的存档蜡块60例,所有患者均为初次手术,术前均未接受过放疗、化疗及免疫治疗。患者均为女性,年龄38~74岁,中位年龄50.5岁。年龄≤45岁13例,>45~60岁37例,>60岁10例。所有患者中未绝经者30例,绝经者30例。60例乳腺癌病理切片均经高年资病理医师诊断复核,组织学类型根据WHO分类分为导管内癌14例,浸润性导管癌27例,浸润性小叶癌19例(浸润性乳腺癌中有淋巴结转移25例,无淋巴结转移21例)。组织分化程度包括高分化19例,中分化22例,低分化19例。随访时间5~60个月。
标本均经10%中性缓冲福尔马林固定,常规取材、脱水、石蜡包埋切成4μm厚,连续切片5张,贴于涂有0.05%多聚赖氨酸的载玻片备用,为确保实验结果评估的准确性,所有病例均经2名有经验的病理科医师经行光镜观察共同确诊并对乳腺癌进行组织学分型。
1.2 试剂:兔抗人CD14多克隆抗体(美国Proteintech集团有限公司);兔抗人CD40多克隆抗体(北京博奥森生物公司);兔抗人CD127多克隆抗体(北京博奥森生物公司);DAB显色试剂盒(北京中杉生物技术有限公司);S-P试剂盒(北京中杉生物技术有限公司)。
1.3 IHC染色方法:采用S-P法。切片经常规脱蜡,用3%过氧化氢甲醇溶液室温下避光孵育15min,以阻断内源性过氧化物酶的活性,微波炉抗原修复。染色按S-P试剂盒提供的说明书进行。同步设有阳性和阴性对照。用已知阳性组织切片作为阳性对照,阴性对照采用PBS代替一抗,其余操作
步骤同实验片。
1.4 IHC结果判定:CD40标记的DC以细胞膜和(或)细胞浆内出现棕黄色或棕褐色颗粒为阳性细胞。阳性细胞的计数方法,对每张切片随机选取10个高倍视野(×400),计数每个视野阳性细胞的数量,求其均值为该病例的阳性表达细胞数[1]。
1.5 统计学方法:应用SPSS 17.0统计软件进行数据分析。计量资料以±s表示,分别采用F检验和q检验;相关性采用Pearson相关分析。P<0.05为差异有统计学意义。
2 结 果
2.1 DC检测结果:CD40阳性染色颗粒定位于T细胞、单核巨噬细胞、DC、上皮细胞、血管内皮细胞、成纤维细胞、及乳腺癌细胞。通过形态学观察排出除DC以外的CD40+表达细胞。
CD40+DC胞浆与胞膜呈棕黄色或棕褐色,主要分布于肿瘤间质中,少量散布于肿瘤细胞之间,呈卵圆形或不规则形,胞浆丰富,细胞表面突起较短或无突起,与淋巴细胞相伴浸润(图1~5)。
2.2 DC计数与乳腺癌临床病理参数之间的关系:浸润性导管癌与浸润性小叶癌之间DC计数差异无统计学意义(P>0.05);未绝经者与绝经者DC计数差异无统计学意义(P>0.05);各年龄段(≤45岁、>45~60岁、>60岁)DC计数差异无统计学意义(P>0.05);无淋巴结转移者与淋巴结转移者DC计数差异无统计学意义(P>0.05);DC计数随着乳腺癌组织分化程度增高而增多,其中高分化者与中分化、低分化组者DC计数差异有统计学意义(P<0.01),而中分化者与低分化者DC计数差异无统计学意义(P>0.05)。见表1。
2.3 相关性分析:乳腺癌患者DC数目与预后呈正相关(r=0.280,P<0.05)。
表1 DC计数与乳腺癌临床病理参数之间的关系 (±s,个)
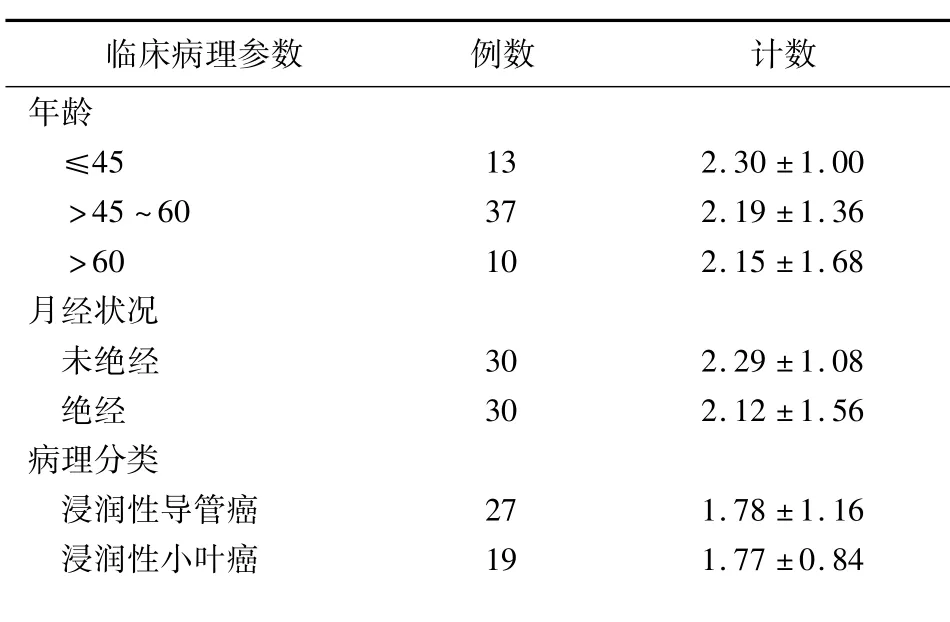
表1 DC计数与乳腺癌临床病理参数之间的关系 (±s,个)
临床病理参数例数计数年龄≤45 13 2.30±1.00>45~60 37 2.19±1.36>60 10 2.15±1.68月经状况未绝经30 2.29±1.08绝经30 2.12±1.56病理分类浸润性导管癌27 1.78±1.16浸润性小叶癌19 1.77±0.84

*P<0.05与高分化比较(q检验)
3 讨 论
DC是Steinman等[2]从小鼠的脾和淋巴器官中分离发现的,其形状可呈树突样。DC起源于骨髓CD34+造血干细胞,广泛分布于除脑以外的全身各个组织与器官,数量甚微,约占外周血单核细胞0.5%~1.0%。DC是目前已知的体内功能最强的专职抗原提呈细胞,具有摄取、处理和提呈抗原至T细胞的功能。处于不同分化阶段的DC具有不同的功能。未成熟的DC高表达补体受体、Fc受体等与吞噬有关的受体,具有较强的抗原内吞和加工处理能力,其在向淋巴组织T区迁移过程中可能诱导免疫耐受;成熟的DC高表达主要组织相容性复合物(major histocompatibility complex,MHC)Ⅰ、Ⅱ类分子和CD40、CD80、CD86等共刺激分子及黏附分子,具有较强的抗原提呈和激活初始型T细胞的能力,它通过处理、提呈抗原从而介导机体的免疫应答。
CD40是由Koho等[3]在人的膀胱癌细胞中发现的。它是一种相对分子质量为45 000~50 000的Ⅰ型跨膜糖蛋白,属于肿瘤坏死因子受体超家族成员,CD40在B细胞、成熟DC、上皮细胞、血管内皮细胞、血小板等[4]上均有表达。研究发现CD40还可表达于一些肿瘤细胞上,如乳腺癌、膀胱癌、卵巢癌等[5]。本研究采用CD40作为DC的表面标记,结合其形态学特点来检测乳腺癌组织中DC的表达情况。
本研究结果显示DC主要分布于乳腺癌间质中,少量散布于肿瘤细胞之间,细胞呈卵圆形或不规则形,表面突起较短或无突起。这不同于正常成熟DC的形态特点,这种差异与DC表面分子低表达或不表达有关。罗小玲等[6]在淋巴瘤中发现DC胞浆突起与肿瘤细胞密切接触,认为DC可以在肿瘤细胞间移行,且借助突起直接摄取肿瘤相关抗原。
本研究结果显示DC计数随着乳腺癌组织分化程度增高而增多,高分化者与中分化、低分化者之间的DC计数差异有统计学意义(P<0.05)。提示DC可能会影响乳腺癌的增殖与分化。这与曹荣华等[7]、冯瑞娥等[8]的研究结果一致。谷彦军等[9]却
得出了相反的结论。机体产生的免疫反应是否会随着肿瘤恶性度增高而增强有待进一步证实。本研究淋巴结转移者与无淋巴结者DC计数差异无统计学意义(P>0.05)。提示DC可能不参与乳腺癌的转移。
本研究还发现DC的表达与乳腺癌患者预后呈正相关。这与相关肿瘤的研究结果一致[10-11]。DC抗肿瘤免疫机制为DC捕获肿瘤抗原后,通过细胞表面的MHC-Ⅰ、MHC-Ⅱ类分子提呈肿瘤抗原给T细胞(抗原)受体。同时,DC提供高水平的共刺激分子、黏附分子激活T细胞。DC与T细胞结合后可通过分泌白细胞介素12来诱导T细胞、自然杀伤细胞等产生肿瘤坏死因子γ、穿孔素和颗粒酶,增强对靶细胞的溶解作用。DC可反映机体的免疫状态,尤其是肿瘤灶局部的DC即肿瘤浸润性DC更能反映宿主的抗瘤免疫状态。肿瘤细胞可以通过释放白细胞介素10、血管内皮生长因子及转化生长因子β1等免疫抑制因子抑制DC的成熟,降低DC表面分子的表达。MHC-Ⅱ类分子的不表达或低表达提示DC提呈外源性抗原的能力低下,而DC表面的共刺激分子、黏附分子的低表达或不表达也可以导致DC的抗原提呈能力低下,从而使DC无法有效地识别和杀伤肿瘤细胞[12]。马静等[13]提出可采用DC作为疫苗载体(或称佐剂),以肿瘤抗原体外冲击使其致敏,不仅可以保证肿瘤抗原被有效地摄取,而且可以提供所需的共刺激信号,从而实现肿瘤的免疫治疗。
总之,DC的计数随着乳腺癌组织分化程度增高而增多,其数目与乳腺癌患者生存期呈正相关。提示乳腺癌中DC的计数可作为评估患者预后的一个独立因素。(本文图见封三)
[1]FURUKARWA T,WATANABE S,KODAMA T,et al.T-zone histiocytes in adenocarcinoma of the lung in relation to postoperative prognosis[J].Cancer,1985,56(11):2651-2657.
[2]STEINMAN RM,COHN ZA.Identification of a novel cell type in peripheral lymphoid organs ofmice.I.Morphology,quantitation,tissue distribution[J].JExp Med,1973,137(5):1142-1162.
[3]KOHO H,PAULIE S,BEN-AISSA H,et al.Monoclonal antibodies to antigens associated with transitional cell carcinoma of the human urinary bladder[J].Cancer Immunol Immunother,1984,17(3):165-172.
[4]SMITH CA,FARRAH T,GOODWIN RG.The TNF receptor superfamily of cellular and viral protein:activation,costimulation,and death[J].Cell,1994,76(6):959-962.
[5]PHIPPS RP.Atherosclerosis:the emerging role of inflammation and the role CD40-CD40 ligand system[J].Proc Natl Acad Sci USA,2000,97(13):6930-6932.
[6]罗小玲,葛连英,谢裕安,等.肝癌组织中浸润树突状细胞的数量和表面分子表面的临床意义[J].广西医科大学学报,2007,24(3):345-348.
[7]曹荣华,袁宏银,杨国梁.乳腺癌肿树突状细胞浸润的临床意义[J].郧阳医学院学报,2001,20(4):203-205.
[8]冯瑞娥,李敬军,王军梅,等.乳腺癌组织中S-100蛋白阳性树突状细胞的研究[J].首都医科大学学报,1997,18(4):369-375.
[9]谷彦军,马洪达,魏焕萍.树突状细胞与乳腺癌[J].国际病理科学与临床杂志,2006,26(1):31-34.
[10]TSUJITANIS,KAKEJI Y,WATANABE A,et al.Infiltration of dendritic cells in relation to tumor invasion and lymph node metastasis in human gastric cancer[J].Cancer,1990,66(9):2012-2016.
[11]FONTENOT JD,GAVIN MA,RUDENSKY AY.FoxP3 programs the development and function of CD4+CD25+regulatory T cells[J].Nat Immunol,2003,4(4):330-336.
[12]NESSELHUT T,MATTHES C,MARS D,et al.Cancer therapy with immature monocyte-derived dendritic cells in patients with advanced breast cancer[J].Clinnical Oncology,2005,23(165):25-28.
[13]马静,程建新.树突状细胞疫苗与妇科肿瘤免疫治疗[J].河北医科大学学报,2009,30(8):854-856.
(本文编辑:刘斯静)
R737.9
B
1007-3205(2013)06-0683-03
2012-12-24;
2013-01-25
成媛(1982-),女,河北新乐人,河北医科大学西山校区助教,医学硕士,从事病理学教学与科研工作。
*通讯作者。E-mail:abcxph@163.com
10.3969/j.issn.1007-3205.2013.06.022
