光谱法研究间尼索地平与人血清白蛋白的相互作用
2013-03-03任晓英冯翠丽王清君李志强
任晓英,王 静,冯翠丽,王 伟*,王清君,李志强
(1.河北省保定市第二医院急诊科,河北保定071051;2.河北医科大学药学院无机物化教研室,河北石家庄050017;
3.河北省新河县中医院妇产科,河北新河055650)
·论 著·
光谱法研究间尼索地平与人血清白蛋白的相互作用
任晓英1,王 静2,冯翠丽3,王 伟2*,王清君2,李志强3
(1.河北省保定市第二医院急诊科,河北保定071051;2.河北医科大学药学院无机物化教研室,河北石家庄050017;
3.河北省新河县中医院妇产科,河北新河055650)
目的研究不同温度下间尼索地平(m-nisoldipine,m-Nis)与人血清白蛋白(human serum albumin,HSA)相互作用。方法采用紫外光谱法和荧光光谱法在模拟人体生理pH=7.4的0.1mol/L磷酸缓冲溶液中研究不同温度下m-Nis与HSA相互作用的光谱行为。结果m-Nis没有使HSA的构象发生变化。293K、301K和310K时的猝灭常数为分别为1.03×105mol/L,1.25×105mol/L和1.31×105mol/L;结合点数n近似为1,反应的焓变值为3.695kJ/mol,且ΔG<0,ΔS>0;m-Nis在HSA上的结合位置距色氨酸残基的距离(r)=2.96nm。结论m-Nis对HSA的荧光猝灭作用不是简单的动态猝灭或静态猝灭,而是形成了1∶1的复合物,造成荧光猝灭;m-Nis与HSA之间发生的是非辐射能量转移过程,二者之间的主要作用力是疏水力。
尼索地平;血清白蛋白;光谱法,荧光
人血清白蛋白(human serum albumin,HSA)是人体血浆中含量最为丰富的大分子蛋白质,大部分药物的运输要通过与血液中的血清白蛋白的可逆结合才能完成[1-4]。间尼索地平(m-nisoldipine,m-Nis)是河北医科大学自主合成的二氢吡啶类钙离子抑制剂,与同类的二氢吡啶类药物相比,更能有效地增强心脏输血量,降低心肌收缩应力,并在胸动脉中有高的选择性[5]。荧光光谱法是研究血清白蛋白与药物相互作用的重要手段[6]。本文采用荧光光谱法,辅助紫外光谱,对m-Nis与HSA的作用机制进行研究,计算得到m-Nis和HSA结合的结合常数、结合位点数和热力学参数,旨在为深入研究m-Nis在体内的储存、运输、作用机制提供参考。
1 材料与方法
1.1 仪器与试药:LS50B型荧光光谱仪(美国Per Kin-Elmer公司);HH-1型恒温水浴锅(北京科伟永兴仪器有限公司);UV-2201型紫外-分光光度计(日本岛津仪器株式会社);KQ-100DE型超声波清洗器(昆山市超声仪器有限公司);pHS-25型精密酸度计(上海雷磁仪器厂);HSA(北京索来宝生物技术有限公司);m-Nis(河北医科大学药物化学教研室自制);其他试剂均为分析纯;实验用水为去离子水。
1.2 方法
1.2.1 溶液的配置
1.2.1.1 HSA溶液:精确称量HSA适量,用pH= 7.40缓冲液溶解并配制成浓度为2.0×10-5mol/L的溶液于4℃冰箱中保存备用。
1.2.1.2 m-Nis溶液:精确称量m-Nis适量,用少量无水乙醇溶解并配成浓度为2.0×10-3mol/L的储备液。
1.2.2 紫外光谱和荧光光谱分析:分别在5mL的容量瓶中加入1.0mL HSA溶液,然后依次加入不同体积(0、0.01、0.02、0.03、0.04、0.05、0.07mL)的m-Nis溶液,以pH=7.40的磷酸盐缓冲液定容,水浴振摇30min,激发波长设定为280nm,扫描范围为280~500nm,扫描速度为100nm/min,激发与发射狭缝均为5nm。测定不同温度下,HSA在不同浓度的m-Nis存在时的荧光光谱和同步荧光光谱(Δλ= 15nm,Δλ=60nm);以缓冲盐做参比,测定m-Nis与HSA浓度比为1∶1时的紫外吸收光谱。
2 结 果
2.1 m-Nis对HSA的荧光猝灭作用:m-Nis在与HSA结合的过程中能不同程度的猝灭HSA的荧光强度,且随着温度的升高猝灭强度增强,说明m-Nis与HSA发生了相互作用。按实验方法得到HSA的荧光猝灭光谱见图1。由图可以看出,在不同温度不同浓度下荧光强度F降低且峰位也发生了蓝移。
2.2 m-Nis对HSA的猝灭常数的计算和猝灭机制的探讨:荧光猝灭过程通常分为动态猝灭和静态猝灭2种[3]。动态猝灭过程遵循Stern-Volmer方程[7],对HSA与m-Nis的结合体系而言是指m-Nis与HSA的激发态分子之间发生了能量转移或是电子转移。
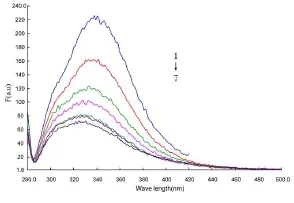
图1 293K时m-Nis对HSA发射光谱的影响曲线1~7浓度分别为0、0.4、0.8、1.2、1.6、20.0、2.8×10-5mol/LFigure1 Effectofm-Nison emission spectraofHSA(4.0×10-6mol/L)at293K withλex=280nmFrom curve 1 to 7m-Nis:0,0.4,0.8,1.2,1.6,2.0,2.8×10-5mol/L
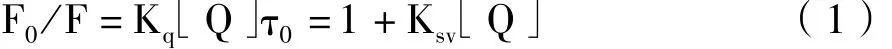
其中F0和F分别为加入m-Nis前后的荧光强度,Kq为双分子猝灭过程的速率常数。τ0为无m-Nis时HSA的平均寿命,一般为10-8s[8]。Ksv称之为Stern-Volmer猝灭常数,随温度的升高动态猝灭常数会增大。而静态猝灭过程遵循以下方程。

其中Ks是静态猝灭常数,其随温度的升高而减小。由猝灭常数随温度的变化规律可判断荧光猝灭类型。293K、301K和310K时m-Nis对HSA猝灭过程的Ksv,Kq和相应的Stern-Volmer方程列于表1。随着温度的升高,猝灭常数Ksv、Kq有轻微的增大,不符合静态猝灭的机制。但从m-Nis对HSA的猝灭常数数量级在1013上推断也不是典型的动态猝灭,因为猝灭剂对生物大分子的最大动态猝灭常数为2× 1010。所以,仅由以上数据不能判断猝灭类型。
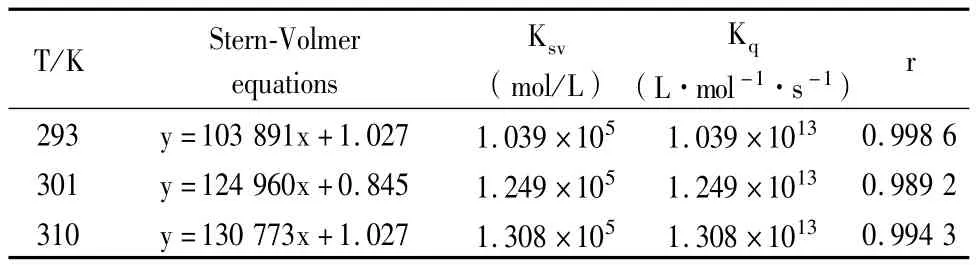
表1 不同温度下m-Nis与HSA作用的Stern-Volmer猝灭常数Table 1 Stern-Volmer quenching constants for m-Nis-HSA system s at different temperature
为进一步验证m-Nis对HSA荧光的猝灭机制,测定了m-Nis与HSA相互作用的紫外吸收光谱图,见图2,3。HSA在紫外光谱区有2个特征的蛋白质吸收带,随着m-Nis的不断加入,波长为280nm的吸收带表现为明显的增色效应且吸收峰位置基本不变。中HSA和等浓度m-Nis的吸光度相加所得图谱及m-Nis与HSA等摩尔混合物的吸收光谱图几乎完全重合,表明HSA的紫外吸收光谱没受m-Nis的影响,说明m-Nis对HSA的荧光猝灭过程没有生成不发光的配合物,也不是典型的静态猝灭[9]。
2.3 m-Nis对HSA构象的影响以及二者结合距离的计算:在相同的实验条件下,HSA的浓度固定为4×10-6mol/L,在m-Nis的浓度逐渐增加的条件下,固定Δλ分别为15nm和60nm进行荧光扫描,得到HSA中酪氨酸和色氨酸残基的同步荧光光谱,见图4。表明随m-Nis浓度的增大,二者的同步荧光强度逐渐降低,峰位和峰形基本没变,说明m-Nis同时对HSA的色氨酸和酪氨酸残基发生作用,且m-Nis的加入没有改变蛋白质的构象。
能量转移效率E与结合距离r之间的关系式如下[1]。
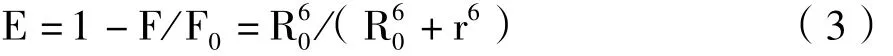
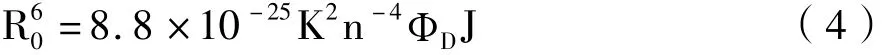
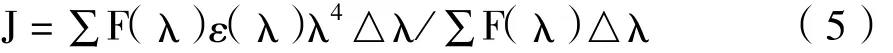
其中,R0为能量转移效率为50%时的临界距离;ΦD为HSA的荧光量子产率,通常取值0.15;K2为偶极空间取向因子,可取HSA与m-Nis各向随机分布的平均值2/3;n为介质的折射指数,一般取值1.366;F(λ)为HSA在波长λ处的荧光强度;ε(λ)为m-Nis在波长λ处的摩尔吸光系数;Δλ为计算时分割的波长跨度;J是HSA的荧光发射光谱和m-Nis的紫外吸收光谱之间的重叠积分。HSA的荧光光谱与m-Nis的吸收光谱的重叠图见图5。结合公式(3)、(4)、(5)计算得到J=1.087×10-14cm3·L-1·mol-1,E=0.29,r=2.96nm。由于m-Nis在HSA上的结合位置距色氨酸残基的距离r<7nm,根据Foster's偶极-偶极非辐射能量转移理论可以得出结论,m-Nis与HSA之间发生的是非辐射能量转移过程。

图2 HSA在m-Nis存在时的紫外-可见吸收光谱图曲线1~6 m-Nis浓度分别为0.4、0.8、1.2、1.6、2.0、2.8×10-5mol/LFigure 2 UV-vis absorption spectra of HSA(4.0×10-6mol/L)in the presence ofm-NisFrom curve 1 to6 Cm-Nis:0.4,0.8,1.2,1.6,2.0,2.8×10-5mol/L
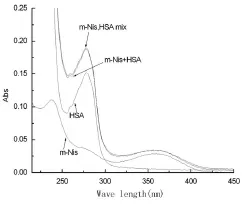
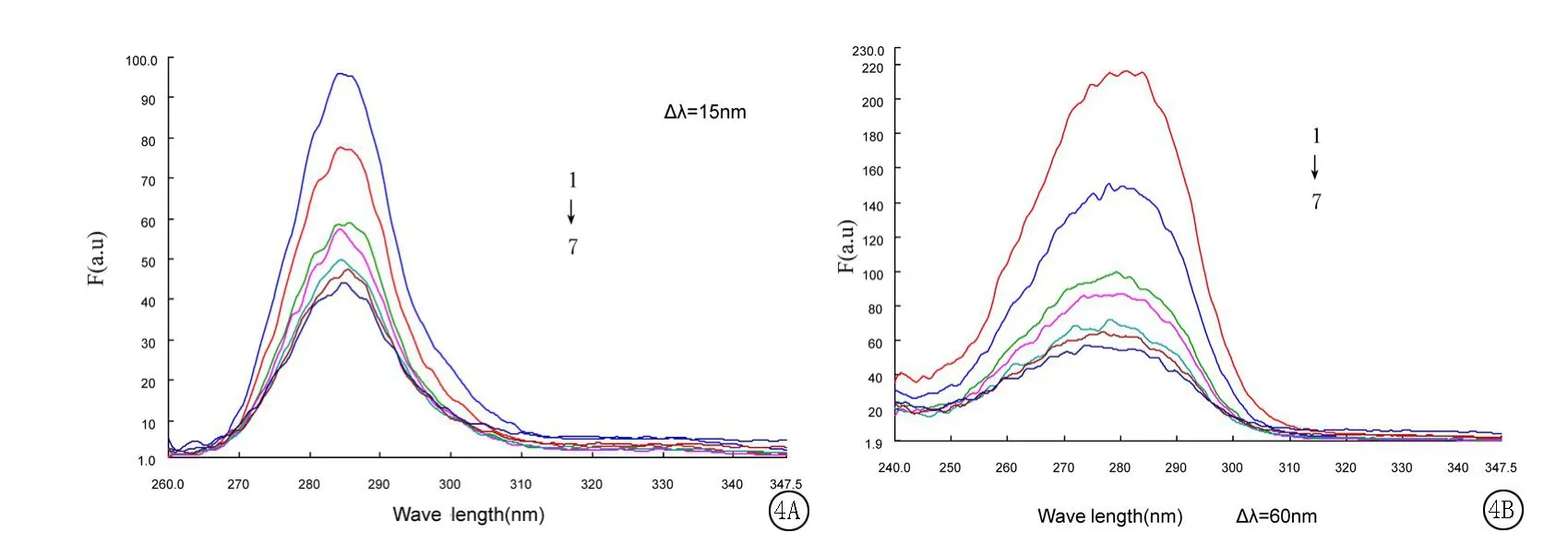
图4 m-Nis和HSA的同步荧光光谱曲线1~7 HSA浓度为4.0×10-6mol/L,m-Nis浓度分别为0、0.4、0.8、1.2、1.6、2.0、2.8×10-5mol/LFigure 4 Synchronous fluorescence spectra ofm-Nis and HSA systemCHSA=4.0×10-6mol/L,from curve 1 to 7 Cm-Nis:0,0.4,0.8,1.2,1.6,2.0,2.8×10-5mol/L
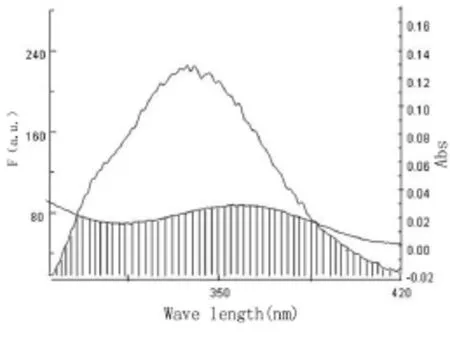
图5 HSA的荧光光谱与m-Nis的紫外光谱的重叠图Figure 5 Overlapping between the fluorescence spectrum of HSA and UV spectrum ofm-Nis
2.4 m-Nis对HSA结合常数和结合位点数的确定:采用Scatchard方程[10]计算了m-Nis与HSA相互作用的结合位点数,见表2。不同温度下的结合位点数n都接近于1,表明m-Nis与HSA形成了1∶1的复合物。利用修正的Stern-Volmer方程求得结合常数K,见表3。结合常数K的数量级在104~105左右,表明m-Nis与HSA形成瞬时的激发态复合物的作用很强,m-Nis完全能凭借这种结合作用被血液中的血清白蛋白储存和运输。2.5 m-Nis与HSA结合过程的热力学参数的计算和作用力类型分析:蛋白质等生物大分子和有机小分子之间的结合力主要有疏水作用力、静电引力、氢键、范德华力等。根据热力学公式,与△G=△HT△S=-RT/nK求得各热力学参数,见表4。Ross根据反应前后焓变△H和熵变△S的大小总结出如下规律[11],如△1t>0、△S>0时,分子间为疏水作用力。由此可见m-Nis与HSA之间的作用力主要为疏水作用力。

表2 不同温度下m-Nis与HSA的结合位点数Table 2 Binding sites ofm-Nisw ith HSA at different tem peratures

表3 不同温度下m-Nis与HSA的结合常数Table 3 Binding constants ofm-Nis w ith HSA at different temperatures

表4 m-Nis与HSA结合过程的热力学参数Table 4 Thermodynam ic parameters for binding ofm-Nis with HSA
3 讨 论
本文在分子水平上,利用荧光光谱法和紫外分光光度法详细地研究了在模拟的生理条件下m-Nis与HSA之间的相互作用。根据荧光猝灭常数随温度的变化趋势初步判断两者的猝灭过程为动态猝灭,但是其数量级大于最大猝灭常数,用动态猝灭机理无法解释清楚。而紫外数据表明了药物没有直接与HSA形成基态复合物,也不符合静态机制。热力学参数的计算表明两者的作用是一个熵加和Gibbs自由能降低的自发过程,反应伴随吸热过程,所以随温度的升高,猝灭常数也增大。药物与HSA之间的作用力为疏水力。由于m-Nis与HSA的结合距离较小,药物很可能是在疏水作用力的引导下,嵌入色氨酸或是酪氨酸附近的疏水腔,微小程度地改变了蛋白质的微环境,使得蛋白质的荧光强度降低,荧光峰位发生了微小的蓝移。
综上所述,m-Nis与HSA的相互作用机制并不
是简单的动态猝灭或静态猝灭,而是形成一种复合物,其由激发态回到基态并未伴随荧光发射[12],而是发生了非辐射能量转移过程。m-Nis没有使蛋白质的构象发生改变,仅通过蛋白质的运输到达作用部位,并得到相应的靶点,发挥药理作用。
[1]陈稚,吴都督,张爽,等.荧光光谱法研究纳米硫化锌与牛血清白蛋白的相互作用[J].分析测试学报,2011,30(11):1272-1275.
[2]尚永辉,孙家娟,刘静,等.水飞蓟素与牛血清白蛋白相互作用的荧光光谱研究[J].化学研究,2011,22(2):1-3.
[3]赵芳,黄超锋,梁慧,等.大黄酸锌配合物与牛血清白蛋白相互作用的研究[J].分析化学,2011,39(3):401-404.
[4]郝娟,张爱平,黄茜,等.光谱法研究欧前胡素及同分异构体与牛血清白蛋白的相互作用[J].分析测试学报,2010,29(11):1173-1179.
[5]高玉敬,李蕴山,傅绍萱,等.间尼索地平和尼索地平对清醒兔血流动力学和局部血流量的影响[J].中国药理学通报,1990,6(2):114-117.
[6]吴刚珂,颜承农.荧光光谱法研究吲哚美辛与牛血清白蛋白结合作用的热力学特征[J].化学与生物工程,2009,9(26):36-40.
[7]易平贵,商志才,俞庆森,等.丝裂霉素C与牛血清白蛋白结合作用的研究[J].化学学报,2000,58(12):1649-1653.
[8]陈晓波,李崧.铜、钠和钼离子与牛血清白蛋白作用的荧光光谱研究[J].光谱学与光谱分析,2006,26(2):309-312.
[9]尚永辉,李华,孙家娟,等.核黄素与牛血清白蛋白相互作用的荧光光谱研究[J].分析科学学报,2010,26(1):67-69.
[10]FENG XZ,LIN Z,YANG LJ,etal.Investigation of the interaction between acridine orange and bovine serum albumin[J].Talanta,1998,7(5):1223-1229.
[11]ROSS PD,SUBRAMANIAN S.Thermodynamics of protein association reactions:forces contributing to stability[J]. Biochemistry,1981,20(11):3096-3102.
[12]ATHINA P,REBECCA JG,RICHARD AF,et al.Spectroscopic studies on the interaction between erlotinib hydrochloride and bovine serum albumin[J].J Agric Food Chem,2005,53(1):158-163.
(本文编辑:刘斯静)
INTERACTIONS BETWEEN M-NISOLDIPINE AND HUMAN SERUM ALBUM IN BY SPECTROSCOPIC METHOD
REN Xiaoying1,WANG Jing2,FENG Cuili3,WANGWei2*,WANG Qingjun2,LIZhiqiang3
(1.Department of Emergency,the Second Hospital of Baoding City,Hebei Province,Baoding 071051,China;
2.Department of Inorganic and Physical Chemistry,the School of Pharmaceutical Sciences,Hebei Medical University,Shijiazhuang 050017,China;3.Department of Gynaecology and Obstertrics,Chinese Traditional Medicine Hospital of Xinhe County,Hebei Province,Xinhe055650,China)
Objective To study the interactions between m-nisoldipine(m-Nis)and human serum albumin(HSA).MethodsUltraviolet visible spectroscopy(UV-vis)and fluorescence spectroscopy were used to study the spectral behavior of interactions between m-Nis and HSA under different temperature at the physiological pH(7.4).Resultsm-Nis did not cause the conformation change of the HAS;The quenching constants at 293K,301K,and 310K were 1.03×105mol/L,1.25× 105mol/L,1.31×105mol/L,respectively;the number of binding sites(n)was nearly 1.The enthalpy change(ΔH)was 3.695 kJ/mol withΔG<0 andΔS>0;The distance between binding site and tryptophan(r)=2.96nm.
Themechanism of fluorescence quenching ofm-Nis to HSA was neither static nor dynamic fluorescence quenching,but formed 1∶1 complex and resulted fluorescence quenching.The non-radialization energy transfer process occurred betwwenm-Nis and HASand the action force was hydrophobic interaction.
nisoldipine;serum albumin;spectrometry,fluorescence
R657.39
A
1007-3205(2013)06-0678-05
2012-10-25;
2012-12-03
2009年河北省教育厅资助项目(2009148);2009年河北省卫生厅资助项目(20090059);河北省科技支撑计划项目(09276438)
任晓英(1973-),女,河北保定人,保定市第二医院副主任医师,医学硕士,从事急诊科疾病诊治研究。
*通讯作者。E-mail:hbydwangwei@163.com
10.3969/j.issn.1007-3205.2013.06.021
