两个实验引发的思考
2013-02-24李传庆
李传庆
(如皋市搬经中学江苏如皋226561)
两个实验引发的思考
李传庆
(如皋市搬经中学江苏如皋226561)
一般认为,钠与水反应的实质是钠与水电离出的氢离子(实际上是水合氢离子,下同)相作用生成氢气。但笔者认为这种看法欠妥,这里就该问题作一个初步探讨。
一、两个实验引发的思考
1.对这样一个实验大家都很熟悉:向硫酸铜(或其他铜盐)的水溶液中投入一小块金属钠,这时反应会迅速进行,反应后得到氢气和氢氧化铜,同时得到钠盐。我们知道,在硫酸铜水溶液中存在的微粒有铜离子、硫酸根离子、氢离子、氢氧根离子、水分子,它们的浓度大小一般情况下应有H2O>SO42->Cu2+>H+>OH-。从电极电位来看:
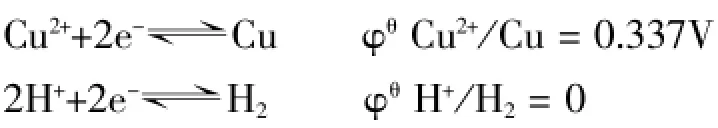
考虑溶液中离子浓度大小对电极电位的影响,根据奈斯特方程,设c(Cu2+)=0.1mol/L;c(H+)=0.1mol/L;p(H2)= 10-10atm,则有:
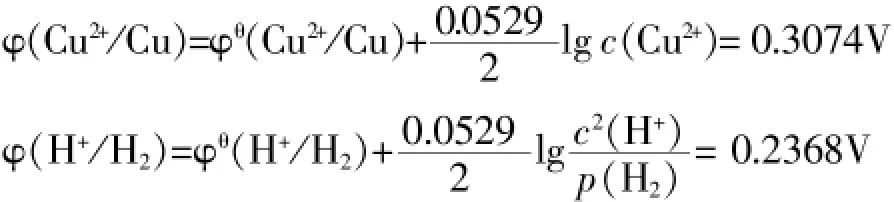
(说明:实际上c(H+)要比c(Cu2+)小,生成H2的分压要远大于10-10atm,这里是一种极端假设。也就是说φ H+/H2实际值要比上述数值小。)
从上述分析看,如果钠跟水反应的实质是钠跟水电离出的氢离子相作用的话,那么,钠跟铜盐溶液反应时得到的则应该是铜,而不是氢气。与实验结果相违背。
2.再看一个实验:取两块大小相同的金属钠,分别投入纯水和1mol/L的NaOH溶液中,发现反应所需的时间非常接近(说明:该反应由于很难准确进行定量测定,故很难给出准确的实验结果,经过反复实验,得到测定值约在1∶1.1左右)。如果钠与水反应的实质是钠跟水电离出的氢离子相作用,那么,根据质量作用定律,钠投入氢氧化钠溶液中的反应要远比投入水中发生的反应慢。事实并非如此。
二、对两个实验的分析
我们知道,在铜盐溶液中,除了Cu2+和H+能被钠还原外,另外可以被还原的可能性最大的就是水。从电极电位分析:
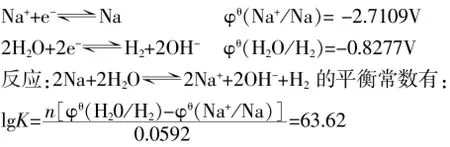
K=4.18×1063,说明该反应可以进行得非常完全。而且,溶液中的氧化还原反应进行的次序也不是完全由电动势决定的。除电动势(热力学因素)以外,决定反应次序的还有动力学因素(反应速率)。对上述反应体系来说,溶液中水的浓度(接近55mol/L)要远远大于Cu2+和H+的浓度,钠投入溶液中,首先与水接触并反应,反应后生成的OH-又进一步与周围溶液中的Cu2+和H+相作用,使Cu2+和H+浓度进一步降低(若设此时溶液中与钠接触的局部溶液c(OH-)=1×10-6mol/L,则由Ksp[Cu(OH)2]= 5.6×10-20可以求出c(Cu2+)=5.6×10-8mol/L;由Kw可求出c(H+)=1×10-8mol/L),使钠与水接触的机会大大超过了与铜离子和氢离子接触的机会。由此可见,钠与水反应的实质应是钠与水分子直接反应,生成钠离子、氢氧根离子和氢气。当然,不完全排除钠与氢离子和铜离子反应的可能性,但这两个反应在这里相对来说实在是太弱了。类似的,由于在氢氧化钠溶液中水分子的浓度与纯水相比没有明显的差距,因此,钠跟氢氧化钠溶液的反应与钠跟水的反应相比,速率上也就不会出现明显的差异。
从结构上看,在水分子中,由于氧元素的电负性极大,使O-H键中的共用电子对强烈向氧原子偏移,O-H键上的氢原子受到的束缚力较小,且带有部分的正电荷,当负极的电极电位远远小于-0.8277V时,水也可以获得电子而被还原。
综上所述,我认为,钠跟水反应的实质应该是钠跟水分子直接作用,而不是跟水电离出的氢离子相作用。
三、由钠与水反应实质想到的
若上述结论是正确的,那么在氯碱工业中,阴极(其电极电位远远小于-0.8277V)的电极反应式就不能写成而只能写成2H2O+2e-
这样,总反应式也就顺理成章的写成中学教材(如人教版普通高中课程标准实验教科书化学选修4《化学反应原理》等)中将氯碱工业阴极的电极反应式写成H2↑,在书写总反应式时总有些别扭,解释时总有牵强附会的嫌疑。同理,我认为在电解硫酸铜溶液时,其阳极的电极反应式只能写成而不能
以上看法当否,恳请同行不吝赐教,但愿能起到抛砖引玉的效果。
[1]北师大等三校编.无机化学[M].北京:高等教育出版社,1992
1008-0546(2013)02-0079-01
G633.8
B
10.3969/j.issn.1008-0546.2013.02.031
