大孔吸附树脂纯化西兰花色素的研究
2013-02-21李云志金志峰
李云志,金志峰
(安徽中医药大学药学院,安徽合肥230045)
随着生活水平的提高,人们对饮食的要求也逐渐提高,富有营养、保健作用和色香味俱全的食品成为大家的首选。色素是一类重要的食品添加剂,可以达到改善食品的色泽,增进食品感官性质的作用。目前,在食品工业上广泛使用的色素主要分为天然色素和人工合成色素两类。天然色素来自于自然界,除了具有基本的着色作用以外,很多还具有一定的生理活性[1-2]。因此,从自然界中获取天然色素已成为食用色素发展的必然趋势[3-4]。
西兰花,属十字花科芸苔属甘蓝变种,又名绿菜花、青花菜,营养丰富,被誉为“蔬菜皇冠”。其食用部分为绿色幼嫩花茎和花蕾,不仅含有蛋白质、糖、脂肪、维生素和胡萝卜素等常见的营养成分,而且还含有一定量类黄酮物质[5]。类黄酮是一类植物色素,具有多样的生理活性,如抗氧化、抗炎、抗肿瘤、保肝等作用,可以作为食品、化妆品的天然添加剂[6]。因此,利用西兰花提取食用色素,对食品资源的综合开发利用,新型食用色素的研发具有重要意义。大孔树脂是一类不带离子交换基团的多孔型交联聚合物,近年来广泛应用于天然活性成分的纯化研究,并取得了较好的效果[7-14]。因此,本实验拟采用大孔树脂研究西兰花色素的纯化工艺,为其开发利用提供理论依据。
1 材料与方法
1.1 材料与仪器
西兰花 市购;95%乙醇 为国产分析纯;AB-8、DM-130、D1300、NKA-9、HPD-300型大孔吸附树脂 安徽三星树脂公司。
722型紫外可见分光光度计 上海菁华科技有限公司;BSA2201-CW型电子天平 赛多利斯科学仪器(北京)有限公司;SHZ-D型循环水式真空泵 巩义市英山谷予华仪器厂;DZF-6090型真空干燥箱 上海精宏实验设备有限公司;RE-52AA型旋转蒸发器 无锡沃信仪器有限公司;DKZ-2B型电热恒温振荡水槽 上海恒勤科技有限公司。
1.2 实验方法
1.2.1 大孔树脂预处理 大孔树脂装柱,用95%乙醇浸泡24h,再用95%乙醇以2BV/h的流速(1BV为一个树脂床体积)通过树脂层,洗至流出液加蒸馏水不呈白色浑浊为止,再用去离子水洗至pH为中性。
1.2.2 西兰花粗色素制备及定性鉴别 称取500g的西兰花,除杂、研磨破碎,按1g∶5m L的比例加入60%的乙醇溶液,滴加盐酸,调节pH 3.0,40℃水浴2h,抽滤,40℃下减压浓缩滤液得到浸膏,最后真空干燥得到粗色素。然后采用经典的盐酸-镁粉实验对提取物进行定性鉴别,以确定其是否为黄酮类化合物[15]。
1.2.3 色素色价的测定方法[4]准确称取色素1g,用pH 3.0的柠檬酸-磷酸氢二钠缓冲液稀释至1000m L,配制成色素原液;吸取10m L原液,用缓冲液稀释至100m L,测定最大吸收波长,并在最大吸收波长处测定其Abs值,用式(1)计算色价。

式中,S:总色价(A/g);A:吸光度;W:原料质量(g);V1:提取液体积(m L);V2:取样体积(m L);n:取样稀释倍数。
1.2.4 静态吸附
1.2.4.1 吸附率和解析率的计算 用滤纸吸干预处理后的大孔树脂,准确称取各0.5g,加入具塞三角瓶;称取0.5g色素,用柠檬酸-磷酸氢二钠缓冲液(pH3.0)1000m L配制成溶液,测定吸光度A0;各取50m L色素溶液加入装有大孔树脂的三角瓶,置于恒温振荡器振荡24h(30℃,150r/m in),过滤,测定滤液的吸光度A1;过滤后的吸附色素的大孔树脂,分别加入50m L 90%乙醇,置30℃和150r/m in恒温振荡器中振荡24h,过滤,测定滤液中色素的吸光度(A2),按下式计算解吸率。
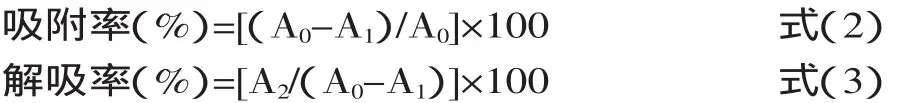
以吸附率与解析率为指标,选取吸附率与解析率高的大孔树脂进行下述工艺参数研究。
1.2.4.2 pH对大孔树脂吸附的影响 量取上述色素原液6份,每份50m L,调节pH分别为2.2、3.0、4.0、5.0、6.0、7.0;准确称取6份选定的大孔树脂,每份0.5g,分别加入色素溶液,30℃150r/m in振荡60m in,过滤,测滤液吸光度,计算吸附率。
1.2.4.3 静态吸附动力学研究 准确称取预处理后的大孔树脂0.5g,置于具塞三角瓶中,加入50m L色素溶液,置50℃恒温振荡器,150r/m in振荡,每隔10m in移取1m L溶液,用95%乙醇定容至5m L,测定吸光度,绘制静态动力学曲线。
1.2.4.4 温度对大孔树脂吸附的影响 准确称取6份大孔树脂,每份0.5g,各加入色素溶液50m L,分别在20、30、40、50、60、70℃下恒温振荡70m in(150r/m in),每隔10m in测色素溶液在最大吸收波长处的吸光度,作吸附率随时间的变化曲线。
1.2.4.5 解析液体积分数对大孔树脂解吸的影响 称取6份经吸附饱和的AB-8大孔树脂,每份0.5g,分别加入50m L体积分数为20%、35%、50%、65%、80%、95%的乙醇水溶液,在水浴振荡器上振荡(30℃,150r/m in)60min,过滤,测定滤液的吸光度。
1.2.5 大孔树脂的动态吸附实验 取上述选定的大孔树脂10g,装入直径为1.2cm的层析柱,进行动态吸附与解析实验,考察上样液浓度、流速以及解析液流速对吸附与解析的影响。
1.2.5.1 上样液浓度对吸附的影响 配制质量浓度0.5、1.0、1.5、2.0、2.5、3.0mg/m L,pH 4.0的色素溶液,以1.0m L/m in流速上样,每5m L收集一次流分,测流出液吸光度。当流出液的吸光度达到上样液的10%时,为泄露点,停止上样,根据上样液体积与浓度计算吸附率。
1.2.5.2 上样液流速对吸附的影响 配制1.2.5.1最佳上样液浓度、pH4.0的色素溶液,分别以0.5、1.0、2.0、3.0m L/m in流速流过树脂,每5m L收集一次流分,测其吸光度。当流出液的吸光度达到上样液的10%时,为泄露点,停止上样,根据上样液体积与浓度计算吸附率。
1.2.5.3 解吸液流速对解吸的影响 配制pH 4.0的色素溶液流经树脂直至达到饱和,然后用3BV蒸馏水洗柱,再以1.2.4.5确定的最佳浓度洗脱液分别在0.5、1.0、1.5、2.0、2.5m L/min流速下洗脱,5m L收集一管,测其吸光度,当吸光度为零时停止洗脱。
1.2.6 实际吸附解析实验 以上述最佳参数上样,每5m L收集一次流分,测吸光度,当流出液吸光度为上样液吸光度的1/10时,停止上样;然后以3BV的蒸馏水洗柱,再以1.2.4.5确定的洗脱液最佳浓度、以1.2.5.3确定的最佳流速及洗脱体积洗脱,合并洗脱液,真空浓缩,测定色价。
2 结果与分析
2.1 西兰花色素的定性鉴别
采用经典的盐酸-镁粉实验测定所提取的色素是否为黄酮类化合物,结果显示阳性反应,因此所提取的成分为黄酮类化合物。
2.2 大孔树脂静态吸附实验
2.2.1 西兰花色素在不同大孔树脂上的吸附及解吸率 实验采用的5种树脂对西兰花色素的静态吸附率和解析率如表1所示,结果显示AB-8在5种大孔树脂中吸附率最高,DM-130、D1300次之,HPD-300、NKA-9最低;AB-8的解析率在所研究树脂中最高。因此,AB-8树脂对西兰花色素具有较好的选择性,后续实验以该树脂为研究对象,考察其静动态吸附与解析性能。

表1 色素在不同大孔树脂上的吸附及解吸率Table1 Adsorption rate and deadsorption rate of differentmacroporous resin
2.2.2 pH对AB-8大孔树脂吸附的影响 在pH分别为2.2、3.0、4.0、5.0、6.0、7.0的条件下,AB-8大孔树脂对西兰花色素的吸附率如表2所示。结果显示,pH= 4.0时AB-8树脂对西兰花色素的吸附率最高。

表2 不同pH条件下AB-8的吸附率Table2 Adsorption rate of AB-8 under different pH conditions
2.2.3 静态吸附动力学特征曲线 静态吸附动力学是树脂的重要性能参数。由图1可知,随着时间的延长,AB-8树脂吸附后色素溶液的吸光度呈现下降的趋势,当吸附50m in以后,吸光度已基本没有变化,表明在此时间点吸附剂已经基本吸附饱和。
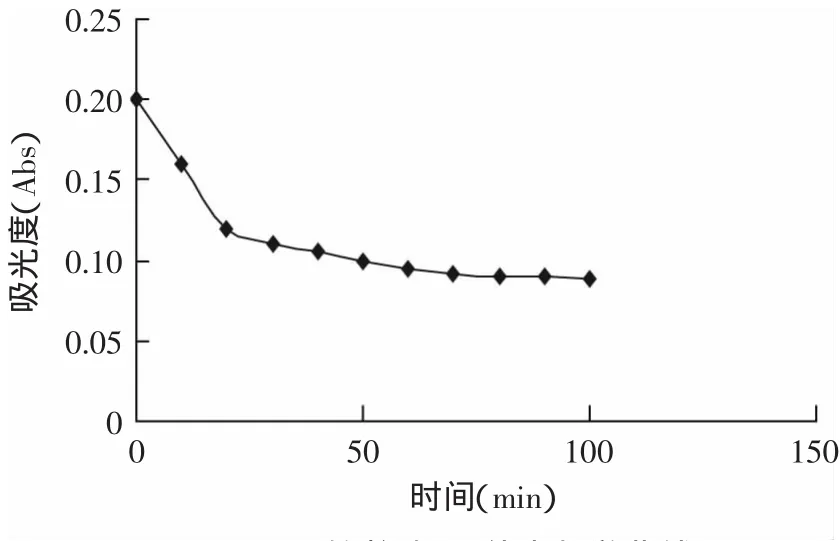
图1 AB-8的静态吸附动力学曲线Fig.1 Static adsorption curve of AB-8
2.2.4 温度对吸附的影响 温度对大孔树脂的吸附有一定的影响。由图2可知,在前40min,吸附率随着温度的升高而升高,在40min以后,随着温度的提高,60、70℃的吸附率反而不如50℃的吸附率,显示温度太高反而不利于吸附。综合考虑,50℃为较为适宜的吸附温度。

图2 不同温度条件下的吸附率Fig.2 Adsorption rate under different temperature conditions
2.2.5 解析液体积分数对解吸的影响 不同体积分数的解析液,其极性不同,对吸附在大孔树脂上的有机物的解析能力不一样,所以有必要考察解析液体积分数对解析的影响。实验采用不同体积分数的乙醇(20%、35%、50%、65%、80%、95%)进行洗脱,结果如图3所示。实验显示随着乙醇体积分数的增加,AB-8大孔树脂对西兰花色素的解析率逐渐增高,但到80%时已基本不变,和95%基本持平,显示西兰花色素适宜于高浓度的乙醇洗脱。为节省成本,在洗脱时选择80%体积分数的乙醇作为洗脱液较为适宜。
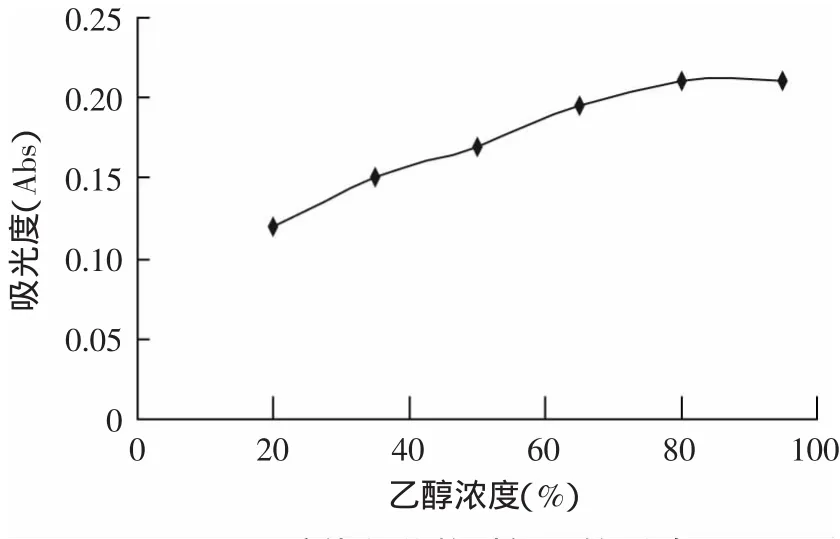
图3 乙醇体积分数对解吸的影响Fig.3 Effectof concentration of ethanol on deadsorption
2.3 大孔树脂的动态吸附
2.3.1 上样液浓度对吸附的影响 上样液浓度对吸附具有一定的影响,为考察上样液浓度与吸附量的关系,取不同浓度的上样液(0.5、1.0、1.5、2.0、2.5、3.0mg/m L)以达到泄露点为终点进行动态吸附研究。结果(图4)显示随着上样液浓度的增加,吸附量随之增加,浓度在2.5mg/m L的上样液的吸附量达到最大,但是进一步增高浓度后,吸附量反而有下降的趋势,其原因是色素分子与树脂之间的吸附需要一定的平衡时间,浓度太高,泄露点提前,反而不利于吸附。

图4 上样液浓度与吸附量的关系Fig.4 The relation between sample concentration and adsorption
2.3.2 上样液流速对吸附的影响 上样液的流速对吸附量有一定的影响,上样液浓度一定,流速越快,泄露的越快。因此,有必要考察上样液流速对吸附的影响,实验取上样液流速分别为0.5、1、2、3m L/m in,结果如图5。由图5可知,随着进样流速的增大,树脂的吸附量降低。当流速为0.5m L/m in时,吸附量最大;当进样流速为1.0m L/m in时,吸附量与流速为0.5m L/m in时相近。考虑到流速低,生产周期长,生产效率低,不利于工业化生产。因此,进样流速为1.0m L/m in较合适。
2.3.3 洗脱液流速对解吸的影响 为考察洗脱液流速对解析的影响,实验采用不同流速的80%乙醇作为洗脱液进行洗脱,每5m L测定一次吸光度,结果如图6所示。实验显示洗脱液流速1.0m L/m in时,流出液的吸光度最早达到最低,40m L体积(4BV)的洗脱液基本将色素洗脱完全。
图5 上样液流速对吸附的影响Fig.5 Effectof sample loading flow rate on adsorption

图6 洗脱液流速对解吸的影响Fig.6 Effectof eluate flow rate on deadsorption
2.3.4 验证实验 根据上述实验结果,选择上样液浓度2.5mg/m L、流速1.0m L/min、pH 4.0、温度50℃上样,达到漏点后,用3BV的去离子水洗柱,然后用80%的乙醇以1.0m L/m in的流速洗脱,洗脱液每5m L一管,洗脱4BV。在此参数下,西兰花色素色价由纯化前的23.7提高到91.7。
3 结论
实验选取5种不同极性的大孔树脂,以对西兰花色素的吸附率和解吸率为指标,筛选出对西兰花色素具有选择性吸附的树脂。结果表明,AB-8树脂对西兰花色素不仅吸附量大而且解吸率高,适合用于西兰花色素的分离和富集。以上样液浓度2.5mg/m L、流速1.0m L/min、pH4.0、温度50℃上样;用80%的乙醇以1.0m L/m in的流速,洗脱4BV后,色素的色价有大幅度的提高,由纯化前的23.7提高到91.7。
[1]刘咏,罗建平.枸杞子中食用色素的提取和稳定性研究[J].食品科学,2005,26(5):168-170.
[2]叶辉,郁建平.老鹰茶(豹皮樟)天然食用色素的初步研究[J].食品科学,2002,23(2):40-43.
[3]孙芸,谷文英.大孔吸附树脂对葡萄籽原花青素的吸附研究[J].离子交换与吸附,2003,19(6)∶561-566.
[4]李进,瞿伟菁.大孔树脂吸附分离黑果枸杞色素的研究[J].食品科学,2005,2(6):47-51.
[5]张怡,关文强,张娜,等.温度对西兰花抗氧化活性及其品质指标影响[J].食品研究与开发,2011,32(8):156-161.
[6]SAHDEOPrasad,KANNOKARN Phromnoi,VIVEK R Yadav,et al.Targeting Inflammatory Pathways by Flavonoids for Prevention and Treatment of Cancer[J].Planta Med,2010,76(11):1044-1063.
[7]王梦楚,李超.AB-8型大孔吸附树脂分离纯化鼠曲草总黄酮工艺[J].食品科学,2011,32(24):88-91.
[8]刘晶晶,刘前进,王雪峰,等.树脂法纯化鸭血糯色素的研究[J].食品科学,2011,32(12)∶156-159.
[9]江敏,胡小军,朱志红.树脂法提取纯化草莓色素的研究[J].食品研究与开发,2008,29(1)∶44-47.
[10]ZHANG Yu,JIAO Jingjing,LIU Chengmei,et al.Isolation and purification of four flavone C-glycosides from antioxidant of bamboo leaves by macroporous resin column chromatography and preparative high-performance liquid chromatography[J].Food Chemistry,2008,107:1326-1336.
[11]CHANGXiulian,WANGDong,CHENBiyun,etal.Adsorption and desorption properties ofmacroporous resins for anthocyanins from the calyx axtract of roselle(Hibiscus sabdariffa L.)[J].J Agric Food Chem,2012,60(9):2368-2376.
[12]LIU Yongfeng,BAIQingqing,LOU Song,et al.Adsorption characteristics of(-)-epigallocatechin gallate and caffeine in the extract of waste tea on macroporous adsorption resins functionalized with chloromethyl,amino,and phenylamino groups [J].JAgric Food Chem,2012,60(6):1555-1566.
[13]LIU Yongfeng,DIDuolong,BAIQingqing,et al.Preparative separation and purification of rebaudioside a from steviol glycosides using mixed-mode macroporous adsorption resins[J].JAgric Food Chem,2011,59(17):9629-9636.
[14]YANG Rui,MENG Demei,SONG Yi,et al.Simultaneous decoloration and deproteinization of crude polysaccharide from pumpkin residues by cross-linked polystyrenemacroporous Resin [J].JAgric Food Chem,2012,60(34):8450-8456.
[15]匡海学.中药化学[M].第二版.北京:中国中医药出版社,2006:138.
