不同精粗比底物下不同添加剂对绵羊瘤胃体外发酵的影响
2013-02-20杨平平甄玉国王晓磊于中英
■杨平平 甄玉国 王晓磊 赵 巍 于中英
(吉林农业大学动物科学技术学院,吉林长春 130118)
目前,如何有效调控瘤胃发酵,促使瘤胃微生物生长和瘤胃发酵达到最佳状态是反刍动物学的热点和难点。抗生素的使用能够有效地降低瘤胃发酵所引起的蛋白质和能量的损失。然而,抗生素存在药物残留和致病菌产生耐药性等种种弊端而被禁止使用[1]。因此,动物营养学家开始研究能够替代抗生素并能有效调控瘤胃发酵的“天然”功能性添加剂。
酵母培养物(Yeast culture,YC)主要是通过向瘤胃微生物提供额外的营养底物刺激反刍动物特定瘤胃微生物区系生长和某些微生物活性的提高,从而提高MCP和VFA的含量[2]。
米曲霉提取物(Aspergillus oryzae extract,AO)能快速有效地促进瘤胃内厌氧真菌和纤维分解菌的生长,使更多的纤维分解菌能与粗纤维接触,从而提高饲料中纤维的消化率[3]。
植物精油(Essential Oils,EO)能够抑制甲烷的产生[4],并通过抑制脱氨基作用,降低NH3-N浓度,从而提高能量和MCP的含量[5]。
综上所述,YC、AO和EO均有独特的调控瘤胃发酵机制,能够促使瘤胃微生物生长和瘤胃发酵达到最佳状态,然而,不同的精粗比对瘤胃发酵以及营养物质代谢的影响存在很大不同,这些添加剂对瘤胃发酵的影响均受日粮精粗比底物的影响。因此,为了更加清楚全面地了解这些添加剂调控瘤胃发酵的作用机制,并将其作用发挥至最大,寻求这些添加剂最适宜的精粗比底物成为必需。
1 材料与方法
1.1 瘤胃液采集
在晨饲前2 h用硬质PVC管从3只体况良好,体重相近(约60 kg)、安装有永久性瘤胃瘘管的绵羊瘤胃不同位点内采集瘤胃液,加入到预热39℃并通有CO2的保温瓶中,采集后立即盖上瓶盖,迅速返回试验室,经四层纱布过滤(期间应将温度保持在39℃左右并且尽可能少与空气接触),滤液等量混合后为瘤胃液的接种液。
1.2 试验日粮与功能性添加剂来源
试验日粮参照绵羊NRC饲养标准(1985),并结合中国肉羊饲养标准配制,主要原料为玉米、豆粕、DDGS、羊草,根据不同的精粗比确定试验日粮组成及营养水平(见表1)。
功能性添加剂:YC由达农威公司购买的益康XP产品;AO由诺伟司公司购买的艾美福产品;EO由宜客福贸易(上海)有限公司购买的恩益300产品。
1.3 试验设计
采用两因素交叉分组试验设计,因素一有4个水平,分别为无添加剂、添加YC、添加AO、添加EO;因素二有3个水平,分别为精粗比3∶7、5∶5、7∶3;每个水平有3个重复;底物量均为0.3 g。在培养前,将底物和添加剂装入发酵瓶中,再将60 ml瘤胃混合发酵液(瘤胃液∶缓冲液=1∶2)装入发酵瓶进行发酵,培养24 h进行采样,并测定培养液pH值、NH3-N、VFA的浓度。
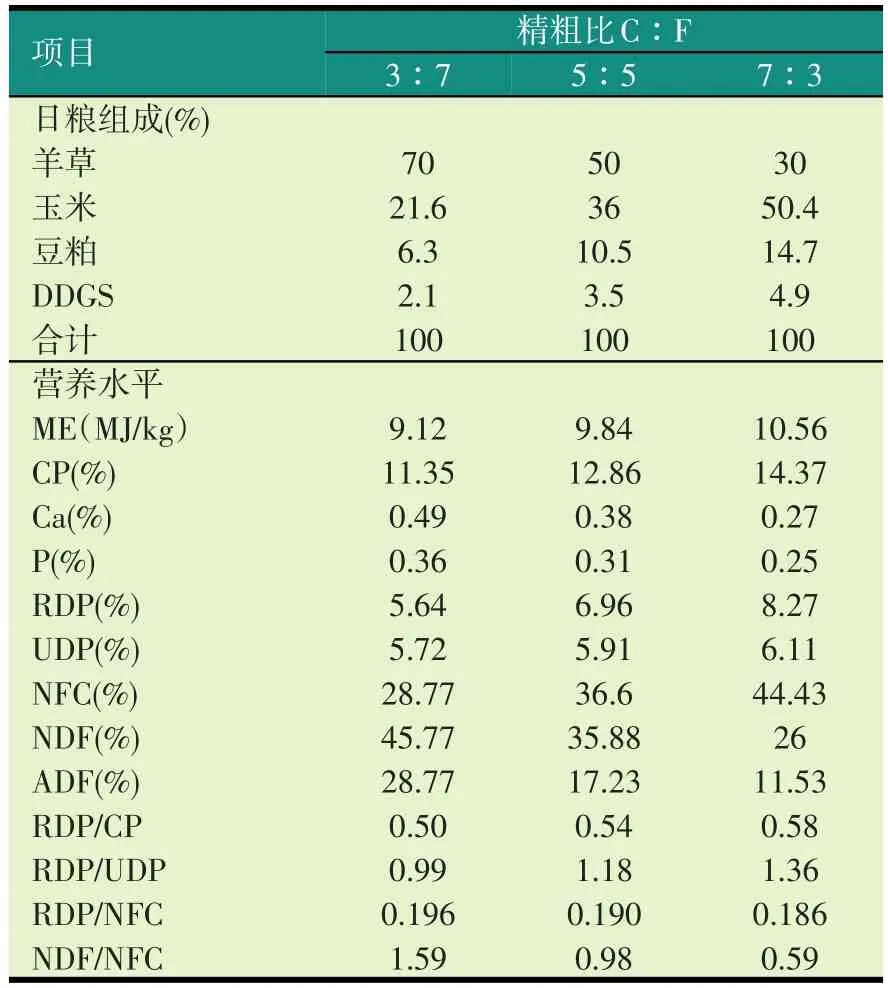
表1 试验日粮组成及营养水平(风干基础)
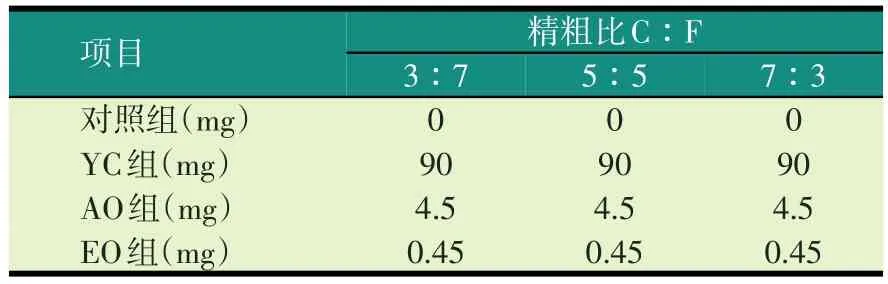
表2 试验设计
1.4 体外批次培养
1.4.1 体外培养装置
培养装置自行设计,主体恒温水浴摇床,用丝扣瓶(容积为250 ml)作为培养瓶;同时,瓶盖中安装硅胶垫,并用封口膜封住瓶口保证发酵的厌氧环境。
1.4.2 缓冲液配制
缓冲液采用Menke和Steingass(1988)[6]的方法配制:缓冲液于培养前1 h准确量取988 ml A液,10 ml B液,2 ml C液,充分混合,通CO2至无色然后将其分装于培养瓶内(每个培养瓶加40 ml),持续通入CO2气体10 min,盖上瓶盖,置于39℃恒温水浴中预热至待用。
1.5 测定指标
在培养24 h时进行采样,测定培养液pH值、NH3-N、VFA浓度。
1.6 测定方法
pH值采用便携式pH计测定;NH3-N测定采用冯宗慈[7]比色法紫外分光光度计Uvmini_1240测定;VFA采用Agilent Technologies 7890A气相色谱仪进行测定(检测器:FID;色谱柱:DB-FFAP;柱箱温度:程序升温过程由65℃升至190℃,每分钟升20 ℃;分流比:50∶1;进样量:1 μl)。
1.7 数据处理
采用Excel整理与统计数据,结果以平均值±标准差表示,用SPSS17.0软件进行比较,其中均值的多重比较用Duncan氏法进行并用单因素ANOVA分析进行数据统计分析。
2 结果与分析
2.1 不同精粗比底物下不同添加剂对培养液pH值的影响(见表3)
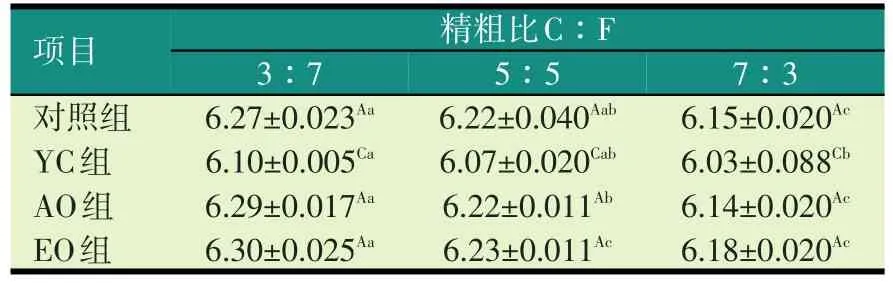
表3 不同精粗比底物下不同添加剂对培养液pH值的影响
由表3可知,随着精粗比的增加,对照组培养液pH值逐渐降低;精粗比3∶7组培养液pH值极显著高于7∶3组(P<0.01),5∶5组显著高于7:3组(P<0.05),而 3∶7组与 5∶5组差异不显著(P>0.05)。YC组在各精粗比底物下,与其他处理组相比,极显著降低培养液pH值(P<0.01);在精粗比3∶7组与7∶3组达到差异显著水平(P<0.05)。AO组和EO组在各精粗比底物下,与对照组相比均有增加培养液pH值趋势,但差异不显著(P>0.05)。且AO组精粗比3∶7组与5∶5组差异显著(P<0.05),与7∶3组达到差异极显著水平(P<0.01);EO组精粗3∶7组极显著高于5∶5组和7∶3组(P<0.01)。AO组和EO组相比,在各精粗比底物下,培养液pH值无显著性变化(P>0.05)。
2.2 不同精粗比底物下不同添加剂对培养液NH3-N浓度的影响(见表4)
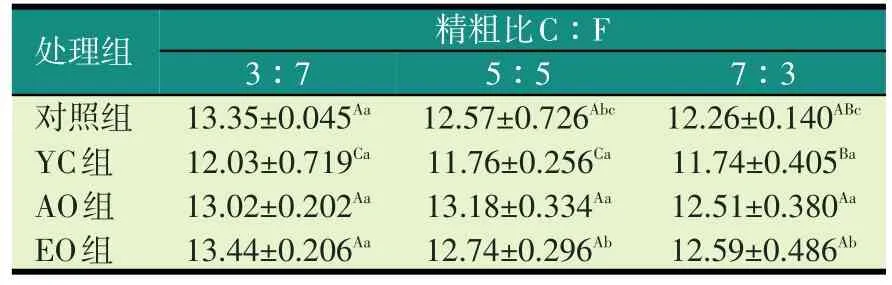
表4 不同精粗比底物下不同添加剂对培养液NH3-N浓度的影响(mg/100 ml)
由表4可知,随着精粗比的增加,培养液NH3-N浓度逐渐降低,精粗比3∶7组显著高于5∶5组(P<0.05),极显著高于7∶3组(P<0.01)。。
YC组在精粗比3∶7和5∶5底物下,与其他处理组相比,极显著降低培养液NH3-N浓度(P<0.01);在精粗比7∶3底物下,与对照组相比,有降低培养液NH3-N浓度趋势(P>0.05),与AO组和EO组相比,显著降低培养液NH3-N浓度(P<0.05)。YC组在各精粗比间相比差异均不显著(P>0.05)。
AO组在精粗比3∶7底物下,与对照组相比有降低NH3-N浓度趋势(P>0.05),在精粗比5∶5、7∶3底物下,与对照组相比有增加NH3-N浓度趋势,但差异均不显著(P>0.05)。AO组在各精粗比间相比差异均不显著(P>0.05)。
EO组在各精粗比底物下,与对照组相比,均增加培养液NH3-N浓度,但差异不显著(P>0.05)。EO组在精粗3∶7组显著高于5∶5组和7∶3组(P<0.05)。AO组和EO组相比,在各精粗比底物下,培养液NH3-N浓度无显著性变化(P>0.05)。
2.3 不同精粗比底物下不同添加剂对培养液VFA的影响(见表5)

表5 不同精粗比底物下不同添加剂对培养液VFA浓度的影响(mmol/l)
由表5可知,随着精粗比的增加,培养液乙酸、丙酸、丁酸和TVFA浓度逐渐增加,不同精粗比组乙酸、丙酸浓度差异不显著(P>0.05),精粗比7∶3、5∶5组丁酸显著高于3∶7组(P<0.05),精粗比7∶3组TVFA浓度显著高于3∶7组(P<0.05)。
YC组除在精粗比5∶5底物下,与AO组相比,乙酸浓度有增加趋势(P>0.05),在精粗比7∶3底物下,与EO组相比,显著降低乙酸浓度(P<0.05),TVFA浓度有降低趋势(P>0.05)外,在各精粗比底物下,与其他处理组相比,极显著增加VFA浓度(P<0.01)。乙酸浓度精粗比7∶3组显著高于5∶5组(P<0.05),丙酸浓度各精粗比间差异不显著,丁酸浓度精粗比7∶3组显著高于3∶7、5∶5组(P<0.05),TVFA浓度精粗比7∶3组显著高于3∶7组(P<0.05),极显著高于5∶5组(P<0.01)。
AO组在精粗比3∶7底物下,与对照组相比,培养液中乙酸、丙酸、TVFA浓度有增加趋势,丁酸浓度有降低趋势,但差异均不显著(P>0.05)。在精粗比5∶5底物下,与对照组、EO组相比,极显著增加乙酸、TVFA浓度(P<0.01)。在精粗比7∶3底物下,与对照组相比,显著增加乙酸(P<0.05),极显著增加TVFA浓度(P<0.01),丙酸、丁酸浓度有增加趋势,但差异不显著(P>0.05)。乙酸精粗比5∶5、7∶3组极显著高于3∶7组(P<0.01);丙酸各精粗比间差异不显著;丁酸精粗比7∶3组极显著高于3∶7组(P<0.01),显著高于5∶5组(P<0.05);TVFA精粗比5∶5、7∶3组极显著高于3∶7组(P<0.01)。
EO组在精粗比3∶7底物下,与对照组相比,增加乙酸、丙酸、TVFA浓度,降低丁酸浓度趋势,但差异均不显著(P>0.05)。在精粗比5∶5底物下,与对照组相比,增加乙酸浓度,降低丙酸、丁酸和TVFA浓度,但差异均不显著(P>0.05)。在精粗比7∶3底物下,与其他处理组相比,极显著增加乙酸浓度(P<0.01);与对照组和AO组相比,极显著增加丙酸和TVFA浓度(P<0.01),显著增加丁酸浓度(P<0.05)。精粗比7∶3组乙酸、丙酸、丁酸、TVFA浓度极显著高于3∶7、5∶5组(P<0.01)。
3 讨论
3.1 不同精粗比底物下不同添加剂对培养液pH值的影响
本试验中,随着精粗比的增加,培养液pH值逐渐降低,表明随着精料比例的提高,瘤胃微生物可发酵非结构性碳水化合物提高,产生VFA增加,pH值下降,这一结果与周为琴[8]和朱素华[9]的研究结果一致。
YC组在各精粗比底物下均能极显著降低培养液pH值,说明YC在各精粗比底物下均能有效刺激特定瘤胃微生物生长及其活性的提高[2],产生大量VFA,降低NH3-N浓度,从而降低培养液pH值。这与唐海翠[10]研究结果相一致。
AO组在精粗比3∶7底物下,能够提高培养液pH值,这与孙安权[3]提出AO能够竞争性地保护饲料中非结构性碳水化合物的快速发酵,使瘤胃微生物对纤维的活动高峰提前到来,从而稳定培养液pH值相一致。而在精粗比7∶3底物下,AO降低培养液pH值,原因可能在于AO显著增加乙酸和TVFA浓度,因此,培养液pH值下降。
EO组在各精粗比底物下均能够提高培养液pH值,原因可能是在各精粗比底物下EO均提高培养液NH3-N浓度,因此培养液pH值提高。
3.2 不同精粗比底物下不同添加剂对培养液NH3-N浓度的影响
本试验中,随着精粗比的增加,培养液NH3-N浓度逐渐降低,原因在于随着精料比例的提高,瘤胃微生物可发酵有机物增加,为瘤胃微生物生长提供能量增加,瘤胃微生物氮合成效率提高,NH3-N浓度降低,这一结果与唐海翠[10]和朱素华[9]的研究结果一致。
YC组在精粗比底物下均能降低培养液NH3-N浓度,但随着精粗比的增加,培养液NH3-N浓度降低幅度逐渐降低,原因可能是蛋白质合成菌为酸性敏感菌[11],随着精粗比增加,培养液pH值不断下降,YC在高精料下对蛋白质合成菌的影响较小,MCP合成效率相对较低,因此培养液NH3-N浓度降低幅度较小。
AO组在精粗比3∶7底物下能够降低培养液NH3-N浓度,可能由两个原因所导致:一是AO降低蛋白质降解速度;二是提高MCP数量[3]。而AO在精粗比5∶5和7∶3底物下能够增加培养液NH3-N浓度,原因可能与上述相反,这一结果说明AO对微生物蛋白质体系受碳水化合物日粮结构的影响。
EO组在各精粗比底物下均提高培养液NH3-N浓度,这与Busquet(2005)[12]报道肉桂醛(31.2 mg/l)对氮代谢没有显著影响结果相一致,而Busquet(2006)[13]提出高剂量(3 000 mg/l)肉桂醛能够降低NH3-N浓度,抑制瘤胃细菌的脱氨基作用。本试验EO的主要成分为肉桂醛和大蒜素,添加剂量为75 mg/l,因此结果不一致可能与EO添加量有关。
3.3 不同精粗比底物下不同添加剂对培养液VFA浓度的影响
VFA的含量是评价瘤胃发酵能力的重要指标,受日粮碳水化合物结构比例的影响。本试验中,随着精粗比的增加,培养液VFA浓度逐渐增加,这与朱素华[9]的研究结果一致。
YC在各精粗比底物下均能极显著提高VFA浓度,在精粗比3∶7底物下乙酸增加幅度较大,在精粗比7∶3底物下丙酸和丁酸增加幅度较大,这一结果说明YC在各精粗比底物下均能有效刺激瘤胃微生物的生长及其活性的提高,在高粗料底物下对纤维分解菌的影响较大,在高精料底物下对淀粉分解菌的影响较大。
AO组在精粗比5∶5和7∶3底物下显著或极显著增加乙酸和TVFA浓度,原因可能在于AO促进瘤胃厌氧真菌和纤维分解菌的生长,瘤胃真菌能够打破木质素和半纤维素连接,为纤维分解菌提供更多与粗饲料接触面积,提高纤维消化率[3]。这与Martin(1990)[14]表明AO在不同的浓度均能刺激瘤胃微生物的发酵,提高乙酸、丙酸、TVFA浓度的结果相一致。而在精粗比3∶7底物下,AO提高VFA浓度的幅度较小,原因可能在于AO在精粗比3∶7底物下降低培养液NH3-N浓度,此时瘤胃微生物利用一部分VFA提供碳架合成MCP,因此,VFA增加的幅度较小。
EO在精粗比7∶3底物下能够显著或极显著提高VFA浓度,而在其他精粗比底物下EO对VFA无显著性影响,说明EO在高精料条件下对纤维分解菌的生长促进作用较强,这与Spanghero(2008)[11]提出日粮类型和pH值均会影响EO对瘤胃发酵的效果,最初pH值为5.5时EO对VFA的影响较大的结果相一致。
4 结论
①从整体趋势看,随着精粗比的增加,培养液VFA浓度逐渐增加,pH值、NH3-N浓度逐渐降低。
②YC组在各精粗比底物下与对照组相比,极显著提高培养液VFA浓度,极显著降低pH值(P<0.01),对NH3-N浓度的影响仅在精粗比3∶7和5∶5组达到显著水平(P<0.05)。
③AO组在精粗比5∶5底物下,与对照组相比,极显著增加乙酸、TVFA浓度(P<0.01);在精粗比7∶3底物下,与对照组相比,显著增加乙酸(P<0.05),极显著增加TVFA浓度(P<0.01)。
④EO组在精粗比7∶3底物下,与对照组相比,极显著增加乙酸、丙酸和TVFA浓度(P<0.01),显著增加丁酸浓度(P<0.05)。
5 应用指导
YC、AO、EO在特定的精粗比底物下均能有效地调控瘤胃发酵,YC在不同精粗比底物下添加均有较好的瘤胃发酵效果,而AO和EO在高精料条件下添加调控的效果较好。
