发酵液中金褐霉素提取工艺的优化及鉴定
2013-02-19孟宪军王秋雨
魏 杰, 金 爽, 孟宪军, 王秋雨
(1.辽宁大学 生命科学院,辽宁 沈阳 110036;2.沈阳农业大学 食品学院,辽宁 沈阳 110161)
金褐霉素(Aureofuscin)是链霉菌新种—金褐链霉菌(Streptomyces aureofuscus.n.sp)产生的一种四烯大环内酯类抗真菌抗生素,其化学结构与国外文献报道的纳他霉素(Natamycin)结构相似。早期研究表明,金褐霉素对霉菌、多种酵母菌及丝状真菌有很强的抗菌作用,但不抗细菌,临床上用于治疗真菌性角膜炎,其疗效优于两性霉素B,同时对一些真菌引起的皮肤病及霉菌性阴道炎等也有很好疗效。金褐霉素早在1975年发现时只做了早期化学结构和初步药效试验后,一直未作深入研究和进行产业化开发[1-3]。在1997年我国正式批准使用纳他霉素作为安全食品防腐剂后,金褐霉素才被重新重视起来。由于未作高产菌种选育和分离提取工艺的深入研究,发酵单位和提取收率都不高,难以达到产业化开发要求[4-6]。鉴于金褐霉素与纳他霉素有着相似的化学结构和生物活性,而纳他霉素现在主要依赖进口,因此金褐霉素的研究开发在真菌疾病的防治和食品防腐上显示出了极好的应用前景和市场潜力,这对促进新药研制、食品防腐和发酵工业的发展都具有积极意义。
目前关于金褐霉素提取和检测方面的研究报道很少。本研究是在项目组前期研究工作基础上,采用大孔吸附树脂从发酵液中分离提取金褐霉素,筛选出较优的金褐霉素吸附剂,然后确定金褐霉素提取纯化的最适工艺条件;并对所得提取物样品采用红外光谱、核磁共振进行检测分析,鉴定金褐霉素的结构及其理化性质,同时进一步验证提取工艺的效果。
1 材料与方法
1.1 菌种
金褐链霉菌 (Streptomyces aureofuscus.n.sp)由沈阳农业大学食品学院实验室保存菌种。
1.2 培养基
1.2.1 种子培养基(组分g/dL) 葡萄糖2,玉米淀粉 1.5,黄豆粉 1,蛋白胨 0.3,玉米浆 1,酵母粉 1,MgSO4·7H2O 0.05,NaCl 0.4,CaCO30.6;pH 自然[7]。
1.2.2 发酵培养基(组分g/dL) 葡萄糖4,玉米淀粉 2, 蛋 白 胨 0.3, 黄 豆 粉 1,MgSO4·7H2O 0.05,CaCO30.6[8]。
1.3 摇瓶发酵实验
将斜面活化好的菌种用挖块法接种于装有50 mL种子培养基的250 mL三角瓶中,220 r/min摇床培养,29℃培养40 h,使菌体处于迅速生长期。然后以体积分数10%接种种子液到装液量为50 mL发酵培养基的250 mL三角瓶中,29℃、220 r/min摇床发酵72 h。
1.4 金褐霉素提取工艺优化
1.4.1 金褐霉素提取工艺路线


1.4.2 树脂的筛选 树脂的吸附率和解吸率是衡量树脂的重要指标,不仅吸附量大,还要求解吸率高,以保证成分最大限度地回收。作者选用8种大孔吸附树脂(X-5大孔吸附树脂;HPD100、HPD400、HPD600、HPD200A、AB-8 大孔吸附树脂;D101 大孔吸附树脂、WD-6大孔阴树脂)进行静态吸附试验和甲醇解吸试验,比较它们的吸附率和解吸率,从中选择出最适合的树脂作为试验采用的处理树脂。
1.4.3 树脂的吸附和解吸 准确称取1 g湿树脂于锥形瓶中,加20 mL金褐霉素发酵粗提液,封口,避光置于摇床中,在18℃、100 r/min的条件下振荡吸附一段时间,将上述吸附饱和的大孔树脂用水洗至流出液无色,滤纸吸干树脂表面残留的溶液,加入一定量甲醇,在相同的条件下振荡解吸一段时间,收集解吸液,蒸发到体积为20 mL[9-11]。分别测吸附前、后溶液中金褐霉素浓度按下列方程计算:

式中,Q为吸附率 (%);c0为吸附前质量浓度(mg/mL);c1为吸附后质量浓度 (mg/mL);c2为解吸后质量浓度(mg/mL);D 为解吸率(%)。
1.5 金褐霉素含量的测定
取发酵液 (总体积6.0 L)1 mL,加入9 mL甲醇,充分振荡后离心(3 000 r/min,20 min)除去菌丝体的不溶物,取1 mL上清液用甲醇进行10倍数的稀释后,高速离心(10 000 r/min,10 min),所得上清液即为HPLC待测液。
1.5.1 高效液相色谱法(HPLC) 流动相为甲醇∶水∶冰醋酸 (体积比 60∶40∶1), 流速 1.0 mL/min, 进行HPLC等度洗脱,对金褐霉素进行定性定量检测。
1.5.2 紫外光谱法 通过紫外分光光度计在波长200~400 nm内扫描,获得金褐霉素最大吸收波长为302.5 nm,作为金褐霉素的检测波长。
1.6 金褐霉素提取样品的鉴定
1.6.1 红外光谱分析法 将待测样加入100 mg干燥的KBr,在4 000~400 cm-1范围红外扫描。本实验提取样品由沈阳农业大学生物中心检测。
1.6.2 核磁共振分析法 将SCP-BI5 mg分别溶于0.5 mL D2O中,在600 M超导核磁共振仪上分别测其1H-NMR、13C-NMR谱及二维谱。本实验提取样品由北华大学生物测试中心检测。
2 结果与分析
2.1 大孔吸附树脂的筛选
大孔树脂的吸附性能主要取决于吸附剂的表面性质,即树脂的极性和空间结构。作者将金褐霉素提取液进行减压浓缩,在温度25℃、转速100 r/min的条件下进行吸附和解吸,用100%甲醇进行洗脱,吸附和解吸时间均为24 h,实验选取8种大孔吸附树脂进行筛选,结果见表1。

表1 不同大孔树脂对金褐霉素的吸附与解吸Table 1 Adsorptive and desorption rate of different macroporous adsorption resin for Aureofuscin
从表 1 可以看出,HPD400、X-5、WD-6、AB-8四种树脂的吸附率较高,均可达到50%以上,X-5达78.7%;HPD100树脂和X-5树脂的解吸率较好,HPD100解吸率达93.5%,X-5达93.7%。吸附率和解吸率都是树脂实验考察的重要指标,在生产上不仅要求树脂的吸附率大,还要求解吸率高,以保证有效成分最大限度回收。因此,综合吸附率和解吸率两个指标,选择X-5型树脂作为金褐霉素纯化树脂并进行后续实验。
综合本课题组前期实验结果,金褐霉素提取工艺路线优化为:取金褐链霉菌发酵液3 000 r/min离心20 min,保留上清液。将含有菌丝体的不溶物用95%的乙醇浸提2次,合并浸提液,减压浓缩至原发酵液体积的1/4,将浓缩液和保留的上清液充分混合,并调pH值至8.0。将混合液过X-5大孔吸附树脂柱,80%乙醇洗脱,将洗脱液减压浓缩、抽滤得到黄色粉末,在甲醇中重结晶得到金褐霉素结晶物。
2.2 金褐霉素的红外光谱分析鉴定
有机化合物的化学键或官能团都有各自的特征振动频率,通过测定化合物的红外吸收光谱,根据吸收带的位置,推断出分子中可能存在的化学键或官能团,再结合其它信息便可确定化合物的结构[12]。
图1为提取样品金褐霉素的红外吸收光谱(KBr),结果显示其在 3 372.77、1 743.65、1 654.55、2 927.33 cm-1等处均有典型吸收峰。3 500~3 300 cm-1区域内3 372.77 cm-1处的吸收峰是O—H,NH2的伸缩振动,表明存在分子间和分子内氢键;3 100~2 800 cm-1区域内 2 927.33 cm-1处的吸收峰是C=C的伸缩振动;1 800~1 500 cm-1区域内 1 743.65 cm-1处的吸收峰是C=O的非对称伸缩振动;1 654.55 cm-1处的吸收峰是C=O对称伸缩振动。综上所述,所得到的目的产物是金褐霉素,它是大环内酯类的,同时也进一步证明本实验提取样品的工艺效果较好。

图1 金褐霉素的红外吸收光谱图Fig.1 IR spectrum of Aureofuscin product
2.3 金褐霉素的核磁共振分析鉴定
天然化合物的结构鉴定是一项繁杂的工作,通常需要多种光谱学方法与化学方法相结合,才能确定物质的分子结构。X-衍射测定化合物的晶体结构是解析天然化合物结构最有效而且准确可靠的手段,但并非所有化合物都能够得到完美的单晶样品。因此,核磁共振技术仍然是确定天然化合物结构的最主要手段,体现了独特的优势。近20年来核磁共振技术的发展十分迅速,两维核磁共振可用于分析原子之间的相关性,傅立叶变换技术提高了核磁共振的灵敏度、高频超导核磁则提高了分辨率。核磁共振技术的发展对天然化合物的结构鉴定起到了极大的推动作用[13-15]。
作者采用核磁共振技术手段进一步确定其化学结构。金褐霉素产品的核磁共振碳谱和氢谱分别见图2~3。谱图中的化学位移与各碳原子、氢原子相对应。13C-NMR图谱解析如下:图中共有25个峰,对应于金褐霉素分子结构中的25个碳原子。由于相临的两个核之间的自旋偶合或自旋干扰,吸收峰发生裂分现象。因此,谱图中不仅有单峰,还有二重峰、三重峰和四重峰。在δ48.450附近有一强吸收峰,对应于C*-NH2,而氢谱中δ4.906处出现的强吸收则对应N—H。通过金褐霉素和纳他霉素的核磁共振谱和氢谱图的对比,可以看出金褐霉素与纳他霉素具有相似的化学结构,进一步证明我们得到的产物是金褐霉素。

图2 金褐霉素产品的核磁共振碳谱图(13C-NMR)Fig.2 13C-NMR spectrum of aureofuscin product
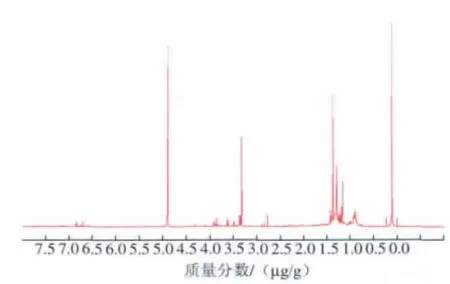
图3 金褐霉素产品的核磁共振氢谱图(1H-NMR)Fig.3 1H-NMR spectrum of aureofuscin product
3 结语
X-5大孔吸附树脂金褐霉素吸附率和解吸率高,可以作为纯化金褐霉素的树脂。此方法建立了大孔吸附树脂纯化金褐霉素的方法,所得金褐霉素纯度较高,是一种简单实用的金褐霉素纯化方法。采用大孔树脂吸附分离方法制得的金褐霉素成品经高效液相分析含量和纯度较高,比溶剂萃取法制得的含量提高很多,说明大孔吸附树脂对金褐霉素的提取纯化有一定的应用价值。经过分离提取工艺的深入研究,可以解决提取收率不高,难以达到产业化开发的问题。
通过红外光谱、核磁共振碳谱和氢谱图的分析,进一步鉴定我们得到的目的产物是金褐霉素,同时也更深入地了解金褐霉素的结构及其理化性质。
[1]上海药物研究所金褐霉素研究小组.一种新的抗真菌的抗生素——金褐霉素[J].微生物学报,1975,15(3):180-187.Institute of Pharmaceutical Research in Shanghai (IPRS) in China.Aoriginal antimycotic antibiotic-aureofuscin[J].Chin J Microbiol,1975,15(3):180-187.(in Chinese)
[2]Basilico J C,Debasilico M Z,Chlericattic,et al.Characterization and contron of thread mould in cheese[J].Lett Appl Microbiol,2001,32(6):419-423.
[3]王富金,武济民.金褐霉素微生物检定法[J].抗生素,1980,5(5):25-26.WANG Fu-jin,WU Ji-min.Aure ofuscin biological standardization[J].Antibiotic,1980,5(5):25-26.(in Chinese)
[4]范德彰,蔡松年.金褐霉素治疗真菌性角膜溃疡——实验研究及248例临床疗效观察[J].中华眼科杂志,1985,21(5):257-259.FAN De-zhang,CAI Song-nian.Aureofuscin cure mycotic corneal ulcer——empirical study and 248 clinical curative effect view[J].China Ophthalmology Journal,1985,21(5):257-259.(in Chinese)
[5]Basilico J C,Debasilico M Z,Chlericatti C,et al.Characterization and contron of thread mould in cheese[J].Lett Appl Microbiol,2001,32(6):419-423.
[6]魏杰,孟宪军.金褐霉素高产菌株的选育及其发酵条件的优化[J].食品与生物技术学报,2009,28(2):240-242.WEI Jie,MENG Xian-jun,JIANG Qiu-shi.Study on the breeding of high aureofuscin producing strains and their fermentation conditions[J].Journal of Food Science and Biotechnology,2009,28(2):240-242.(in Chinese)
[7]魏杰,孟宪军.前体对金褐霉素生物合成的影响[J].食品与生物技术学报,2009,28(3):429-432.WEI Jie,MENG Xian-jun.Effect of precursor on aureofuscin biosynthesis[J].Journal of Food Science and Biotechnology,2009,28(3):429-432.(in Chinese)
[8]高萍.大孔树脂在天然药物分离纯化中的应用[J].天津药学,2006,18(2):63-66 GAO Ping.Application of macroporous adsorbing resins in the separation and purification of natural medicines[J].Tianjin Pharmacy,2006,18(2):63-66.(in Chinese)
[9]黎海彬,李小梅.大孔吸附树脂及其在天然产物研究中的应用[J].广东化工,2005(3):22-52.LI Hai-bin,LI Xiao-mei.Application of macroporous adsorbing resins in natural products research[J].Guangdong Chemical Industry,2005(3):22-52.(in Chinese)
[10]黄少伟,池汝安,张越非,等.大孔吸附树脂分离纯化土茯苓总黄酮[J].中国中医药杂志,2008,33(10):1133-1137.HUANG Shao-wei,CHI Ruan,ZHANG Yue-fei,et al.Separation and purification of flavonoids from Smilax glabra by macroporous adsorption resin[J].China Journal of Chinese Materia Medica,2008,33(10):1133-1137.(in Chinese)
[11]李晋,徐怀德,米林峰.洋葱多糖的分离纯化及单糖组成研究[J].中国食品学报,2012,12(2):202-206 LI Jin,XU Huai-de,MI Lin-feng.Isolation,purification and monosaccharide analysis of polysaccharide from onion[J].Journal of Chinese Institute of Food Science and Technology,2012,12(2):202-206.(in Chinese)
[12]Partanen R,Marie V,Macnaughtanw,et al.1H-NMR study of amylose films plasticised by glycerol and water[J].Carbohydrate Polymers,2004,56:147-155.
[13]Ruan R,Zou C,Wadhawan C,et al.Studies of water mobility and shelf life quality of precooked wild rice using pulsed NMR[J].Journal of Food Processing and Preservation,1996,21(2):91-104.
