食品和饲料中火鸡源性成分的实时荧光PCR检测方法
2013-02-19张舒亚谌鸿超刘月明李富威
张舒亚, 谌鸿超, 宋 青, 高 琴,吕 蓉, 李 想, 刘月明, 李富威
(1.上海出入境检验检疫局,上海 200135;2.上海海洋大学 食品学院,上海201306)
在动物产品原料和加工产品中,经常出现成分的掺假造假和无意污染现象。人为搀假主要是不法商要降低成本或增加品质,以谋取巨额经济利益,如三聚氰胺奶粉、地沟油、染色馒头事件等,这是欺诈违法行为。这种掺假造假、以次充好的行为除了严重扰乱我国经济秩序,另一个最主要影响是危害人体健康和畜禽安全。在加工产品的造假掺假过程中,经常会使用有毒有害物质(如染色馒头等),危害人民身体健康。疯牛病和禽流感的世界性爆发和流行,人们越来越关注食品安全和饲料安全。部分人群因为健康缘故也只食用素食部分。疯牛病的发生是由于反刍动物食用了含有动物成分的饲料,所以各国禁止含有动物成分的饲料喂养动物。由于含有禽成分的饲料可能具有传播禽流感的风险,用这些掺假的饲料喂养动物,会影响畜禽的健康生长及我们的畜牧业安全。《中华人民共和国产品质量法》、《中华人民共和国食品卫生法》和《食品标识管理规定》(国家质量监督检验检疫总局令第102号)等法律法规禁止产品的造假掺假行为和正确标识食品标签。
为保持产品的真实性,国内外研究学者建立了食品和饲料中牛、羊、猪等多种物种成分以及鱼翅等高附加值产品的检测方法[1-9]。目前对火鸡源性成分检测研究报道还不多,国内还未见火鸡源性成分检测的研究报道。作者采用实时荧光PCR检测方法对火鸡成分进行鉴定,确保火鸡及相关产品的真实性,该方法的推广应用对保障产品质量安全,保护消费者知情权和选择权,打击掺假造假违法行为和保护畜牧业健康发展等提供技术支持。
1 材料与方法
1.1 实验材料
火鸡、鸡肉、鸭肉、鹅肉、鸽子、鹌鹑、牛肉、猪肉、山羊肉、绵羊肉、梅花鹿肉、骆驼肉、马肉、驴肉、兔肉、野兔肉、野猪肉、貉肉、蛇肉、牛蛙、蛤蟆肉、草虾、螃蟹、甲鱼、牡蛎、贻贝、蜗牛等27种动物材料:购自上海市农贸市场或超市;大豆、玉米、大麦、小麦、大米、马铃薯、番茄、豌豆、苹果、胡萝卜等10种常见植物材料:购自上海市农贸市场或超市;15批进口冻火鸡腿肉、火鸡脯肉和火鸡颈肉,10个进口未标识火鸡成分的食品(包括面包、香肠、饼干等),20批鸡肉骨粉饲料,20批其他成分饲料(包括猪肠膜蛋白粉、多福蛋白、乳清粉、宠物饲料等):由作者所在实验室保存。2个国内市场火鸡产品,各6种鸡、鸭、鹅、鸽子、鹌鹑等30种禽肉和蛋产品,20批其他成分食品(肉干、肉酱、饼干、罐头等):购自上海市农贸市场或超市。
1.2 试剂
CTAB提取缓冲液:20 g/L CTAB,1.4 mol/L NaCl,0.1 mol/L Tris-HCl,0.02 mol/L Na2EDTA,pH 8.0。蛋白酶K:20 mg/mL。CTAB沉淀溶液:5 g/L CTAB,40 mmol/L NaCl。氯仿(三氯甲烷)。70%乙醇。TE 缓冲液(Tris-Cl、EDTA 缓冲液):10 mmol/L Tris-HCl(pH 8.0),1 mmol/L EDTA(pH 8.0)。 实时荧光PCR混合液:Taqman Gene Expression Master Mix(AB 公 司 ,Part No.4369016)。 PCR 预 混 合 液:Premix Ex Taq Version2.0 (TaKaRa 公 司 ,Code:D332A)。 超纯水(ddH2O)。
火鸡源性检测正向引物:5’-GCC CTA ACC CCT TAA GAA AAG AAT-3’,反向引物:5’-AGT TGC TAT GGC TAA GTC AAG TTT ACA C-3’,探针:5’-FAM-CTT GCT TGA GCC ACA CC-MGB-3’。
18S rRNA检测引物:5’-TCT GCC CTA TCA ACT TTC GAT GGT A-3’ 和 5’-AAT TTG CGC GCC TGC TGC CTT CCT T-3’。
1.3 仪器设备
ABI 7300实时荧光PCR仪,天平,移液枪,离心机,恒温孵育器,冷冻碾磨机,DNA冷冻干燥离心机,核酸蛋白浓度分析仪,Eppendorf离心管,PCR反应管。
1.4 样品的制备
用冷冻研磨机将上述植物材料和动物材料样品研磨成粉状。使用冷冻研磨机将鸡肉和火鸡肉磨成粉末状,并于60℃烘干3 h。用鸡肉粉与火鸡肉粉混合,配制成分别含有质量分数10%、1%、0.1%、0.01%、0.001%和0.000 1%火鸡肉粉的混合样品。
1.5 DNA的提取
将样品研磨后,称取100 mg样品于2 mL离心管中,加入1.5 mL CTAB提取缓冲液和10 μL蛋白酶K(20 mg/mL)溶液。60℃振荡过夜后13 000 g离心10 min,转移上清液到新的离心管中。加入750 μL氯仿后用力振荡,13 000 g离心5 min,将上清转移到新的离心管中。加入2倍体积的CTAB沉淀溶液,室温静置60 min,13 000 g离心15 min,弃去上清。加入350 μL NaCl溶液将沉淀进行悬浮。再加入350 μL氯仿,涡旋振荡进行混匀,13 000 g离心10 min。转移上清液后加入0.6倍体积的异丙醇用来沉淀核酸,室温放置20 min,13 000 g离心10 min,弃去上清液。加入500 μL 70%乙醇溶液洗涤沉淀,溶解于200 μL TE溶液中,用核酸蛋白含量测定仪测定DNA浓度,也可用等效的商业化DNA提取试剂盒提取模板DNA。
1.6 DNA浓度测定及配制
用德国Eppendorf Biophotometer型核酸蛋白浓度分析仪测定抽提样品DNA的质量浓度。
用鸡肉DNA溶液(质量浓度100 ng/μL)将抽提的火鸡肉 DNA溶液(浓度 100 ng/μL)稀释成 10、1、0.1、0.01、0.001、0.000 1、0.000 01 ng/μL DNA 混合液,用于灵敏度测试。
1.7 PCR测试
过敏原大豆成分实时荧光PCR检测的反应体系:实时荧光PCR混合液12.5 μL,正反向引物(10 μmol/L)各 1 μL,探针(5 μmol/L)0.5 μL,模板 DNA 100 ng,水补足至25 μL。实时荧光PCR反应循环参数:50 ℃,2 min;95 ℃,10 min;95 ℃,15 s,60 ℃,1 min,40 个循环。
18S rRNA基因引物PCR反应体系:PCR预混合液 12.5 μL,引物(5 μmol/L)各 0.5 μL,模板 100 ng, 反应体积为 25 μL。扩增条件为:94℃,3 min;94 ℃,20 s,54 ℃,40 s,72 ℃,40 s,40 个 循环 ;72℃,5 min。取 10 μL PCR 产物,加 1 μL 10×上样缓冲液点样进行琼脂糖凝胶电泳。PCR产物电泳检测所用的凝胶质量浓度为1.5~2.0 g/dL。
2 结果与分析
2.1 真核生物特异引物18S rRNA引物的检测结果
18S rRNA基因在真核生物中高度保守,18S rRNA基因特异引物在真核生物DNA中均能有效扩增,常用于真核生物的内参照基因。用真核生物18S rRNA特异引物扩增本实验提取的所有DNA溶液(包括各种动物或植物材料的DNA溶液),所有DNA溶液均能出现137 bp的特异扩增条带。结果表明,所有抽提的DNA溶液适合于PCR测试。
2.2 火鸡成分的实时荧光PCR特异性检测
以火鸡12S rRNA基因为靶标,设计火鸡检测引物和探针序列。用火鸡源性检测引物对火鸡和供试的其他动物和植物进行检测,在火鸡DNA中出现扩增,而在鸡肉、鸭肉、鹅肉、鸽子、鹌鹑、牛肉、猪肉、山羊肉、绵羊肉、梅花鹿肉、骆驼肉、马肉、驴肉、兔肉、野兔肉、野猪肉、貉肉、蛇肉、牛蛙、蛤蟆肉、草虾、螃蟹、甲鱼、牡蛎、贻贝、蜗牛、大豆、玉米、大麦、小麦、大米、马铃薯、番茄、豌豆、苹果、胡萝卜等36种常见动植物材料DNA样品中均无扩增,见图1。这说明该检测方法具有物种特异性。

图1 火鸡源性引物探针特异性实时荧光PCR检测图谱Fig.1 Specific detection of real-time PCR for turkey
2.3 火鸡成分的实时荧光PCR检测灵敏度
对 10、1、0.1、0.01、0.001、0.000 1、0.000 01 ng/μL火鸡 DNA 进行检测, 在 10、1、0.1、0.01、0.001、0.000 1 ng/μL火鸡DNA中出现扩增,在0.000 01 ng/μL火鸡DNA中未出现扩增,见图2。实验表明,火鸡源性检测引物检测灵敏度为0.000 1 ng/μL火鸡DNA。

图2 火鸡DNA实时荧光PCR检测灵敏度图谱Fig.2 Amplification curve generated by serial dilution of turkey DNA
用鸡肉粉10倍系列混合配制不同含量的火鸡肉粉样品。使用火鸡成分引物和探针对质量分数10%、1%、0.1%、0.01%、0.001%和 0.0001%火鸡肉粉的样品DNA进行检测。10%、1%、0.1%、0.01%和0.001%火鸡肉粉均出现扩增曲线,而0.000 1%火鸡肉粉未出现扩增曲线,见图3。实验表明,该方法的检测灵敏度为0.001%(10 mg/kg)火鸡肉粉。
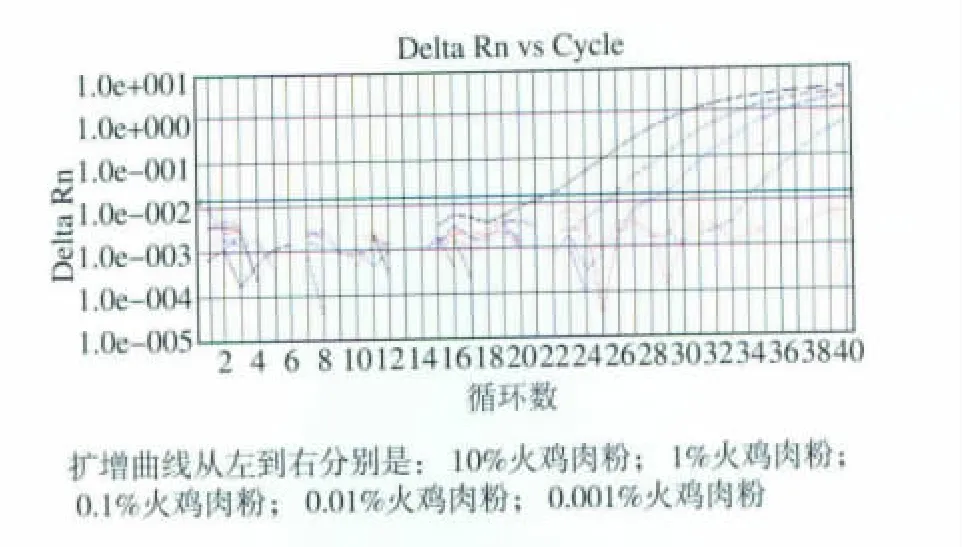
图3 火鸡肉粉质量比的实时荧光PCR检测灵敏度图Fig.3 Amplification curve generated by different turkey percentage
2.4 食品中火鸡成分检测的应用
使用建立的检测方法对15个进口火鸡产品、10个、52个国内市场流通的市售食品以及进口40批饲料进行检测,以验证检测方法的实际应用性。经对117个食品和饲料样品进行检测,在15批进口样品和2个国内火鸡产品中检测出火鸡成分,检测结果与食品成分相符;在10个进口未标识火鸡成分的食品,国内市场的30个禽肉蛋制品和20批其他成分食品中未检出火鸡成分,检测结果与食品成分相符;在1批美国进口的鸡肉骨粉饲料检出火鸡成分,在其他的19批鸡肉骨粉饲料和20批其他成分饲料未检出火鸡成分,见表1。结果表明,研究建立检测方法能够适用于食品和饲料的火鸡源性成分检测。

表1 食品和饲料中火鸡源性成分检测结果Table 1 Test results of commercial food and feed samples
3 结语
目前对物种成分的鉴定,基本上是采用生物技术手段,以蛋白质为基础的检测技术(如ELISA)和核苷酸为基础的检测技术(如PCR)。PCR检测方法由于其高特异性和高灵敏度广泛应用于加工产品(尤其是深加工产品)的检测[1-13]。12S rRNA基因序列由于保守特异而常被选用于动物源性成分鉴别,I Martín 和 Miguel A Rodríguez 报 道 了 以 12S rRNA为检测靶标的火鸡普通PCR检测方法[11-12],其检测限为0.1%~1%。2012年Zulal Kesmen报道了基于火鸡NADH脱氢酶检测靶标的检测方法,其检测限为0.001%[13]。作者以火鸡12S rRNA基因为靶标,研究建立了食品和饲料中火鸡成分实时荧光PCR检测方法,特异性强,灵敏度高,检测限为0.001%(10 mg/kg),能准确检测出食品和饲料中的火鸡成分,为食品和饲料中火鸡成分检测方法标准化提供了依据。
[1]Miguel A Rodríguez,Teresa García,Isabel González,et al.PCR identification of beef,sheep,goat,and pork in raw and heattreated meat mixtures[J].J Food Prot,2004,67(1):172-177.
[2]Miguel A Rodríguez,Teresa García,Isabel González.Quantitation of mule duck in goose foie gras using taqman real-time polymerase chain reaction[J].J Agric Food Chem,2004,52(6):1478-1483.
[3]张舒亚,金丽琴,蒋剑琼,等.食品中鱼源性成分PCR检测方法研究[J].食品与发酵工业,2010,1:142-145.ZHANG Shu-ya,JIN Li-qin,JIANG Jian-xiong,et al.Identification of fish derived material in food[J].Food and Fermentation Industries,2010,1:142-145.(in Chinese)
[4]张舒亚,吕蓉,刘月明,等.硫酸软骨素中掺假动物成分检测方法研究[J].食品工业科技,2009,1:309-318.ZHANG Shu-ya,LV Rong,LIU Yue-ming,et al.Identification of animal derived material in chondroitin sulfate[J].Science and Technology of Food Industry,2009,1:309-318.(in Chinese)
[5]张舒亚,管薇薇,刘月明,等.饲料中鱼源性成分真实性鉴别研究[J].饲料研究,2009,6:45-48.ZHANG Shu-ya,GUAN Wei-wei,LIU Yue-ming,et al.Identification of fish derived material in feed[J].Feed Research,2009,6:45-48.(in Chinese)
[6]张舒亚,李艳,潘良文.鸡精调味料中鸡源性成分真实性鉴别研究[J].中国调味品,2007,12:60-62.ZHANG Shu-ya,LI Yan,PAN Liang-wen.Identification of chicken derived material in chicken essence seasoning[J].China Condiment,2007,12:60-62.(in Chinese)
[7]郭云霞,冒海琳,张舒亚,等.鱼翅的分类及鉴别方法[J].食品工业,2011,6:96-99.GUO Yun-xia,MAO Hai-lin,ZHANG Shu-ya,et al.Classification and identification of shark fin[J].The Food Industry,2011,6:96-99.(in Chinese)
[8]郭云霞,包建强,张舒亚,等.食品中鲨鱼源性成分真实性PCR鉴别研究[J].食品工业科技,2011,32(10):421-42.GUO Yun-xia,BAO Jian-qiang,ZHANG Shu-ya,et al.Authentication of shark derived material in food using PCR[J].Science and Technology of Food Industry,2011,32(10):421-42.(in Chinese)
[9]赵文静,李 妍,高鹏飞,等.实时荧光定量PCR技术在乳酸菌定量检测中的应用[J].食品与生物技术学报,2009,28(4):289-294.ZHAO Wen-jing,LI Yan,GAO Peng-fei,et al.Application of real-time fluorescent quantitative PCR in quantitative detection of laatic acid bateria[J].Journal of Food Science and Biotechnology,2009,28(4):289-294.(in Chinese)
[10]刘光明,苏文金,梁基选,等.多重PCR方法检测食品中转基因成分[J].食品与生物技术学报,2002,21(4):379-383.LIU Guang-ming,SU Wen-jin,LIANG Ji-xuan,et al.Multiplex PCR for detecting transgenic component in foods[J].Journal of Food Science and Biotechnology,2002,21(4):379-383.(in Chinese)
[11]I Martín,T García,V Fajardo,et al.Technical note:detection of chicken,turkey,duck,and goose tissues in feedstuffs using species-specific polymerase chain reaction[J].Journal of Food Science,2007,85(2):452-458.
[12]Miguel A Rodríguez,Teresa García,Isabel González,et al.Identification of goose,mule duck,chicken,turkey,and swine in foie gras by species-specific polymerase chain reaction[J].J Agric Food Chem,2003,51(6):1524-1529.
[13]Zulal Kesmen,Ahmet E.Yetiman,Fikrettin Sahin,et al.Detection of chicken and turkey meat in meat mixtures by using realtime PCR assays[J].Journal of Food Science,2012,77(2):167-173.
