百草枯半抗原分子设计合成及表征
2013-02-19张银志杨婷婷尤继明李红梅孙秀兰
管 露, 张银志*, 杨婷婷, 尤继明, 李红梅, 孙秀兰
(1.食品科学与技术国家重点实验室 江南大学,江苏 无锡 214122;2.江苏苏微微生物研究有限公司,江苏 无锡214068;3.国家有机食品质量监督检验中心,江苏 宝应 225800)
百草枯(paraquat,PQ)又名克无踪、对草快,化学名为1,1'-二甲基-4,4'-联吡啶阳离子盐,它是一种广谱、灭生性有机杂环类除草剂,主要防治玉米、大豆、蔬菜、水稻、果园等地的杂草,也用作谷类、棉花、甘蔗等收割前的脱叶剂,它对植物绿色组织具有较强的破坏作用[1]。百草枯可经胃肠道、皮肤和呼吸道吸收。有研究显示,使用百草枯除草的农民长期吸入小剂量百草枯易导致肺纤维化[2]。由于百草枯的广泛应用,有可能会存在于粮油作物和一些食品原料中,即使在非致害水平下,也会对人体健康产生潜在危害。
农药免疫分析法不但具有与常规分析法相当或更高的灵敏度,而且无须使用昂贵仪器设备,方法简便快速,在农药残留的快速筛选和定量检测以及现场和快速检测方面已显示出独特的优点,受到环境监测工作者的重视。酶联免疫吸附测定法检测百草枯残留的研究,国外已有报道[3-8],国内相关报道极少[9-10]。百草枯的分子量仅为257 Da,属于半抗原,只具有反应原性,而无免疫原性。由于百草枯自身没有可供偶联的活性官能团(如氨基、羧基等),因此,必须对百草枯分子结构进行修饰,使其具有活性基团——羧基,然后与大分子载体蛋白质交联,才能刺激动物产生特异性免疫应答。由于百草枯分子结构中,联吡啶环上两氮原子均连有甲基,不易直接连入带有一段碳连的羧基。为此,作者选取百草枯的结构类似物—4,4’-联吡啶,通过控制反应先在其一侧氮原子上加入甲基,然后再在另一氮原子上连入带有一段碳连的羧基,即为百草枯半抗原,从而为百草枯完全抗原的合成奠定了基础。
1 材料与方法
1.1 材料与仪器
1.1.1 实验材料 4,4’-联吡啶、碘甲烷、N,N二甲基甲酰胺(DMF)、浓 HCl、丙酮、体积分数 95%乙醇等均为分析纯,氮气,3A分子筛。
1.1.2 实验仪器 Spectronic 1.70紫外可见光分光光度计,意大利GBC产品;WBG 1-4002型旋转蒸发仪,德国产品;79-1型磁力加热搅拌器,常州市国立试验设备研究所提供;DF-101S型集热式磁力搅拌器,江苏省金坛市正基仪器有限公司制造;SHB-Ⅲ型循环水真空泵,巩义市站街光亚仪器厂制造;DZF-6020型真空干燥箱,巩义市英峪予华仪器厂制造;SX2箱式电阻炉,上海实验仪器厂有限公司制造;Waters Platform ZMD 4000型液相色谱质谱联用仪,美国Waters公司产品;BC-W201型恒温浴锅,上海贝凯生物化工设备有限公司制造;ALPHA1-4型冷冻干燥机。
1.2 实验方法
百草枯的分子结构式如图1,本实验以4,4’-联吡啶和碘甲烷为起始原料[4,9],合成了N-甲基-N′-戊酸基-二吡啶二溴化物(简称PQ-h),用于制备百草枯的人工抗原。其合成路线如图2,反应分3步完成。
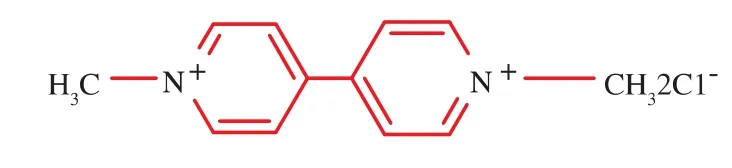
图1 百草枯的分子结构式Fig.1 Molecular structural formula of paraquat
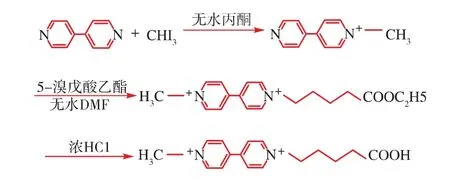
图2 百草枯人工半抗原的合成路线Fig.2 Synthesis route of artificial hapten for paraquat
1.2.1 N-甲基-二吡啶阳离子化合物——Monoquat(MQ)的合成 事先将50 mL的三颈圆底烧瓶通氮气排除其中的空气,称取3 g 4,4’-联吡啶于圆底烧瓶中,加入30 mL无水丙酮溶解后冷却至4℃,在磁力搅拌下慢慢加入1.14 mL碘甲烷(CH3I),于暗处反应。反应混合物完全加入后,低温(4℃左右)搅拌过夜。用无水丙酮洗涤,抽干,得产品MQ,真空干燥,得黄色针状结晶,然后存放于真空干燥器中,取少量进行鉴定。
1.2.2 N-甲基-N′-戊酸乙酯基-二吡啶阳离子化合物的合成 称取1.56 g第一步反应得到的MQ于圆底烧瓶中,加入30 mL新鲜蒸馏的无水二甲基甲酰胺(DMF)溶解,然后加入1.6 mL 5-溴戊酸乙酯在120℃油浴磁力搅拌下反应,回流5 h,然后室温放置过夜。抽滤,用无水DMF洗涤,真空干燥,得黄色片状结晶,存放于真空干燥器中,取少量进行鉴定。
1.2.3 N-甲基-N′-戊酸基-二吡啶阳离子化合物(PQ-h)的合成 称取0.3 g第二步得到的N-甲基-N′-戊酸乙酯基-二吡啶阳离子化合物与23 mL浓HCl混合,水浴加热回流3 h左右。在旋转蒸发器上蒸去过量的酸和水,保持水浴温度不超过60℃,蒸干,得固体残留物。冷却后,加入少量丙酮结晶(析出白色晶体),过滤,抽干,真空干燥,得粗品,再经体积分数95%乙醇重结晶,真空干燥,存放于真空干燥器中,取少量进行鉴定。
2 结果与分析
取上述每一步合成的百草枯衍生物进行LCMS鉴定和1HNMR鉴定,并将百草枯半抗原进行IR鉴定,结果见图3—9。
2.1 N-甲基-二吡啶阳离子化合物——Monoquat(MQ)的 LC-MS、1HNMR 鉴定
由图3知,第一步反应合成的产物纯度较高,达95%以上,说明反应比较彻底,基本无副产物生成。经计算产物得率约为86%。由质谱图可看出产物的相对分子质量为171,这与目标产物——N-甲基-二吡啶阳离子化合物(MQ)的相对分子质量一致。

图3 N-甲基-二吡啶阳离子化合物(MQ)的LC图谱和MS图谱Fig.3 LC spectrum (A)and MS spectrum (B)of N-methyl-4-(pyridine-4-pyridyl)pyridinium(MQ)
由图 4可知,该物质的1HNMR (500 MHz,D2O):δ为 8.92(d,2H,ArH),8.76(d,2H,ArH),8.39(d,2H,ArH),7.9 (d,2H,ArH),4.5 (s,3H,CH3),所得结构信息与目标物——N-甲基-二吡啶阳离子化合物(MQ)的结构信息相同,从而推断其为目标产物[9]。
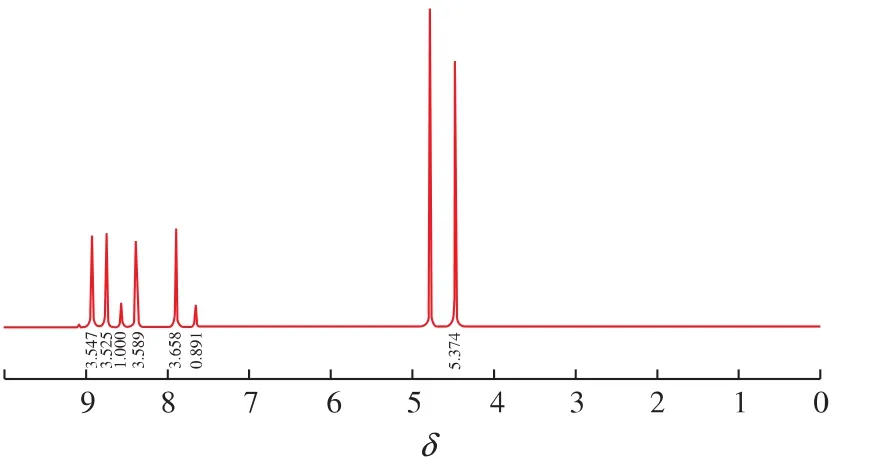
图4 N-甲基-二吡啶阳离子化合物(MQ)的1HNMR图谱Fig.4 1HNMR spectrum of N-methyl-4-(pyridine-4-pyridyl)pyridinium(MQ)
2.2 N-甲基-N′-戊酸乙酯基-二吡啶阳离子化合物的LC-MS、1HNMR鉴定
图5的LC图出现两个峰,N-甲基-N′-戊酸乙酯基-二吡啶阳离子化合物在液相色谱上的保留时间为1.62 min,其余为杂质峰,通过积分计算其纯度为70%。由质谱图可以看出,300.5为N-甲基-N′-戊酸乙酯基-二吡啶阳离子化合物的阳离子峰,计算得其相对分子质量为300,与实际相对分子质量相符。
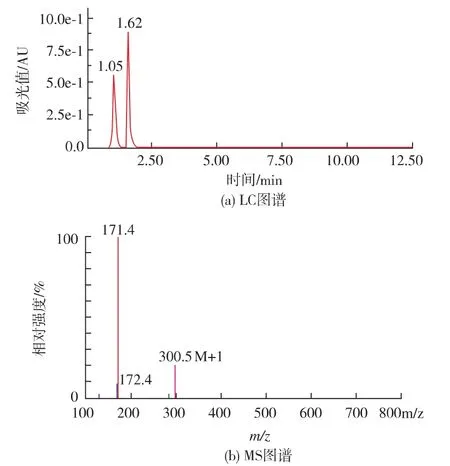
图5 N-甲基-N′-戊酸乙酯基-二吡啶阳离子化合物的LC图谱和MS图谱Fig.5 LC spectrum (A)and MS spectrum (B)of N-(5-ethoxy-5-oxopentyl)-N'-methylbipyridilium
由图 6可知,该物质的1HNMR (500 MHz,D2O):δ(ppm)9.18 (d,2H,ArH),9.11 (d,2H,ArH),8.61(d,2H,ArH),8.58(d,2H,ArH),4.56(s,3H,NCH3),2.54 (t,2H,CH2),2.18 (t,2H,CH2),1.76(m,2H,CH2),1.29 (t,3H,CH3), 所得结构信息与目标物——N-甲基-N′-戊酸乙酯基-二吡啶阳离子化合物的结构信息相同,从而推断其为目标产物[9]。
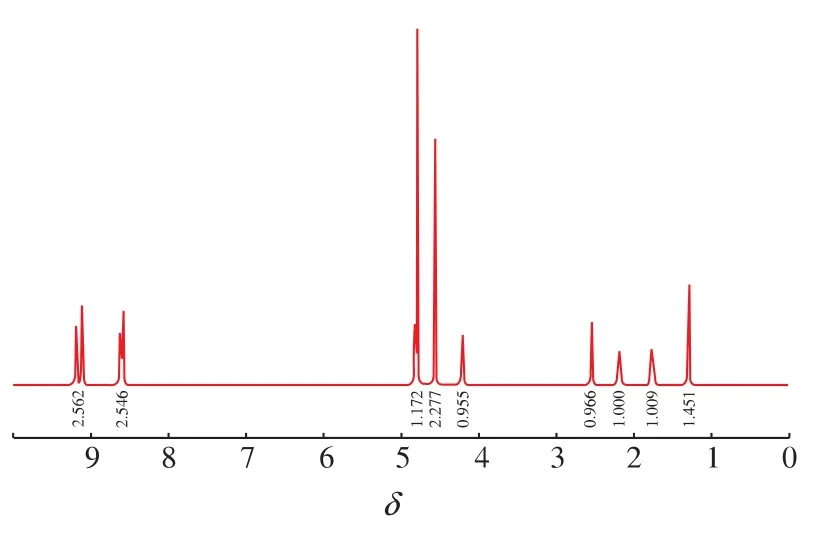
图6 N-甲基-N′-戊酸乙酯基-二吡啶阳离子化合物的1HNMR图谱Fig.6 1HNMR spectrum of N-(5-ethoxy-5-oxopentyl)-N'-methylbipyridilium
2.3 N-甲基-N′-戊酸基-二吡啶阳离子化合物(PQ-h)的 LC-MS、1HNMR 鉴定
由图7可知,酸水解后的产物相对较纯,纯度达96%。由质谱图可看出272.5为PQ-h的阳离子峰,计算得其相对分子质量为272,与实际的相对分子质量相符,经计算得率为69%。

图7 N-甲基-N′-戊酸基-二吡啶阳离子化合物(PQ-h)的LC图谱和MS图谱Fig.7 LC spectrum (A)and MS spectrum (B)of N-(5-ethoxy-5-oxopentyl)-N'-methylbipyridilium(PQ-h)
由图 8可知, 该物质的1HNMR (500 MHz,D2O):δ为 9.18(d,2H,ArH),9.11(d,2H,ArH),8.61(d,2H,ArH),8.57 (d,2H,ArH),4.81 (t,2H,CH2),4.56 (s,3H,CH3),2.54 (t,2H,CH2),2.19 (m,2H,CH2),1.75 (m,2H,CH2), 羧基上的活泼氢被溶剂DO2中的D替换。该所得结构信息与目标物——N-甲基-N′-戊酸基-二吡啶阳离子化合物(PQ-h)的结构信息相同,从而推断其为目标产物[9]。
2.4 IR鉴定结果及分析
取合成的百草枯半抗原进行IR (KBr压片)鉴定,结果见图9。
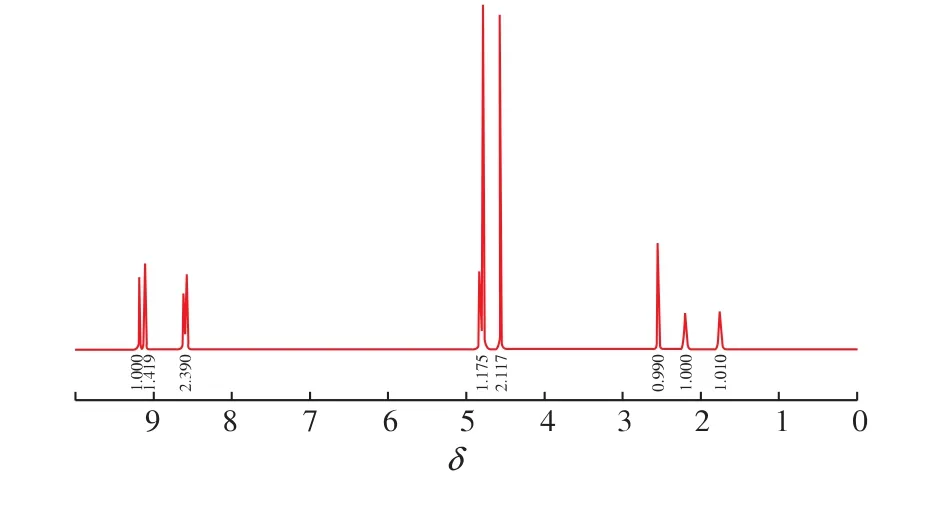
图8 N-甲基-N′-戊酸基-二吡啶阳离子化合物 (PQ-h)的1HNMR图谱Fig.8 1HNMR spectrum of N-(5-ethoxy-5-oxopentyl)-N'-methylbipyridilium(PQ-h)
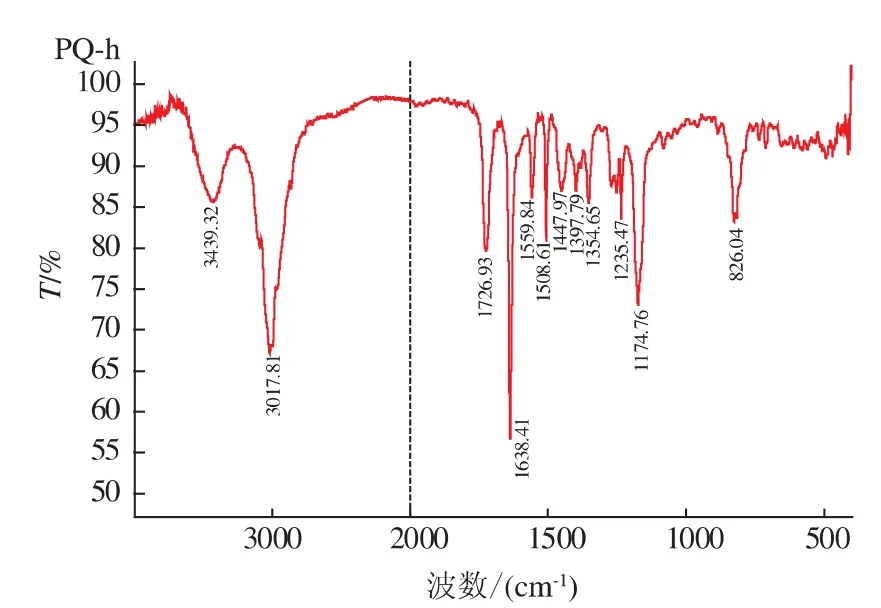
图9 百草枯半抗原的IR图谱Fig.9 IR spectrum of paraquat hapten
由图9知,3 439.32 cm-1对应的宽的峰为羧酸上的O—H伸缩吸收,3 017.81 cm-1对应的为芳环上C—H的伸缩振动,1 726.93 cm-1为C=O的吸收,1 638.41 cm-1为C=N的吸收(即吡啶环结构),1 397.79、1 447.97、1 508.61、1 559.84 cm-1均 为C=C骨架的振动,826.04 cm-1为芳环上C—H面外弯曲振动吸收。通过以上分析,初步确定为目标产物—PQ-h。
3 结语
在农药残留的免疫学分析中,人工抗原的合成是制备抗体和建立免疫分析方法最关键的步骤,而半抗原的设计又是合成人工抗原的前提。半抗原的设计要求应尽量使合成的半抗原能刺激机体产生特异性免疫应答,并且产生的抗体应具有预期的活性[11]。因此,应尽量保证半抗原分子具有与待测物分子类似的立体化学特征。一般将半抗原设计成包含一个间隔臂和偶联基团,并仍具有原农药分子基本结构的分子。通常认为连接臂的最适长度在3~6个碳原子,连接臂太短不利于半抗原的充分暴露,而连接臂太长又会因疏水作用而造成烷基链的折叠,导致半抗原分子仍然被载体蛋白质所掩盖,不利于抗原递呈细胞(APC)的识别[12]。
在本研究中,采用百草枯的结构类似物—4,4’-联吡啶通氮气保护下经3步化学反应合成了目标产物,并用ESI、1HNMR、IR对其结构进行了鉴定。经分析证明,合成的百草枯中间体纯度较高,可以将其与载体蛋白质偶联制备百草枯人工抗原。
[1]曾铭.共振光散射光谱法机理研究及其在农药分析中的应用[D].成都:四川师范大学,2006:29.
[2]夏敏,刘建华.百草枯中毒研究现状[J].四川医学,1995,16(4):237-239.XIA Min,LIU Jian-hua.Research status quo of paraquat poisoning[J].Sichuan Medical Journal,1995,16 (4):237-239.(in Chinese)
[3]Niewola Z,Walsh S T,Davies G E.Enzyme linked immunosorbent assay (ELISA) for paraquat[J].International Journal of Immunopharmacology,1983,5(3):211-218.
[4]Jeanette Van Emon,Bruce Hammock,James N Seiber.Enzyme-Linked immunosorbent assay for paraquat and its application to exposure analysis[J].Anal Chem,1986,58:1866-1873.
[5]Coxon R E,Rae C,Gallacher G,et al.Development of a simple,fluoroimmunoassay for paraquat[J].Clin Chim Acta,1988,175(3):297-305.
[6]Michele Y Selisker,David P Herzog,Roger D Erber,et al.Determination of paraquat in fruits and vegetables by a magnetic particle based enzyme-linked immunosorbent assay[J].J Agric Food Chem,1995,43:544-547.
[7]Koivunen M E,Gee S J,Park E K,et al.Application of an Enzyme-Linked immunosorbent assay for the analysis of paraquat in Human-Exposure samples[J].Arch Environ Contam Toxicol,2005,48:184-190.
[8]Caroline A Spinks,Wang Bo,Clare Mills E N,et al.Development of an ELISA for paraquat;improvement of antibody characteristics by reversed affinity chromatography[J].Analyst,1999,124:847-850.
[9]马兆扬,黄金祥.半抗原:N-甲基-N′-戊酸基-二吡啶-二溴化物的合成[J].卫生研究,2004,33(2):220-221.MA Zhao-yang,HUANG Jin-xiang.The synthesis of the hapten:N-(5-ethoxy-5-oxopentyl)-N'-methylbipyridilium[J].Journal of Hygiene Research,2004,33(2):220-221.(in Chinese)
[10]Takatori T,Nagao M,Wu B等.单克隆抗体与百草枯反应的特性与进展[J].中国法医学杂志,1988,3(3):171 Takatori T,Nagao M,Wu B,et al.The characteristics and progress of the reaction to monoclonal antibody and paraquat[J].Chinese Journal of Forensic Medicine,1988,3(3):171.(in Chinese)
[11]朱国念,吴刚,吴慧明.有机磷杀虫剂毒死蜱人工抗原的合成与鉴定[J].中国农业科学,2003,36(6):657-662.ZHU Guo-nian,WU Gang,WU Hui-ming.Synthesis and identification of the antigens for the organophosphorus insecticide chlorpyrifos[J].Scientia Agricultura Sinca,2003,36(6):657-662.(in Chinese)
[12]Jung F,Gee S J,Harrison R O,et al.Use of immunochemical techniques for the analysis of pesticides[J].Pestic Sci,1989,26:303-317.
