适应性进化策略强化厌氧产氢菌群的发酵效能
2013-02-19黄振兴余晓斌廖家林阮文权
黄振兴 , 余晓斌 , 廖家林 , 阮文权
(1.江南大学 环境与土木工程学院,江苏 无锡 214122;2.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;3.江南大学 生物工程学院,江苏 无锡 214122)
厌氧发酵细菌由于缺乏完整的电子传递体系,代谢过程中底物脱氢产生的电子需要有适当的途径进行宣泄,以维持胞内的氧化还原平衡,从而保证代谢过程的顺利进行。通过氢化酶的作用,以铁氧还蛋白作为电子载体,催化质子接受电子产生分子氢,可以作为宣泄电子和维持胞内氧化还原平衡的一种调节机制[1]。厌氧混合菌群中同时存在着产甲烷菌等耗氢微生物,因此目前大多数研究采用热处理等方式以杀死混合菌群中的耗氢微生物,同时保留以芽孢形式存在的梭菌属产氢发酵细菌[2]。梭菌属产氢发酵细菌有着较高的氢气产率,氢分子形成不仅可以基于丙酮酸脱羧作用 (pyruvateferredoxin oxidoreductase PFOR),而且可以来自于NADH的氧化 (NADH-ferredoxin oxidoreductase,NFOR)[3]。研究表明,在梭菌产氢代谢过程中,氢气的产率取决于丁酸和乙酸的生成水平,而醇类和乳酸的积累会导致较低的氢产率。然而,丁酸的积累会反馈抑制产氢产酸过程,某些梭菌由于缺乏足够的耐受能力,就会停止代谢或者转换代谢途径生成醇类或者乳酸[4]。但是不同梭菌的生理生化行为存在差异,其各自的耐受阈值和响应机制不尽相同[5]。因此厌氧菌群的微生物多样性和基因型的不确定性会形成其内在的异质性,在产氢过程中就会形成“短板效应”,从而限制了菌群整体的发酵能力。因此如能消除混合菌群中对丁酸敏感以及富集具有较好丁酸耐受能力的产氢梭菌,消除“短板效应”,提高菌群整体水平的丁酸耐受力和持续生产力,定能强化混合菌群的发酵制氢能力。
本课题研究中以外源丁酸胁迫结合竞争性途径抑制剂作为复合选择性压力,在连续流中对产氢发酵菌群进行适应性进化,在提高菌群整体耐酸水平的同时,弱化产氢竞争途径,强化菌群整体水平的产氢能力,并在关键酶学水平对进化机制进行阐释。
1 材料与方法
1.1 接种物来源及培养基成分
混合菌群取自于苏州洁净公司厌氧消化系统中的厌氧污泥。污泥的TS为13.24%,VS为86.46%。将厌氧污泥在100℃下干热灭菌1 h,这样可以完全杀死污泥里的产甲烷菌和其它细菌的营养细胞,并能保留芽孢形式的产氢梭菌。经过热处理的厌氧污泥即为本实验的接种物。培养基中,葡萄糖为唯一碳源,NH4Cl为唯一氮源,添加KH2PO4和 FeCl2·4H2O, 使 m (Glucose)∶m (NH4Cl) ∶m(KH2PO4)∶m(FeCl2·4H2O)=100∶5∶1∶0.3,其它微量营养成分质量浓度(mg/L):MgSO4·7H2O 200;NaCl 20;CaCl2·2H2O 10;L-cysteine 10;Na2MoO4·4H2O 0.5;MnSO4·7H2O 0.5;H3BO30.5;ZnCl20.5;CuCl20.5;CoCl2·2H2O 0.5;Biotin 0.05;Riboflavin 0.05;Nicotinic acid 0.05。
1.2 连续流中厌氧产氢菌群的适应性进化
将经过热处理的厌氧污泥接种至含有4 L培养基的厌氧发酵罐(7 L容量)。通入N25 min后,反应器首先在分批模式下启动,初始接种量和葡萄糖含量分别为4.0 g/L和5.0 g/L。定时检测产氢情况,当氢气顺利生成后启动连续流。反应器搅拌速度为150 r/min,温度控制在35℃。pH采用6 mol/L KOH控制在5.6。水力停留时间(HRT)最终维持在8 h(Phase I)。在稳定运行的反应器中引入外源丁酸胁迫作为选择性压力,并在反应器达到稳态的基础上逐步增加质量浓度,最终胁迫质量浓度为25 g/L(Phase II)。然后逐步提高进水葡萄糖质量浓度直到底物除去率低于80%(Phase III)。最后在进化体系中引入4-甲基吡唑(醇脱氢酶抑制剂)以及草氨酸盐(乳酸脱氢酶抑制剂),形成复合胁迫压力。
1.3 污泥细胞提取物、透性化细胞及总DNA制备
收集60 mL污泥混合液洗涤、离心,然后悬浮于3 mL含有10 mmol/L二硫苏糖醇 (DTT)的0.1 mol/L Tris/MES(pH 7.2)缓冲液。将污泥悬浮液置Tissuelyzer II破碎仪破细胞,然后4℃下40 000 g离心30 min以去除细胞碎片和污泥杂质,上清液即为污泥细胞提取物。污泥透性化细胞制备按照O’sullivan和Condon提出的方法并做少许修改[6]。污泥悬浮液加入体积分数10%甲苯,并在液氮中冻融两次。污泥总DNA的提取采用Mobio公司的PowerSoil DNA isolation kit试剂盒,并按照说明书操作。
1.4 氢化 酶 (hydrogenase)、NFOR、 膜 ATPase(membrane ATPase)活性测定
Membrane ATPase活性测定反应体系 (1 mL):50 mmol/L Tris-maleate,10 mmol/L MgSO4,0.2 mol/L ATP,100 μL透性细胞悬浮液。酶活定义为每分钟释放1 μmol磷酸根离子所需要的酶量。
NADH-ferredoxin oxidoreductase(NFOR)活性测定反应体系(1 mL):50 mmol/L Tris-MES;2 mmol/L DTT;7 mmol/LMNADH;4 mmol/L acetyl-CoA; 2 mmol/L 2,3,5-氯化三苯基四氮唑(TTC);101 325 Pa CO; 10 μmol/L FAD; 200 μL 细胞提取物。酶活定义为每分钟生成1 μmol TF所需要的酶量。
Ferredoxin-NAD+oxidoreductase(FNOR)活性测定反应体系(1 mL):50 mmol/L Tris-MES, 2 mmol/L甲基紫晶,60 mmol/L亚硫酸钠,5 mmol/L NAD+,101 325 Pa CO, 10 mmol/L DTT, 200 μL cell extract。酶活定义为每分钟释放1 μmol NADH所需要的酶量。
Hydrogenase活性测定反应体系 (1 mL):50 mmol/L Tris-MES,2 mmol/L甲基紫精,60 mmol/L亚硫酸氢钠,100 μL细胞提取物。酶活定义为每分钟释放1 μmol氢气所需要的酶量。
1.5 PCR-DGGE表征进化过程中微生物群落的动态变化
采用细菌通用引物F341与R534对污泥总DNA进行扩增,其中引物F341的5’端带有GC夹[7];PCR反应采用25 μL的反应体系,扩增条件为:94℃预变性 4 min,94℃变性 1 min,65℃退火 1 min,之后每个循环降低0.5℃,72℃延伸1 min,20个循环,然后再以94℃变性1 min,55℃退火1 min,72℃延伸1 min,进行10个循环,最后72℃终延伸6 min。PCR产物用质量分数1%的琼脂糖凝胶电泳进行检测。采用突变凝胶电泳(DGGE)对扩增产物进行分离,用SYBR Green I染色后拍照观察。将DGGE指纹图谱与发酵参数结合分析群落进化过程。
1.6 分析方法
污泥生物量以挥发性悬浮物(VSS)计,按照国标法测定;葡萄糖含量利用生物传感器测定;气相产物采用气相色谱仪测定;液相产物采用液相色谱仪测定;TF采用分光光度计测定;NADH含量采用酶法进行测定[8];磷酸根离子含量采用多参数水质分析仪测定,发酵液总碳含量用TOC测定仪测定。
2 结果与讨论
2.1 在连续流中,以丁酸作为选择性压力对厌氧污泥进行适应性进化
如图1所示,和已有研究结果一致,厌氧菌群在低负荷(Phase I)运行条件下,液相产物主要为丁酸和乙酸,两者碳含量占液相产物总碳的90%以上。DGGE图谱分析表明,此时的微生物多样性显著。在此基础上逐渐引入外源丁酸胁迫,胁迫终质量浓度为25 g/L(Phase II)。在此稳态基础上的DGGE分析表明微生物多样性显著降低,说明一些酸敏感微生物由于缺乏足够的酸耐受能力,其生长受到抑制,在连续流中被淘汰出反应器或者丧失了其生长优势。但是代谢产物分析表明,丁酸胁迫在低负荷下并没有诱导醇类等竞争性产物生成,反应器中的代谢产物主要还是丁酸和乙酸。这可能是因为梭菌产醇或者产乳酸途径的引发需要足够ATP库或者较高的底物浓度[4]。因此,在外源丁酸胁迫的基础上,逐渐提高培养基中的葡萄糖质量浓度,直到底物降解率下降到80%以下,其目的在于充分激发某些梭菌以产醇途径的转化来应对丁酸胁迫的可能性(Phase III)。在此条件下反应器达到稳态后,发现有大量的丁醇、乙醇和乳酸生成,这说明某些梭菌在低负荷下可以依赖自身一定的耐酸机制来抵御酸胁迫,但是高负荷下其又通过产醇和产乳酸途径的转换来响应。这种现象会造成高负荷下产氢过程的短板效应,从而限制了厌氧菌群的产氢能力。同时DGGE结果表明,当有机负荷提高以后,微生物的多样性有所增加。这可能是由于在丁酸胁迫压力和低负荷条件下,某些梭菌由于缺乏足够的耐酸能力,其生长能力在厌氧菌群中处于劣势但是并没有完全淘汰出反应器,当有机负荷提高后,其又可通过产醇或者产乳酸来抵御丁酸胁迫并恢复其生长优势,从而展现在DGGE图谱中。为了消除以上存在的不利现象,在进化过程中继续引入(醇脱氢酶抑制剂)以及草氨酸盐(乳酸脱氢酶抑制剂)来抑制产醇和产乳酸途径,两种抑制剂的最终浓度为12 mmol/L和20 mmol/L。当反应器达到稳态后(Phase IV),分析发现,乙醇、丁醇以及乳酸生成受到明显抑制,乙酸和丁酸再次成为主要的代谢产物。此阶段的DGGE指纹分析表明,微生物的多样性大幅降低,只存在3种较为明显的条带。这是因为在高负荷下那些依赖代谢途径转化来抵御丁酸胁迫的梭菌,由于其响应策略受到化学抑制剂的阻碍而无法进行,这时其胞内的pH动态平衡或者氧化还原平衡将被打破,其生长能力受到严重抑制,从而在连续流中被淘汰出反应器。通过以上的适应性进化过程,具有较强丁酸胁迫耐受力,且是不依赖于代谢途径转换的产氢菌可以在反应器中得到富集。
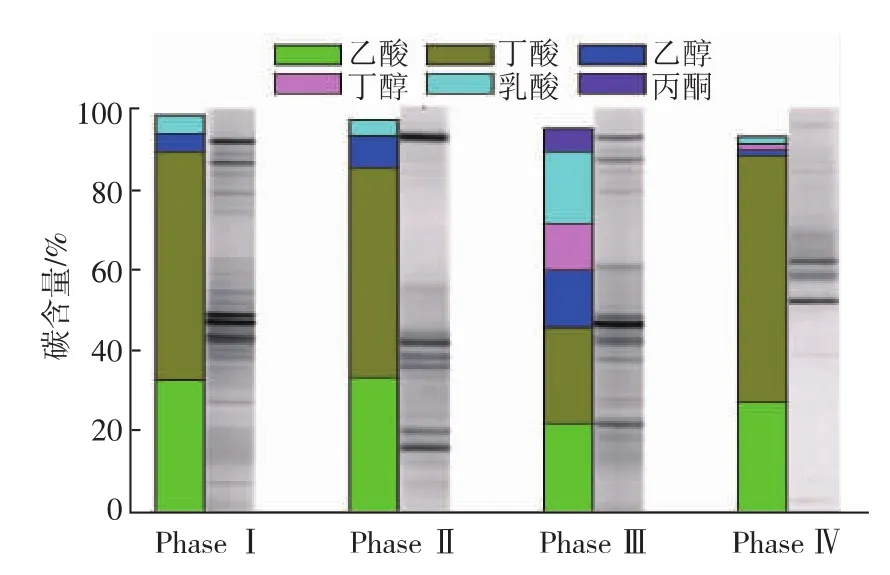
图1 适应性进化过程中代谢产物的碳分布以及微生物群落的演替Fig.1 Carbon distribution and bacterial community succession during the adaptive evolution
2.2 适应性进化策略对厌氧产氢的强化作用
为了验证适应性进化策略对产氢发酵的作用,本课题研究中分别对原污泥和进化污泥在高浓度有机物条件下的产氢潜力进行研究。两种污泥的发酵产物含量变化如图2所示。随着时间变化,产物含量越来越高,32 h之后葡萄糖含量都在200 mg/L以下,降解率都接近于100%。碳平衡都达到98%以上,说明没有重要的产物测定遗漏。由图2(b)可见,在原污泥的发酵过程中,4 h的时候开始出现醇类产物,此时有机酸含量为0.88 g/L(12.6 mmol/L)。发酵结束时,总的醇类产量为6.49 g/L,主要包括乙醇(3.05 g/L),丁醇(2.48 g/L)和丙酮(0.96 g/L),没有乳酸的生成;同时总酸的产量为7.07 g/L,包括丁酸(50.0 mmol/L)和乙酸(44.5 mmol/L)。 由于醇类积累,氢气产率和产生速率分别仅1.43 mol-H2/mol-Glucose 和 0.168 L/(L·h)。 相比较的是在进化污泥的发酵过程(图2(a))中,氢气产率和生成速率增加了56.5%,分别达到了2.25 mol-H2/mol-Glucose和0.263 L/(L·h),乙酸/丁酸增加到了 1.33,丁酸和乙酸产量分别达83.3 mmol/L和111.2 mmol/L。此外,进化污泥的发酵过程中出现了少量琥珀酸,意味着在厌氧菌群的进化过程中可能有新的代谢途径得到了诱导。最近研究表明,一些厌氧菌特别是一些梭菌属的微生物具有分支的TCA循环。这样的TCA循环一方面可以提供谷氨酸等氨基酸合成的前体物质,充足的氨基酸库有助于一些氨基酸依赖型耐酸系统的运行[9];另一方面依赖分支TCA循环,琥珀酸可以在一些胁迫环境下正向或者反向合成,这对细胞保持NAD+/NADH平衡起到一定的作用[10]。因此在进化污泥的发酵过程中琥珀酸的形成,一方面可能是因为进化污泥中氨基酸依赖型耐酸系统的诱导而形成,另一方面也可能是由于耐丁酸微生物为了保持自身的NAD+/NADH平衡而形成的一种辅助调节机制。
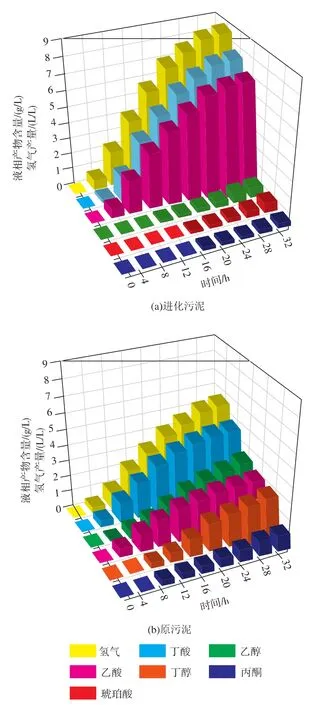
图2 进化污泥和原污泥的发酵性能比较Fig.2 Comparison of fermentation performances between evolved cultures and original cultures at a high initial glucose concentration of 30 g/L
2.3 进化机制在酶学水平的解析
以上结果表明,进化污泥和原污泥在高有机负荷下的代谢表现存在明显差异。为了阐释其内在差异,作者对产氢和耐酸性相关酶学水平的表现进行了研究,以解析其进化机制。将原污泥与进化污泥分别接种至发酵罐中,反应条件参照2.2节。在发酵产氢过程的指数期取样测定。结果发现,两种产氢菌群在酶学水平上存在着显著差异。如图3所示,在进化污泥中,氢化酶、Membrane ATPase以及NFOR的比酶活分别为260 U/g,200 U/g及36 U/g,而原始污泥中其比酶活仅分别为128 U/g,126 U/g以及29 U/g。Membrane ATPase是微生物主要的耐酸机制之一,其高活性说明进化污泥有着较好的耐酸潜力以保证其在高负荷下丁酸和乙酸的持续生成。此外,丁酸和乙酸的生成过程中,其产生的电子需要及时得到宣泄,而进化污泥产醇和产乳酸途径的削弱,电子则主要依赖释氢作用宣泄,因此氢化酶和NFOR的高活性可以保证负荷提升之后的高产氢效率。原污泥中的某些梭菌由于相对低的耐酸能力和释氢活性,其不仅造成了菌群整体水平的活性降低,而且当负荷提高之后,耐受机制无法应对发酵过程中产生的酸胁迫,就会通过代谢途径转化来维持代谢活性,从而在产氢过程中导致短板效应,氢气产率大大降低。但是在进化污泥和原始污泥中都存在着相当的FNOR活性。
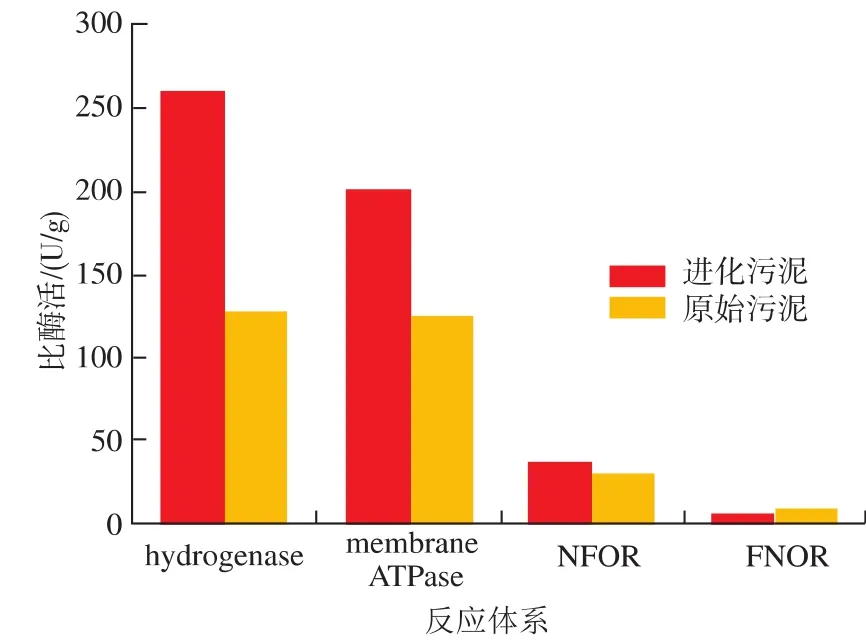
图3 产氢和耐酸性相关酶活水平的比较Fig.3 Comparison of enzymatic activity involved in H2 and acid tolerance
FNOR是产醇途径中代表性的一种酶,其与NFOR分别催化电子在铁氧还蛋白和NAD+之间的相互传递,如公式 (1)所示。但是基于NFOR的NADH氧化产氢热力学上是不可行的,其已被证实可以被丁酸合成途径中巴豆酰辅酶A的还原放能反应所驱动,在梭菌中此耦合反应由丁酰辅酶A脱氢酶复合物(ETF/BCD)所介导,如公式(2)所示[11-12]。因此NFOR与FNOR很有可能是一种铁氧还蛋白氧化还原酶催化的正逆反应,只是其反应过程并不一致。NFOR需要ETF/BCD介导的放能反应驱动,其测定过程必须要加入乙酰辅酶A或者巴豆酰辅酶A,所以此方向的活性很大程度上取决于丁酸合成途径的活性。而在FNOR反应方向下不需要任何其它反应参与,所以比酶活取决于细胞提取物中酶本身的含量和催化活性。以上分析说明,此酶的反应方向或活性取决于丁酸合成活性,反过来说丁酸积累不仅会导致酸胁迫效应,而且会反馈抑制基于NFOR的NADH氧化,从而造成NAD+再生压力。这也很好地解释了为什么是丁酸而不是乙酸、乳酸等其它有机酸能够激活产醇等竞争性途径。

3 结语
1)在连续流中,通过适应性进化手段,消除了厌氧菌群中对丁酸敏感以及依赖代谢途径转换来抵御丁酸胁迫的产氢梭菌,有效抑制了产氢菌群整体水平上的代谢异质性,从而显著弱化了产氢菌群在发酵过程中的短板效应。
2)相较于原始污泥,进化污泥在利用高浓度底物产氢过程中竞争性途径活性大大减弱,而丁酸和乙酸的持续生成力更强,从而获得了较高的氢气产率。
3)耐酸机制和产氢作用相关酶活分析表明,较于原始污泥,进化污泥的Membrane ATPase、氢化酶以及NFOR活性更强,其保证了在高负荷下厌氧菌群氢气、乙酸以及丁酸的持续生产力。
[1]Valdez-Vazquez I,Poggi-Varaldo H M.Hydrogen production by fermentative consortia[J].Renew Sust Energ Rev,2009,13:1000-1013.
[2]Das D.Advances in biohydrogen production processes:an approach towards commercialization[J].Int J Hydrogen Energy,2009,34:7349-7357.
[3]Sinha P,Pandey A.An evaluative report and challenges for fermentative biohydrogen production[J].Int J Hydrogen Energy,2011,36:7460-7478.
[4]Van Ginkel S,Logan B E.Inhibition of biohydrogen production by undissociated acetic and butyric acids[J].Environ Sci Technol,2005,39:9351-9356.
[5]Lidstrom M E,Konopka M C.The role of physiological heterogeneity in microbial population behavior[J].Nat Chem Biol,2010(6):705-712.
[6]O’sullivan E,Condon S.Relationship between acid tolerance,cytoplasmic pH,and ATP and Ht-ATPase levels in chemostat cultures of Lactococcus lactis[J].Appl Environ Microb,1999,65(6):2287-2293.
[7]Huang Y,Zong W M,Yan X,et al.Succession of the bacterial community and dynamics of hydrogen producers in a hydrogenproducing bioreactor[J].Applied and Environmental Microbiology,2010,76(10):3387-3390.
[8]李骆冰,王永红,庄英萍,等.乙醇发酵中酿酒酵母辅酶NAD+及NADH测定方法[J].食品与生物技术学报,2011,30(2):287-293.LI Luo-bing,WANG Yong-hong,ZHUANG Ying-ping,et al.Determination of coenzyme NAD+and NADH of Saccharomyces cerevisiae cells in ethanol production[J].Journal of Food Science and Biotechnology,2011,30(2):287-293.(in Chinese)
[9]孟影,张光生,王爱杰,等.生物产氢过程中厌氧污泥耐酸响应的生物化学机制[J].食品与生物技术学报,2012,31(3):301-311.MENT Ying,ZHANG Guang-sheng,WANG Ai-jie,et al.Acid tolerance response of anaerobic sludge with butyrie acid stress during the enhanced biohydrogen process[J].Journal of Food Science and Biotechnology,2012,31(3):301-311.(in Chinese)
[10]Crown S B,Indurthi D C,Ahn W S,et al.Resolving the TCA cycle and pentose-phosphate pathway of Clostridium acetobutylicum ATCC 824:Isotopomer analysis,in vitro activities and expression analysis[J].Biotechnol J,2011(6):300-305.
[11]Li F L,Hinderberger J L,Seedorf H N,et al.Coupled ferredoxin and crotonyl coenzyme A(CoA) reduction with NADH catalyzed by the Butyryl-CoA Dehydrogenase/Etf complex from Clostridium kluyveri[J].Journal of Bacteriology,2008,190(3):843-850.
[12]Seedorf H N,Ricke W F,Veith B,et al.The genome of Clostridium kluyveri,a strict anaerobe with unique metabolic features[J].Proc Natl Acad Sci,2008,105(6):2128-2133.
