酶联免疫法检测食品中乳酸链球菌素
2013-02-19赵贵明王振宝
孟 茹, 赵贵明, 贾 瑜, 王振宝
(1.伊犁出入境检验检疫局,新疆 伊宁 835000;2.中国检验检疫科学研究院,北京 100013;3.北京勤邦生物技术有限公司,北京 102206)
乳酸链球菌素[1](英文名Nisin,以下简称Nisin)又称乳链菌肽,是一种高分子多肽,分子式为C143H228N42O37S7。它是从乳酸乳球菌或乳酸链球菌发酵产物中提制的一种多肽抗菌素类物质,被认为是一种高效、天然生物性食品防腐剂和抗菌剂,能有效杀死或抑制引起食品腐败变质的革兰氏阳性菌,特别是细菌孢子,如葡萄球菌、链球菌、乳杆菌、小球菌、明串珠菌、芽孢杆菌等。到目前为止,全世界约有50多个国家和地区广泛使用Nisin[2],我国于1990年开始批准使用Nisin,并在 《GB 2760-2010食品添加剂使用卫生标准》中规定Nisin作为食品防腐剂的最大允许使用量。
Nisin定量分析的最初测定方法为甲基蓝还原法[3],后来相继开发了用于Nisin定量的生物分析方法,包括试管稀释法、浊度分析法[4]、琼脂扩散法[5-7]、ATP生物发光测定法[8-9]、绿光荧光蛋白测定法和微量滴定法等。国外于1990年开始报道Nisin的酶联免疫分析法,Falahee[10]发展了多克隆抗血清分析乳酸链球菌素的酶联免疫分析法,该方法对奶酪中Nisin的最低检测质量浓度为200 ug/mL。Suacrez[11]设计的多克隆抗体酶联免疫吸附法在牛奶和乳清中的最低检测质量浓度为170 ug/mL。作者从制备Nisin多克隆抗体、优化反应模式出发,建立了乳制品及肉制品中Nisin间接竞争性ELISA定量检测方法并制备了相应的试剂盒,扩大了检测对象范围,具备稳定性好,检测限低的特点,并填补了国内乳酸链球菌素酶联免疫检测试剂盒的空白。
1 材料与方法
1.1 材料
1.1.1 实验动物 新西兰大白兔,购自兴隆实验动物养殖厂。
1.1.2 试剂 Nisin标准品,牛血清白蛋白(BSA),卵清蛋白(OVA),美国Sigma公司产品;羊抗兔酶标记二抗,北京金桥凯泰生物技术有限公司产品;TMB底物显色液,弗氏完全佐剂(羊毛脂、液体石蜡,自配),弗氏不完全佐剂(羊毛脂、液体石蜡和卡介苗,自配),其他常规化学试剂,国药集团化学试剂北京有限公司产品。
1.1.3 设备 MK3型酶标仪,芬兰雷伯公司产品;微量移液器,Eppendorf公司产品;BF400型恒温培养箱,德国宾得公司产品;MK3型漩涡混合器,德国IKA公司产品;MS1602S型电子天平,梅特勒·托利多公司产品。
1.2 方法
1.2.1 免疫原的制备 采用碳二亚胺法[12]将Nisin标准品分别与BSA和OVA偶联制备偶联物,分别作为免疫原和包被原。
1.2.2 多克隆抗体的制备
1)动物免疫
由于Nisin的分子量为3 510 Da,而其活性分别以二聚体和四聚体形式出现,其二聚体和四聚体的分子量分别为7 000 Da和14 000 Da[13-14],介于小分子和大分子之间,故用Nisin的标准品以及其与BSA的偶联物分别作为免疫原进行免疫。
取1.0 μg/mL的免疫原溶液用于免疫新西兰大白兔。首次免疫时,将免疫原与等量的弗氏佐剂混匀,每只兔子2.0 mL,颈背部皮下多点注射,每点0.2 mL,第二次免疫时取免疫原与等量的弗氏不完全佐剂混匀,每只兔子2.0 mL,颈背部皮下多点注射,每点0.2 mL。每次注射间隔2周,从第三次免疫开始,每次免疫后一周采血检测抗血清效价,连续加强免疫,直到获得满意的抗体效价为止。最后一次无佐剂用1.0 mg抗原直接腹腔注射。
2)抗血清的采集
将兔子全身麻醉后实施心脏穿刺取血。将采得的血液室温静置2~3 h,4℃过夜后低速离心30 min分离血清,收集上清液,分装,-20℃冻存备用。
3)抗血清的纯化
采用辛酸-硫酸铵法[15-16]纯化制得的多克隆抗体,用紫外-可见分光光度计测定其在280、260 nm的吸光度值,计算蛋白质含量[17]。
1.2.3 ELISA方法的建立
1)酶标板包被抗原的选择
将Nisin-OVA偶联物及Nisin分别稀释至相同的浓度,包板后采用间接竞争法检测。
2)最佳抗原抗体稀释质量浓度配比的确定
将上步选定好的抗原和抗体分别梯度稀释后,带2.5 μg/mL的标准品进行检测,确定抗原抗体的最佳稀释倍数。
3)标准曲线的建立
通过预实验,将标准品稀释为 0.1、0.5、2.5、12.5、62.5 μg/mL 作为标准点,各取 50 μL 加入已包被有抗原的酶标板孔,然后加入50 μL按最佳稀释倍数稀释的抗体溶液,置于37℃避光反应30 min,取出洗板4~5次。每孔加入已经稀释好的酶标抗体100 μL,37 ℃避光反应 30 min,取出洗板 4~5 次。加入底物显色液100 μL后,37℃避光反应15 min,用酶标仪在450/630 nm处测定波长,建立标准曲线。
4)样品处理方法的选择
将肉制品剁碎成粉末状后取样,用稀释液稀释不同的倍数;含乳饮料直接稀释不同的倍数后分别进行直接检测和添加标准品后测定回收率。选择样本检测值稳定、添加回收率准确的样本处理方法。
1.2.4 ELISA方法的评价
1)方法的灵敏度
评价竞争ELISA方法灵敏度的指标,常用的有IC50抑制浓度 (指0标准溶液吸光度值的50%处所对应的标品浓度)和最低检测限,两者值越低说明试剂盒的灵敏度越高。一般规定20份空白样品或零标准品的测定平均值加3倍标准差为方法的最低检测限。分别测定20次标准曲线的IC50抑制浓度,确定该值浮动范围。分别测定20份空白含乳饮料和肉制品,求其对应的最低检测限。
2)方法的准确度和精密度
取空白肉制品样品以 0.5、10、100 μg/g Nisin 进行添加, 取空白乳制品样品以 1、30、300 μg/mL Nisin进行添加,每种样品、每个质量分数或质量浓度各取5个平行,分别用不同批次制备的间接竞争ELISA试剂盒进行测定。
2 结果与分析
2.1 Nisin多克隆抗体的制备
用Nisin直接免疫的兔子得到的抗血清效价比用Nisin-BSA偶联物免疫的兔子的抗血清效价高,说明Nisin具备免疫原性。 经过8次免疫后,采血检测抗血清的效价达到1∶10 000。纯化后的抗体用紫外分光光度计测得蛋白质质量浓度为10.66 mg/mL。
2.2 包被抗原的选定结果
取Nisin-OVA偶联物及Nisin分别包被后的检测结果,见表1。
从表1可见,在相同条件下,Nisin-OVA偶联抗原包被比用Nisin直接包被测得的OD值高,且带2 μg/mL的标准品的OD值在0标准品OD值的一半左右。因此用Nisin-OVA偶联抗原作为包被原效果更好,这可能是因为Nisin是一种多肽,聚苯乙烯酶标板对多肽的吸附性并不好,故需要将其与大分子蛋白进行偶联才能更好地吸附在酶标板上。
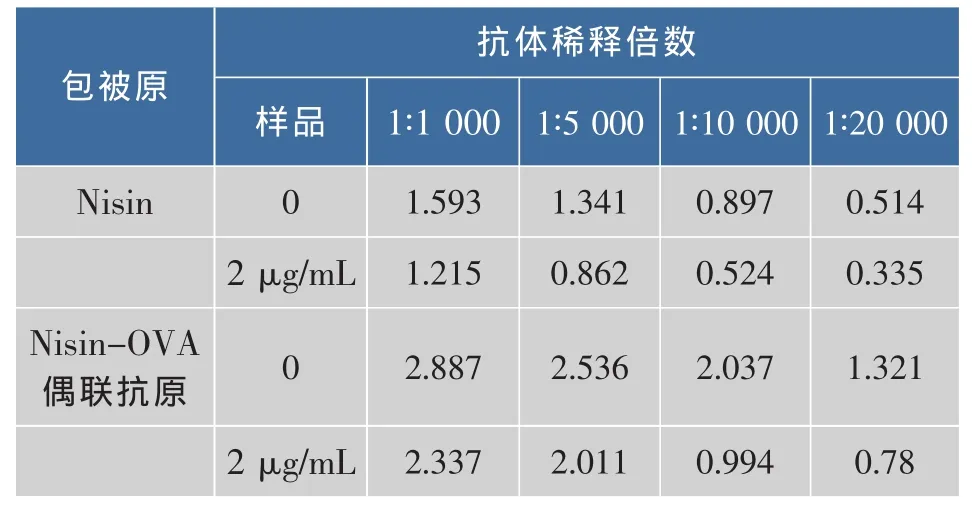
表1 不同包被原的检测结果Table 1 Different package of the original test results
2.3 抗原与抗体最佳稀释倍数的确定
抗原和抗体按照不同的稀释倍数稀释后,采用间接竞争ELISA法测得OD值,见表2。

表2 抗原抗体稀释倍数的选定Table 2 Selected antigen-antibody dilution factor
由表2可以看出,当抗原稀释1 000倍、抗体稀释10 000倍时,带2.5 μg/mL的标准品的抑制最好,综合考虑成本以及误差等因素,故选用抗原和抗体的最佳稀释倍数均为10 000倍。
2.4 标准曲线的建立结果
通 过 实 验 最 终 选 中 0、0.1、0.5、2.5、12.5、62.5 μg/mL这几个质量浓度作为曲线中标准品的最终质量浓度。以标准品浓度的对数值(logC)为横坐标,以吸光度值的logit值为纵坐标建立双对数直线拟合曲线,数学模型为logit y=a+blogC。其中logit y=ln(A/(A0-A)),A0为零标准品的吸光度值,A 为其他质量浓度标准品吸光度值。建立的标准曲线见图1,该曲线的IC50为1.1 μg/mL,曲线的相关系数为r=0.993 4。

图1 标准曲线图Fig.1 Standard curve
2.5 样品前处理方法的选定
将含乳饮料用样本稀释液稀释10倍,取50 mL用于分析。
将肉制品样本剁碎成粉末状,取1 g样本至50 mL的离心管内,加入5 mL的样本稀释液,充分震荡混匀后静置10 min,小心地提取上清液1 mL至2 mL的离心管中用于分析,注意不要吸到表层的油脂和底层的沉淀物。取50 μL用于分析。
经验证,上述方法处理的样本检测结果准确,且添加回收率正常。
2.6 方法的灵敏度
20次标准曲线的IC50测定结果见表3。
从表 3可知,IC50平均值为 1.16 μg/mL,浮动范围在1.0~1.4 μg/mL之间。经计算IC50的平均值±3倍标准差的范围为0.8~1.5 μg/mL;因此确定标准曲线 IC50应在 0.8 μg/mL~1.5 μg/mL 的范围之内。
对空白含乳饮料和肉制品的最低检测限的检测结果见表4和表5。

表3 IC50统计表Table 3 IC50tables μg/mL
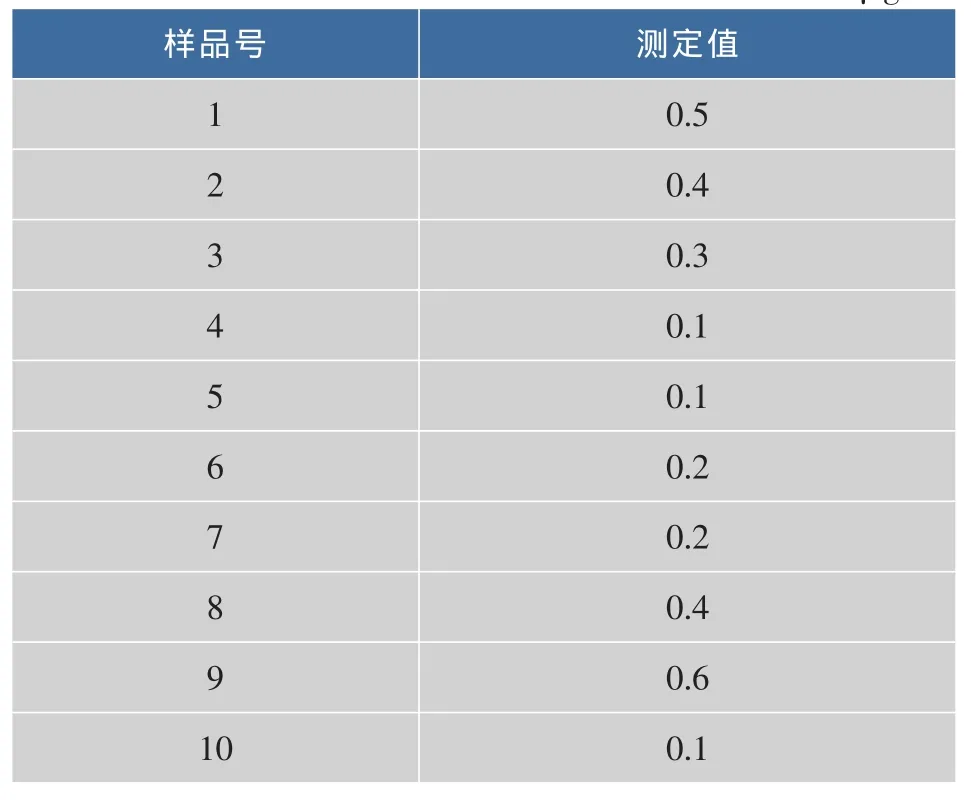
表4 空白含乳饮料测定结果统计表Table 4 Blank milk drinks determination of the results of tables μg/mL

续表4
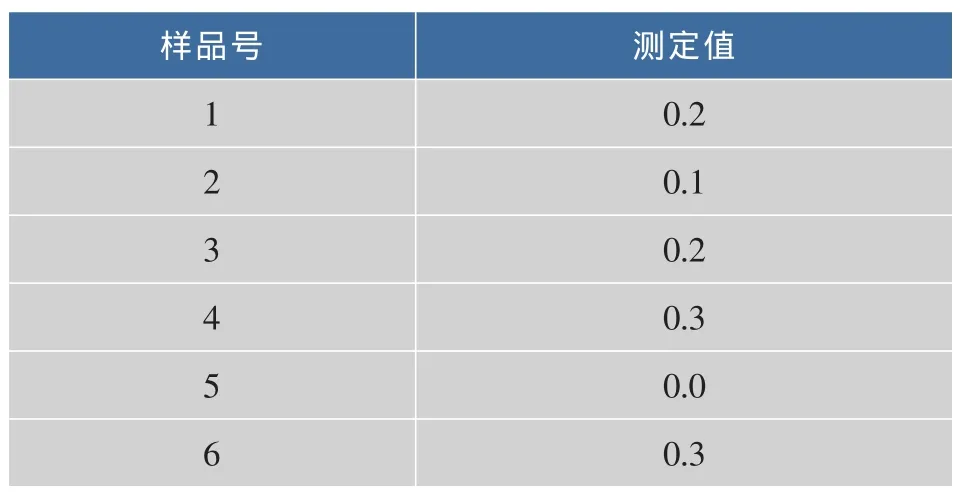
表5 空白肉制品测定结果统计表Table 5 Blank meat products determination of the results of tables μg/mL

续表5
从表4和表5可见,空白乳制品样品的最低检测限为0.85 μg/mL,空白肉制品样品的最低检测限为 0.45 μg/mL。
2.7 方法的准确度和精密度
对样本按不同质量浓度的标准品进行添加后,检测得到的变异系数和添加回收率见表6和表7。

表6 含乳饮料样品精密度及准确度的试验Table 6 Milk beverage sample precision and accuracy test
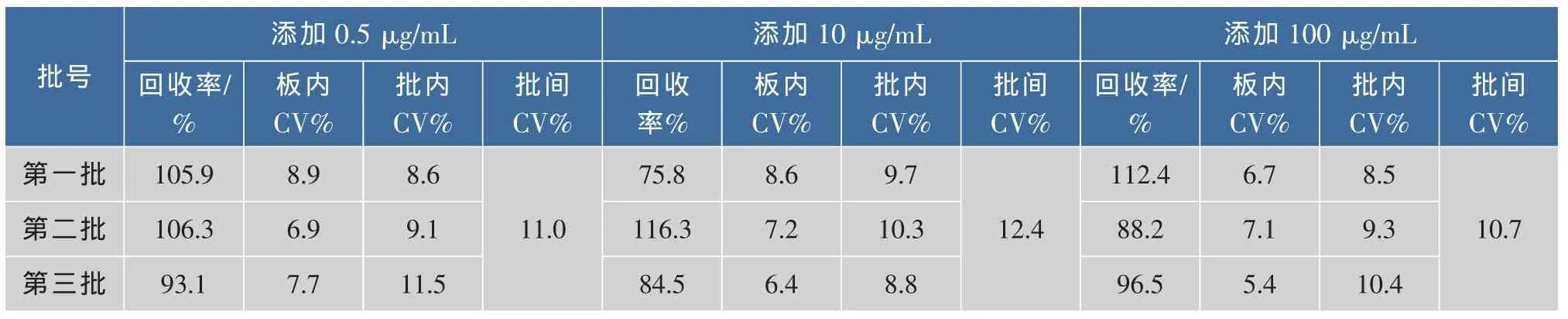
表7 肉制品样品精密度及准确度的试验Table 7 Meat samples the precision and accuracy test
从表6和表7可以看出,对肉制品样品以0.5、10、100 μg/g 3个质量分数的乳酸链球菌素进行添加,测定变异系数和回收率,样品的板内变异系数为5.4%~8.9%之间,样品的回收率在75.8%~112.4%之间;对乳制品样品以 1、30、300 μg/mL 3 个质量浓度的Nisin进行添加,样品板内变异系数为5.4%~8.3%之间,样品的回收率在78.6%~117.9%之间。
综上所述,所测样品的板内变异系数在5.4%~8.9%之间,均小于20%,所测批内、批间的变异系数小于20%。样品的回收率均达75.8%~117.9%之间。
4 结语
建立了一种快速、简便的检测Nisin的方法——间接竞争酶联免疫吸附法。该方法利用预先包被在酶标板孔上的抗原(Nisin-OVA偶联物)和样本中的Nisin和抗体(抗Nisin多克隆抗体)竞争性的结合原理,用酶标二抗(羊抗兔抗抗体)与已经结合的抗原抗体结合物反应,进行Nisin的检测分析。利用结合的酶标记物使无色的底物产生颜色深浅,以进行定性或定量检测。该方法稳定性、重复性好,其检测低限为:牛奶、饮料、乳制品为1.0 mg/L(mg/kg);肉制品为 0.5 mg/kg,检测范围 0.5~600 mg/kg(mg/L)之间。用该方法制备的试剂盒经稳定性试验验证,在4℃环境下可稳定6个月以上,达到应用要求。
[1]缪存影.天然食品防腐剂——乳酸链球菌素[J].中国食物与营养,2008(4):30-32.MIAO Cun-yin.Natural food preservative-Nisin[J].Chinese Food and Nutrition,2008(4):30-32.(in Chinese)
[2]汤凤霞,蔡慧农.微生物防腐剂Nisin的研究与应用[J].食品科技,2002(11):46-48.TANG Feng-xia,CAI Hui-nong.Study and application of microbioal preservative Nisin[J].Food Science and Technology,2002(11):46-48.(in Chinese)
[3]孙来华,张志强.乳酸链球菌素的特性及其在食品中的应用[J].食品研究与开发,2008,29(10):119-121.SUN Lai-hua,ZHANG zhi-qiang.The application of Nisin in food processing[J].Food Research and Development,2008,29(10):119-121.(in Chinese)
[4]Turcotte C,Lacroixb C,Kheadra E,et al.A rapid turbidonmetric microplate bioassay for accurate quantification of lactic acid baxteria bacteriocins[J].Int J Food Microbiol,2004,9(3):283-284.
[5]肖长青,赵海,戚天胜.国外医药抗生素分册:细菌素Nisin检测方法[M].北京:[出版者不详],2004.
[6]Wolf C E, Gibbons W R.Improve method for quantification of the bacteriocins Nisin[J].Appl Bacteriol,1996,80:453-454.
[7]张国只,陈林海,杨天佑,等.琼脂扩散法测定乳链菌肽效价的优化[J].食品科学,2007(3):175-177.ZHANG Guo-zhi,CHENG Lin-hai,YANG Tian-you,et al.Optimization of agar diffusion bioassay for Nisin[J].Food Science,2007(3):175-177.(in Chinese)
[8]Reunanen J,Saris P E J.Microplate bioassay for nisin in foods based on nisin-induced green fluorescent protein fluorescence[J].Appl Environ Microbiol,2003,69:4214-4216.
[9]Wahlstom G,Ssaris P E J.Anisin bioassay based on bioluminescence[J].Appl Environ Microbiol,1999,65:37-42.
[10]Falahee M B,Adams M R,Dale J W,et al.Cross-reactivity of bacteriocins from lactic acid bacteria and lantibiotics in a nisin bioassay and ELSA[J].J Food Sci Technol,1992,25:590-591.
[11]Suacrez A M,Rodrycguez J M,Hernacndez P E,et al.Generation of polyclonalantibodies against nisin:immunization strategies and immunoassay development[J].App Euviron Microbiol,1996,62:117-119.
[12]陈蕾,何小维,刘晓云.甲基苯丙胺与蛋白质结合物的合成[J].中国药物依赖性杂志,2010,19(6):23-25.CHEN Lei,HE Xiao-wei,LIU Xiao-yun.Synthesis of methamphetamine-bovine serum albumin conjugates[J].Chinese Journal of Drug Dependence,2010,19(6):23-25.(in Chinese)
[13]Juan L A,Javier F,Pilar G,et al.Antimicrobial activity of reuterin in combination with nisin against food-borne pathogens[J].International Journal of Food Microbiology,2004,95:225-229.
[14]Naomi E K,Eddy J S,Jan K,et al.Resistance of Gram-positive bacteria to nisin is not determined by Lipid Ⅱ Levels[J].Femsmicro-biology letters,2004,239:157-161.
[15]Lambert L A,Wamer W G,Wei R R,et al.The protective but nonsynergistic effect of dietary β-carotene and vitamin E on skin tumorigenesis in skh mice[J].Nutrition and cancer,1994,21(1):1.
[16]刘晓波,蔡美英,王霞,等.一种简单实用纯化腹水McAb方法-辛酸/硫酸铵法[J].华西医大学报,1999,30(4):455-456.LIU Xiao-bo,CAI Mei-ying,WANG Xia,et al.One simple and efficient method for purification of IgG McAb from mice ascites:caprylic acid/ammonium sulfate precipitation[J].Journal of West China University of Medical Sciences,1999,30 (4):455-456.(in Chinese)
[17]杨利国,胡少昶,魏平华,等.酶免疫测定技术[M].南京:南京大学出版社,1998:272-273.
