芦笋醇提取物的免疫调节作用
2013-02-19马淑凤李汉臣王周平黄云祥
王 芳 , 马淑凤 *, 李汉臣 , 王周平 , 黄云祥 , 代 卉
(1.食品科学与技术国家重点实验室 江南大学,江苏 无锡 214122;2.江南大学 食品学院,江苏 无锡 214122;3.河北师范大学 食品科技学院,河北 秦皇岛066600)
芦笋 (Asparagus officinalis L.) 俗称石刁柏、龙须菜等,被世界卫生组织列为世界十大最具有营养价值的蔬菜之首,是国际上公认的防癌保健蔬菜[1]。芦笋不仅可以食用,其加工残渣物可以作为苏云金芽孢杆菌固态发酵的培养基[2]。芦笋含有多种活性成分,如黄酮、芦笋多糖、氨基酸、微量元素、皂苷[3]等。随着芦笋的大量种植,我国已成为世界上第一大芦笋生产国和出口国,芦笋产业在我国得到迅猛发展。许多研究者不仅对芦笋的加工生产[4]、组成成分与结构化学成分[5]和贮藏过程中功能成分的变化[6]做了系统研究,而且对芦笋的抗疲劳[7]、抗肿瘤[8]、免疫调节[9]、抗炎[10]等生物活性进行了部分研究。芦笋的保健功能成为近些年国内外关注的热点之一。Gautam M等人[9]对芦笋根水提取物调节细胞亚群的免疫活性做了较深入研究。然而许多生物活性物质是通过作用于免疫器官或者调节多种免疫细胞来发挥免疫作用的。因此,本实验以风干芦笋的乙醇提取物为研究对象,对其特异性和非特异性免疫功能进行了初步研究,旨在为芦笋的保健食品研发提供科学依据。
1 材料与方法
1.1 供试样品
芦笋醇提取物由秦皇岛长胜农业科技发展有限公司提供。
1.2 试剂
菝葜皂苷元标准品,上海源叶/永叶生物科技有限公司提供;葡萄糖标准品,天冬氨酸标准品,中国食品药品检定研究院提供;RPMI1640细胞培养液,胎牛血清,生工生物工程上海有限公司提供;刀豆蛋白 A(ConA),噻唑蓝(MTT),Sigma 公司提供;绵羊红细胞 (SRBC),广州蕊特生物科技有限公司提供;豚鼠血清:健康豚鼠心脏取血,离心,分离出血清;谷氨酰胺,华美生物工程公司提供;HEPES、FITC异硫氰酸荧光素,北京拜尔迪生物技术有限公司提供。
1.3 主要仪器
Zenth 3100型,荧光/化学发光分析仪,奥地利Anthos产品;MK3酶标仪,上海雷勃分析仪器厂产品;超低温冰箱,SANYO公司产品;二氧化碳培养箱,Thermo Forma公司产品;净化工作台,苏州净化设备厂产品;倒置式生物显微镜,重庆光电仪器有限公司产品;UV2800型紫外可见分光光度计,尤尼柯上海仪器有限公司产品。
1.4 实验动物
30 日龄健康昆明种小鼠,体质量(20±2) g,单一雄性:上海斯莱克实验动物有限责任公司提供,动物合格证号2007000517939。
1.5 芦笋乙醇提取物的成分分析
芦笋乙醇提取物中总皂苷含量的测定采用香草醛-高氯酸法[11]:精确吸取各质量浓度菝葜皂苷元标准品甲醇溶液 (分别为 0、0.1、0.15、0.2、0.3、0.4 mg/mL)0.5 mL,70℃水浴挥干溶剂,加入新配制的5 g/dL香草醛-冰醋酸溶液0.2 mL,高氯酸0.8 mL,摇匀密封,于70℃水浴15 min,取出,立即用冷水冷却,加入5 mL的冰乙酸,摇匀,反应5 min,以溶剂作空白,于535 nm处测吸光度,以吸光度(A)对菝葜皂苷元质量浓度(C)绘制标准曲线。称取0.40 mg干燥至恒重的芦笋乙醇提取物溶解于10 mL甲醇中,按上述步骤操作。根据标准曲线计算提取物中的总皂苷含量。
总多糖含量采用蒽酮-硫酸法测定[12]:精密量取不同质量浓度葡萄糖对照品水溶液 (分别为0、0.018、0.036、0.054、0.09 和 0.108 mg/mL)各 1.0 mL于10 mL的玻璃离心管中,分别加入0.2 g/dL蒽酮硫酸试剂4 mL,混匀,立即置冰水浴中冷却5 min,取出后置沸水浴中加热10 min,取出,置冷水流中冷却至室温。以溶剂为空白,于626 nm处测定吸收度,以吸光度(A)对葡萄糖质量浓度(C)绘制标准曲线。称取0.40 mg干燥至恒重的芦笋乙醇提取物溶解于10 mL蒸馏水中,按上述步骤操作。根据标准曲线计算提取物中的总多糖含量。
总游离氨基酸采用茚三酮法测定[13]:分别精密量取不同质量浓度天冬氨酸标准品水溶液(分别为0、0.015、0.03、0.045 和 0.09 mg/mL)各 1.0 mL 于 10 mL的量瓶中,分别加入醋酸-醋酸钠缓冲液(pH 5.5)2 mL和3 g/dL的茚三酮70%体积分数乙醇溶液1 mL,混匀,沸水浴加热15 min,取出,冷却至室温,加水定容至刻度,摇匀。以溶剂为空白,在570 nm波长处测定吸收度,以吸光度(A)对天冬氨酸质量浓度(C)绘制标准曲线。称取0.40 mg干燥至恒重的芦笋乙醇提取物溶解于10 mL蒸馏水中,按上述步骤操作。根据标准曲线计算提取物中的总游离氨基酸含量。
1.6 动物实验
48只昆明种小鼠,按体重随机均分成4组:空白对照组、低剂量组、中剂量组和高剂量组。低、中、高剂量组分别按7、70、140 mg/kg芦笋醇提物灌胃,对照组按10 mL/kg灌胃无菌生理盐水。每日一次,连续灌胃30 d,第25天 所有小鼠均腹腔注射0.2 mL 2%体积分数的压积绵羊红细胞进行免疫。末次给药后禁食12 h后处理。
1.6.1 小鼠免疫器官胸腺、脾脏质量法测定 根据按《保健食品检验与评价技术规范》(2003版)中的方法测定[14]。
1.6.2 芦笋乙醇提取物对腹腔巨噬细胞吞噬功能的影响 无菌取腹腔巨噬细胞,调整巨噬细胞浓度为 2×106mL,RPMI 1640 完全培养基,100 μL/孔,37℃,CO2下培养4 h,贴壁,更换培养基继续培养4 h,加芦笋乙醇提取物100 μL培养 24 h,4 000 r/min离心10 min,去上清液,将标记浓缩液调细胞数至1×108mL,100 μL/孔加入已处理的腹腔巨噬细胞内,继续培养1 h,将培养板放置冰上5 min,终止吞噬反应,300 g,5 min,4 ℃离心,去上清液,加冷 PBS洗涤2次,加100 μL PBS,混匀,485 nm激发光,530 nm发射光测定荧光值,此值为吞噬及表面荧光总和。详见文献[15]。
将上述测定板离心,去上清液,加1 g/dL的台酚蓝-PBS 100 μL,离心,去上清液,加 100 μL PBS溶解,测定荧光值,此值为表面荧光值。
巨噬细胞吞噬能力=吞噬及表面荧光总和-表面荧光值
1.6.3 ConA诱导的小鼠脾淋巴细胞转化实验(MTT法) 将细胞悬液分两孔加入96孔培养板中,每孔200 mL,一孔加15 μL ConA液,另一孔作为对照,置质量分数5%CO2,37℃ CO2孵箱中培养48 h。培养结束后,每孔轻轻吸去上清液100 μL,同时加入MTT(5 mg/mL)20 μL/孔,继续培养 4 h。 培养结束后,每孔加入100 μL酸性异丙醇,吹打混匀,使紫色结晶完全溶解。用酶联免疫检测仪,以570 nm波长测定光密度值。详见文献[14]。
受试样品组的光密度差值显著高于对照组的光密度差值,可判定该项实验结果阳性。
1.6.4 半数溶血值(HC50)测定 用生理盐水将小鼠血清稀释200倍,将稀释后的血清1 mL置试管内,依次加入10%体积分数的SRBC 0.5 mL,补体1 mL(用SA液按1∶8稀释)。另设不加血清的对照管(以SA液代替)。置37℃恒温水浴中保温15~30 min后,冰浴终止反应。2 000 r/min离心10 min。取上清液1 mL,加都氏试剂3 mL,同时取10%体积分数SRBC 0.25 mL加都氏试剂至4 mL,充分混匀,放置10 min后,于540 nm处以对照管作空白,分别测定各管光密度值。溶血素的量以半数溶血值(HC50)表示,按下式计算:

受试样品组的HC50显著高于对照组的HC50,可判定该项实验结果阳性。
1.7 数据处理
实验数据均以平均数±标准差(x±s)表示。组间差异比较用SPSS 10统计软件作方差分析。
2 材料与方法
2.1 芦笋乙醇提取物的成分分析
对风干芦笋乙醇提取物活性成分的测定结果见表1。可以看出,风干芦笋经乙醇提取后,富含皂苷、多糖、总游离氨基酸等活性成分,表明乙醇提取能较好地富集芦笋活性成分。
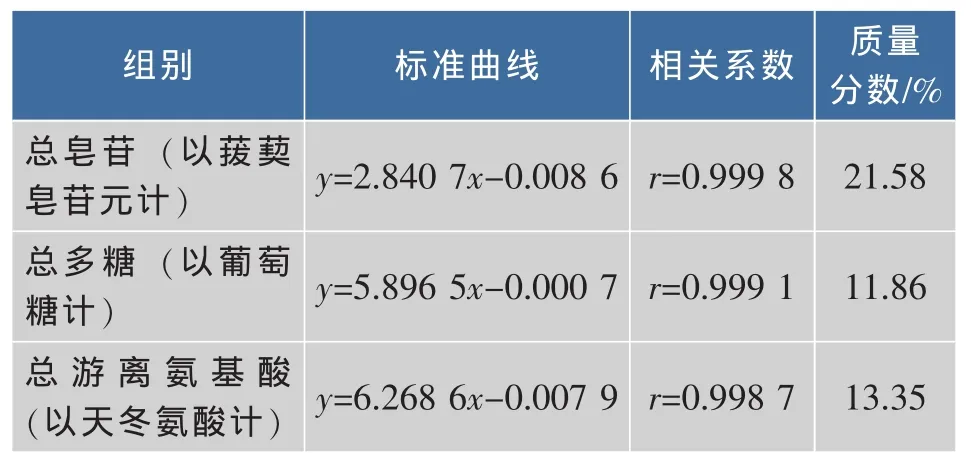
表1 芦笋乙醇提取物中活性成分含量Table 1 Analysis of Ethanol extract active components from asparagus(X±S,n=3)
2.2 芦笋乙醇提取物对小鼠胸腺指数和脾指数的影响——非特异性免疫
胸腺指数和脾脏指数是评价机体非特异性免疫响应的重要指标。实验测定了不同剂量组芦笋乙醇提取物对小鼠胸腺指数和脾指数的影响,结果如表2所示。可以看出,芦笋乙醇提取物低、中、高剂量组的处死前体重与空白对照组相比差异不显著。对照组与芦笋乙醇提取物低剂量组的脾指数相比差异不显著,与中、高剂量组的脾指数相比差异均显著,表明芦笋乙醇提取物具有增值脾脏指数的作用,并且随芦笋皂苷剂量增加,脾脏指数呈增加的趋势。芦笋乙醇提取物中剂量组的胸腺指数与对照组相比差异极显著,低、高剂量组的胸腺指数与对照组相比差异不显著。表明芦笋乙醇提取物对胸腺指数具有一定增加作用。
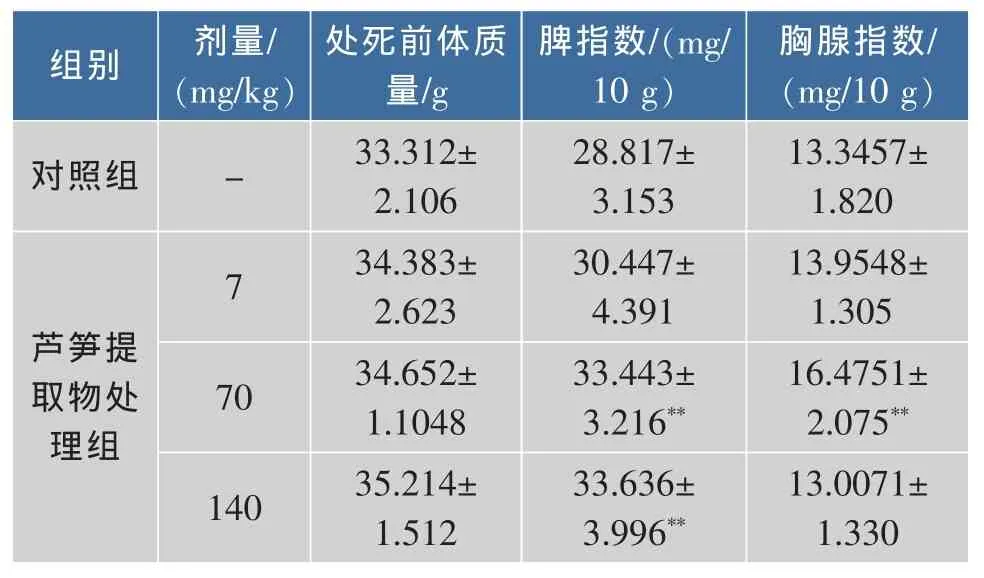
表2 芦笋乙醇提取物对小鼠脾指数和胸腺指数的影响Table 2 Effects of asparagus ethanol extract on spleen index and thymus index of mice(X±S,n=12)
2.3 芦笋乙醇提取物对小鼠腹腔巨噬细胞吞噬功能的影响——非特异性免疫
巨噬细胞属免疫细胞,有多种功能,是研究细胞吞噬、细胞免疫和分子免疫学的重要对象,其吞噬功能可反映机体的非特异性免疫功能。实验测定了不同剂量组芦笋乙醇提取物对小鼠腹腔巨噬细胞吞噬功能的影响。结果(表3)显示,与对照组相比,芦笋乙醇提取物能显著提高腹腔巨噬细胞的吞噬功能,70 mg/kg剂量组的腹腔巨噬细胞的吞噬功能最强。说明芦笋乙醇提取物有助于提高小鼠的非特异免疫功能。
2.4 芦笋乙醇提取物对脾淋巴细胞增殖能力的影响(MTT)——特异性免疫
当T淋巴细胞受ConA刺激后发生母细胞转化,活细胞特别是增殖细胞通过线粒体水解酶将MTT(一种淡黄色的唑氮盐)分解为兰紫色结晶而显色,其光密度值能反映细胞的增殖情况[14]。实验测定了不同剂量组芦笋乙醇提取物对脾淋巴细胞增殖能力的影响。结果(表4)表明:经口给予小鼠不同剂量芦笋乙醇提取物30 d后,与空白对照组比较,70 mg/kg、140 mg/kg剂量组能显著增强ConA诱导的小鼠脾淋巴细胞转化能力(P<0.01)。而7 mg/kg剂量实验组的脾淋巴细胞转化能力未发生明显变化(P>0.05)。淋巴细胞在免疫调控中起重要作用,特异性免疫是由淋巴细胞识别外源性抗原开始,通过增殖和分化成效应细胞行使清除抗原的功能。因此,淋巴细胞的增殖反应是反映淋巴细胞活化和功能的重要指标[16]。本实验说明一定剂量的芦笋乙醇提取物能够刺激淋巴细胞增殖的有丝分裂源活性,具有显著增强其细胞免疫功能,并且随芦笋乙醇提取物剂量增加,淋巴细胞增殖能力呈增强趋势。

表3 芦笋乙醇提取物对小鼠腹腔巨噬细胞吞噬功能的影响Table 3 Effects of asparagus ethanolextract on macrophage phagocytosis (X±S,n=12)
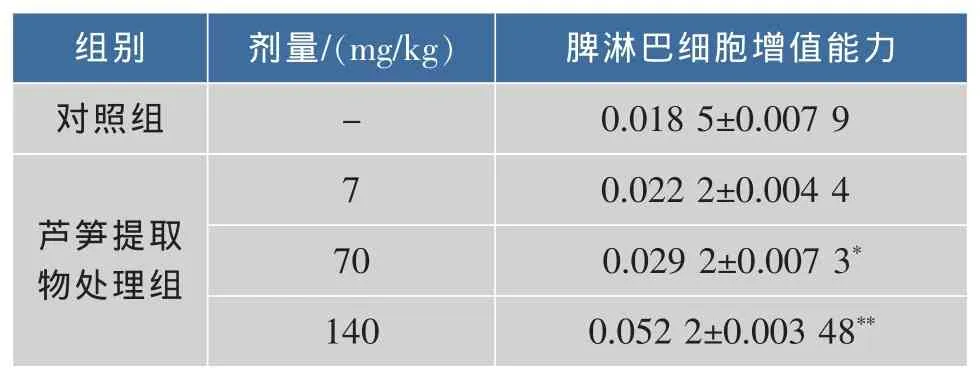
表4 芦笋乙醇提取物对脾淋巴细胞增值能力的影响Table 4 Effects of asparagus ethanol extract on spleen lymphocytes multiplication (X±S,n=12)
2.5 芦笋乙醇提取物对半数溶血值 (HC50)的影响——特异性免疫
血清溶血素含量(HC50)可以反映B淋巴细胞受抗原刺激后分化成浆细胞并产生抗体的能力,其含量与机体体液免疫能力呈正相关[17]。实验进一步考察了不同剂量组芦笋乙醇提取物对半数溶血值(HC50)的影响。 结果(表 5)表明:低、中和高剂量组的半数溶血值HC50与空白对照组比较差异极显著,低、中和高剂量组间的差异也极显著,剂量与效应呈正相关关系。表明芦笋乙醇提取物能显著提高溶血素的生成量,具有很强体液免疫调节功能。
表5 乙醇提取物对小鼠半数溶血值的影响Table 5 Effects of asparagus ethanol extract on HC50 (±S,n=12)
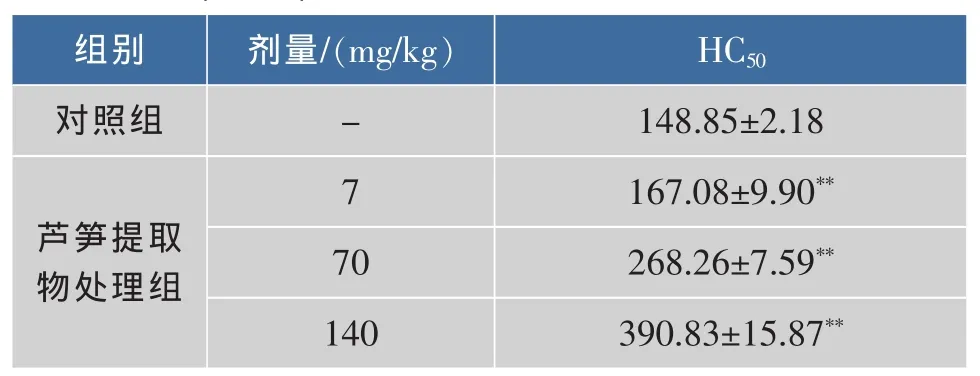
表5 乙醇提取物对小鼠半数溶血值的影响Table 5 Effects of asparagus ethanol extract on HC50 (±S,n=12)
注:compare with control,*P<0.05;**P<0.01;Production of hemolysin was indicated by HC50。
组别 剂量/(mg/kg) HC50对照组 - 148.85±2.18 7芦笋提取物处理组167.08±9.90**70 268.26±7.59**140 390.83±15.87**
3 结语
用乙醇提取风干芦笋,可以得到芦笋的多种活性成分,其主要包括芦笋皂苷、芦笋多糖和多种游离氨基酸。Gautam M等人[9]报道指出,芦笋根水提取物可以显著增加外周血CD3和CD4/CD8的百分比,降低其Th1/Th2比值;实验表明,芦笋根水提物具有T淋巴细胞的活化作用。该研究针对芦笋根水提取物对细胞亚群的免疫活性做了较深入分析。本实验对芦笋乙醇提取物调节小鼠的非特异性和特异性免疫功能进行了全面研究,结果显示芦笋乙醇提取物可以显著增强脾脏淋巴细胞增殖能力,极显著提高血清溶血素含量,并具有剂量依赖性;同时,芦笋乙醇提取物可显著提高小鼠的脾脏指数和腹腔巨噬细胞的吞噬能力,表明芦笋乙醇提取物可以通过调节巨噬细胞活性来实现免疫调节作用。以上结果表明,芦笋乙醇提取物对小鼠的非特异性免疫功能和特异性免疫功能均有明显的增强作用。
本实验首次以芦笋的乙醇提取物为研究对象进行其免疫功能研究,对于剂量的选择是一个初步的探索,以推荐人剂量的1倍、10倍、20倍剂量作为小鼠灌胃剂量,剂量选择的跨度相对较大,以此来探索芦笋乙醇提取物的有效剂量区间,今后将在本次实验的基础上寻求芦笋乙醇提取物发挥免疫功能作用的最佳剂量,并从细胞水平和分子水平展开芦笋乙醇提取物调节机体免疫机理方面的研究工作。
[1]胡立勇,余德谦.芦笋栽培与加工[M].北京:科学技术文献出版社,1998:1-10.
[2]Zhao Q S,Zhao B.Production of bacillus thuringiensis biopesticide using extract residue of Asparagus officinalis as substrate by solid state fermentation[C]//2010 Internantional Symposium On Advanced Biological Engineering.Beijing:[s.n.],2010.
[3]季宇彬,许贺.芦笋抗肿瘤活性成分及作用机制的研究进展[J].药品评价,2008,5(9):428-432.JI Yu-bin,XU He.Study progress on anti-tumor mechanism of active components in asparagus officinalis[J].Drug Evaluation,2008,5(9):428-432.(in Chinese)
[4]朱丽霞,魏东.芦笋保健醋饮料的研制及其降血脂试验[J].食品研究与开发,2009,30(10):64-67.ZHU Li-xia,WEI Dong.Preparation of asparagus healy vinegar beverage and its reducing blood lipid fuction[J].Food Research and Development,2009,30(10):64-67.(in Chinese)
[5]顾关云,蒋昱.芦笋的化学成分和生物活性[J].国外医药:植物药分册,2007,22(2):47-50.GU Guan-yun,JIANG Yu.The chemical composition and biological activity of asparagus[J].World Phytomedicines,2007,22(2):47-50.(in Chinese)
[6]熊光权,周明,叶丽秀.芦笋贮藏过程中功能成分的变化研究[J].食品科学,2005,26(9):537-542.XIONG Guang-quan,ZHOU Ming,YE Li-xiu.The change of functional components in asparagus officinalis during storage period[J].Food Science,2005,26(9):537-542.(in Chinese)
[7]冯翠萍,程红艳,刘喜文,等.芦笋皮对小鼠抗疲劳作用的实验研究[J].营养学报,2003,25(3):330-332.FENG Cui-ping,CHENG Hong-yan,LIU Xi-wen,et al.Study of asparagus peel on delay of fatigue in mice[J].Acta Nutrimenta Sinica,2003,25(3):330-332.(in Chinese)
[8]夏俊,陈治文,胡守芬,等.芦笋提取物抑制恶性黑色素瘤A375细胞增值的研究[J].蚌埠医学院学报,2004,29(2):95-97.XIA Jun,CHEN Zhi-wen,HU Shou-fen,et al.Asparagus extract in inhibiting the proliferation of melanoma A375 cells[J].Journal of BengBu Medical College,2004,29(2):95-97.(in Chinese)
[9]Gautam M,Saha S,Bani S,et al.Immunomodulatory activity of asparagus racemosus on systemic Th1/Th2 immunity:Implications for immunoadjuvant potential[J].Journal of Ethnopharmacology,2009,121:241-247.
[10]Lee D Y,Choo B K,Yoon T,et al.Anti-Inflammatory effects of asparagus cochinchinensis extract in acute and chronic cutaneous inflammation[J].Journal of Ethnopharmacology,2009,121:28-34.
[11]孙健,李曼,王丽卫,等.芦笋下脚料皂苷超声提取工艺[J].食品科学,2011,32(14):152-154.SUN Jian,LI Man,WANG Wei-li,et al.Ultrasonic-Assisted extraction of saponins from asparagus officinalis scraps[J].Food Science,2011,32(14):152-154.(in Chinese)
[12]付志红,谢明勇,聂少平,等.不同品种车前子中多糖含量比较[J].中国中药杂志,2004,29(6):581-582.FU Zhi-hong,XIE Ming-yong,NIE Shao-ping,et al.Determination of the contents of polysaccharides in the seeds of plantago asiatica L and plantago depressa WILLD[J].China Journal of Chinese Materia Medica,2004,29(6):581-582.(in Chinese)
[13]黄 松,吴月娜,刘梅,等.茚三酮比色法测定青天葵中总游离氨基酸的含量[J].中国中医药信息杂志,2010,17(12):50-52.HUANG Song,WU Yue-na,LIU Mei,et al.Quantitative determination of total Free-Amino acid in nervilia fordii(Hance) schltr by ninhydrin colorimetric method[J].Chinese Journal of Information on Traditional Chinese Medicine,2010,17 (12):50-52.(in Chinese)
[14]中华人民共和国卫生部.保健食品检验与评价技术规范[S].北京:人民卫生出版社,2003,77:22-34.
[15]Bonar A,Chmiela M,Rudnicka W,et al.Mannose-Binding lectin enhances the attachment and phagocytosis of mycobacteria in vitro[J].Arch Immunol Ther Exp,2005,53(5):437-441.
[16]林学颜,张玲.现代细胞与分子免疫学[M].第2版.北京:科学出版社,2000.
[17]代卉,乐国伟,孙进,等.小麦肽对受环磷酰胺免疫抑制小鼠的免疫调节及抗氧化功能[J].食品生物技术,2009,25(4):549-553.DAI Hui,LE Guo-wei,SUN Jin,et al.Immune modulation and antioxidant effects of wheat peptides on immunosuppressed mice[J].Chinese Journal of Biotechnology,2009,25(4):549-553.(in Chinese)
