一种真菌复合多糖提取及体外抗氧化活性的研究
2013-02-19付海田徐静静胡明华徐晓飞陈敬华
付海田, 徐静静, 邓 超, 胡明华, 徐晓飞, 陈敬华*
(1.江南大学 药学院,江苏 无锡 214122;2.无限极(中国)有限公司,广东 广州 510623)
作为主要的供能途径,氧化反应在生物体的生存过程中起着至关重要的作用[1-2]。但活性氧(ROS)会对DNA造成损伤,从而引起癌症、冠心病以及其他老年性疾病[3-4],不受机体控制产生过多的氧自由基会加快机体衰老,同时可能会引发风湿性关节炎和动脉粥样硬化等疾病[5]。而人工合成的抗氧化剂的安全性远远低于天然抗氧化剂[6]。因此,寻找一种天然的、有效的、无毒性、安全的抗氧化剂来消除体内自由基[7]成为当今医药界关注的课题。
真菌多糖是从真菌子实体、菌丝体或发酵液中分离出来的一类具有生物活性的大分子碳水化合物。研究表明,真菌多糖具有提高免疫力、抗肿瘤、延缓衰老、降血糖、降血压、降血脂等生理功效,并且对正常细胞不产生毒副作用[8-9],因此可作为潜在的机体抗氧化剂加以开发。目前关于多糖抗氧化的研究主要局限在单一多糖的层面上,而关于复合多糖的研究还较少。作者研究一种以香菇、竹荪和虫草菌粉为主要成分的真菌保健口服液中的复合多糖的提取及体外抗氧化活性,旨在为中药有效成分的进一步研究提供理论基础。
1 材料与方法
1.1 材料、试剂与仪器
保健液口服液、香菇、竹荪、虫草菌粉,均由广州无限极(中国)有限公司提供;铁氰化钾、硫酸亚铁、无水乙醇、正丁醇、三氯甲烷、溴化钾、水杨酸、三氯乙酸、三氯化铁、双氧水、DPPH等,均为国产分析纯;透析袋,购自上海捷瑞生物工程有限公司;SephadexG-200,购自上海鹏顺科学仪器有限公司。
UV-1800型紫外可见分光光度计,上海美谱达仪器有限公司制造;NICOLET NEXUS 470型红外光谱仪,Thermo Electron Corporation制造;FreeZone 2.5 L冷冻干燥机,美国Labconco有限公司制造;LC1200型凝胶渗透层析液相色谱仪,安捷伦科技有限公司制造。
1.2 复合多糖的提取
口服液中的复合多糖提取采取直接用乙醇沉淀(口服液体积∶乙醇体积=1∶4),获得的粗多糖沉淀水溶后,采用sevage法脱蛋白,将混合液(正丁醇体积∶氯仿体积=1∶4)等体积加入糖溶液中后,剧烈振摇20~30 min,静置至溶液分层,将溶剂层和溶液层中间变性蛋白质去掉,重复多次,直至无中间蛋白层出现。将脱蛋白质后的糖溶液pH调至8.0左右,55℃下滴加体积分数30%过氧化氢,保温2 h至淡黄色后,将多糖溶液醇沉复溶后,透析去除盐类等小分子物质[10-11],经G200型凝胶色谱柱纯化后,用苯酚-硫酸法检测洗脱曲线为单一对称峰(图1),证明为单一成分,经GPC检测该复合多糖重均分子量为2.4*105。洗脱液冷冻干燥得复合真菌多糖样品。
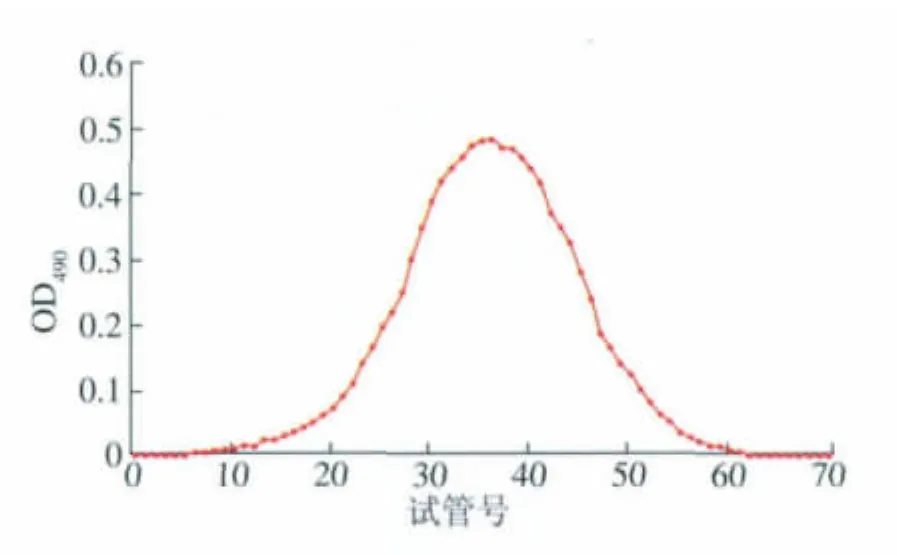
图1 口服液多糖组分的Sephadex G200型凝胶过滤色谱图Fig.1 Sephadex G -200 chromatogram of the polysaccharide extracted from the Healthy oral liquid shows a large peak near aliquot 35
1.3 单糖分析
1.3.1 多糖水解 称取20 mg左右多糖于水解管中,加入2 mL 1 mol/L的硫酸水溶液,封管,于100℃水解4 h,水解液用碳酸钡中和,过滤,滤液冷冻干燥或置真空烘箱在45℃下真空干燥,得到的干燥物即为游离单糖。
1.3.2 衍生化 称取上述干燥单糖样品加入10 mg盐酸羟胺,加入2 mg肌醇作为内标,0.5 mL吡啶,于90℃水浴中保持30 min;取出冷却后加入0.5 mL乙酸酐于90℃水浴中保持30 min,待样品冷却后进行GC分析。
1.3.3 色谱分析条件 岛津GC-14A气相色谱仪;OV1701 石英毛细管柱(30 m,0.53 mm,1.0 μm);检测器为FID(氢火焰离子鉴定器)。
1.3.4 气相条件 气化室温度260℃,检测器温度250℃;柱温升温程序:起始温度120℃,保持3 min,每分钟升10℃,至195℃,保留0.1 min,每分钟升3℃,至240℃,保留10 min;载气压力(N2)0.60 kg/cm2,燃气压力(H2):0.65 kg/cm2,助燃气压力(空气)0.50 kg/cm2,分流比 30∶1,进样量 2.0 μL。
1.4 红外图谱分析
溴化钾压片法:室温条件下,将1 mg干燥的样品与适量干燥溴化钾混合研磨压片后,在4 000~500 cm-1范围内进行红外光谱扫描并FTIR分析。
1.5 体外抗氧化活性
1.5.1 系列多糖样品溶液的配制 分别称取适量所得真菌复合多糖及其3种组分多糖 (香菇多糖、竹荪多糖和虫草多糖),用去离子水溶解配制成质量浓度为1 000 μg/mL的溶液,再分别吸取该母液2.5、1.5、0.5、0.25 mL 至试管中, 加水补至 5 mL,即得质量浓度为 500、300、100、50 μg/mL 的样品溶液。
1.5.2 还原力测定 在具塞试管中加入1 mL多糖样品(50~1 000 μg/mL)、0.2 mL PBS(2.0 mol/L,pH 6.6)和0.25 mL质量分数1%的铁氰化钾溶液。置50℃恒温水浴中反应20 min,迅速冷却,再加入10 g/dL的三氯乙酸溶液0.5 mL,3 000 g离心10 min,取上清液1.5 mL,加入0.1 mL 1 g/dL三氯化铁溶液和3.0 mL去离子水,振荡均匀,静置5 min,在700 nm处以蒸馏水代替多糖溶液为空白,测定其吸光值[12]。
1.5.3 对羟基自由基的清除 在试管中依次加入1 mL 不同质量浓度的多糖样品 (50~1 000 μg/mL),0.9 mL FeSO4(0.15 mmol/L),0.5 mL 水 杨 酸 (9 mmol/L),0.5 mL H2O2(8.8 mmol/L),37 ℃反应 60 min,于510 nm处测得不同竹荪多糖浓度下的吸光值Ax,水杨酸替代双氧水时的吸光值Ax0,水杨酸代替多糖测得空白对照吸光值A0[13]。
·OH 清除率=[A0-(Ax-Ax0)/A0]×100%
1.5.4 对DPPH自由基的清除 样品管中加入1 mL不同质量浓度的多糖溶液 (50~1 000 μg/mL)与3.0 mL的0.004%体积分数溶于95%乙醇的DPPH溶液,室温放置10 min后,517 nm处测定吸光值Ax,空白管用蒸馏水代替多糖溶液,测定值为A0,体积分数95%乙醇代替DPPH测定值为Ax0[14]。
DPPH 自由基清除率=[1-(Ax-Ax0)/A0]×100%
2 结果与分析
2.1 单糖组成
通过对各多糖的单糖组成摩尔比进行比较(见表1),可得出该复合多糖中主要成分为虫草多糖,竹荪多糖和香菇多糖含量极少,即该保健口服液中大部分原材料为成本较低的虫草菌粉。
2.2 红外分析
真菌复合多糖的特征吸收峰、红外光谱谱图见图2,表现出一般多糖的特征吸收峰:由多糖羟基的伸缩振动引起的3 600?~3 200 cm-1之间的吸收峰、由C—H伸缩振动引起的2 930 cm-1处的吸收峰等特征峰[10]。此外840 cm-1处无吸收峰,890 cm-1处有明显吸收峰,表明该复合多糖是以β糖苷键相连的。
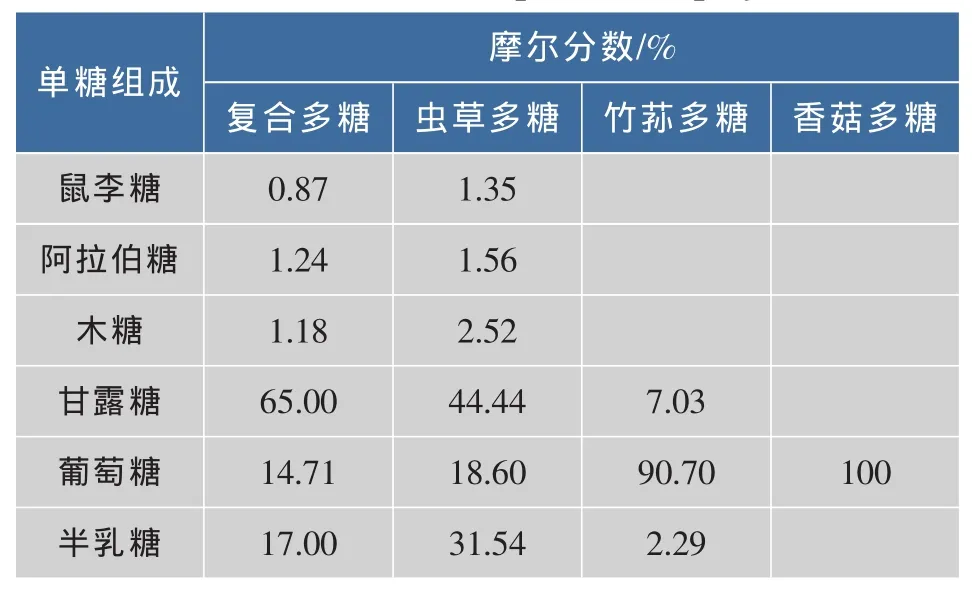
表1 各多糖单糖组成Table 1 Monosaccharide composition of polysaccharides

图2 复合多糖红外色谱图Fig.2 FTIR spectrum of the combined fungus polysaccharide
2.3 还原力测定
铁氰化钾[K3Fe(CN)6]可被还原试剂还原成亚铁氰化钾[K4Fe(CN)6],K4Fe(CN)6再和 Fe3+作用生成普鲁士蓝,在700 nm处有最大吸收值,以检测其还原力,吸光值越大,说明其还原力越高[15]。
随着多糖质量浓度的增加(图3),各多糖还原能力呈现出稳定的增长,复合多糖的还原能力在各质量浓度测量范围内均大于竹荪多糖和虫草多糖。当多糖质量浓度为50、100 μg/mL时,复合多糖与香菇多糖的还原能力无明显差异,而在较大质量浓度时复合多糖还原能力小于香菇多糖。当质量浓度为1 mg/mL时,各多糖还原能力达到最大,其中复合多糖OD700为0.478,香菇多糖为0.667。
2.4 对羟自由基清除能力测定
利用H2O2和Fe2+混合发生Fenton反应[16],生成具有很高反应活性的·OH,在该体系内加入水杨酸可捕捉·OH并产生深色物质,该物质在510 nm处有最大吸收。
随着多糖质量浓度的增加,各多糖对羟基自由基清除能力呈现出稳定的增长(图4),复合多糖的清除能力在各质量浓度测量范围内均大于竹荪多糖和虫草多糖,小于香菇多糖的清除能力。当多糖质量浓度为1 000 μg/mL时,各多糖对羟基的清除能力达到最大,其中复合多糖清除率为44.26%,香菇多糖清除率为61.76%,虫草多糖清除率为32.41%,竹荪多糖清除率为26.85%。
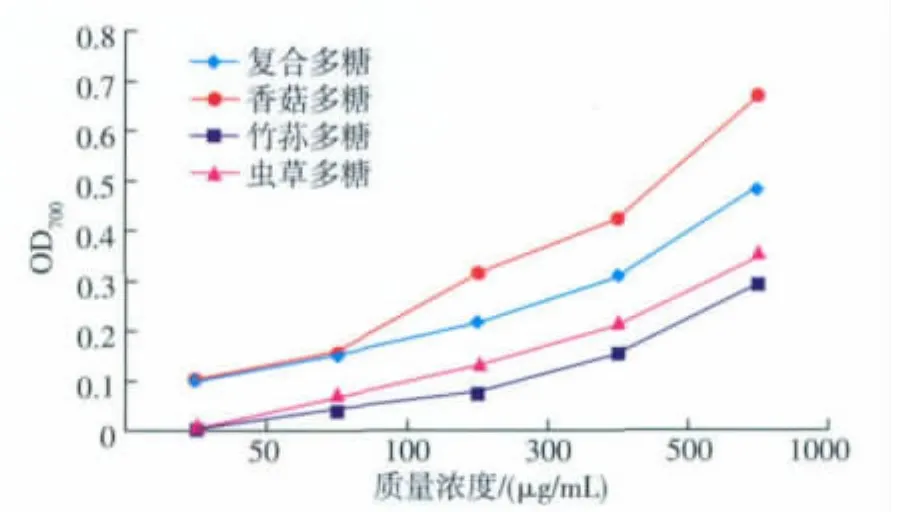
图3 还原力曲线Fig.3 Curve of reducing power
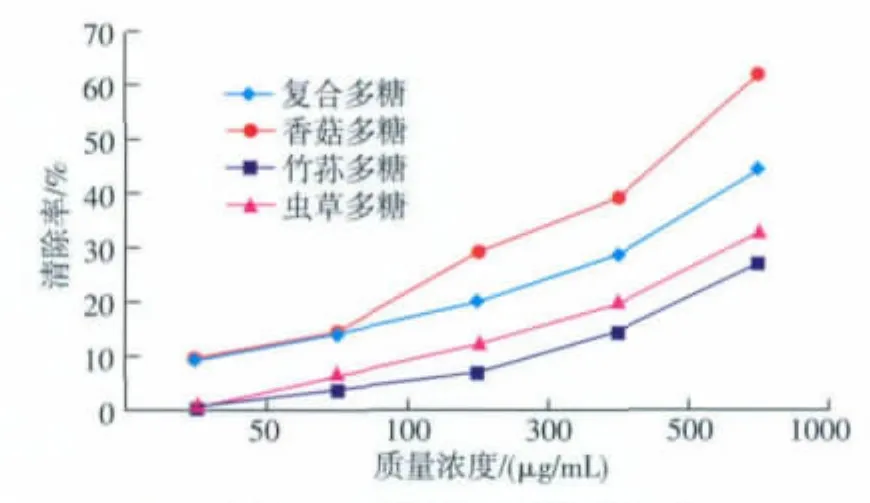
图4 真菌多糖对羟自由基的清除能力Fig.4 Effects of polysaccharides on scavenging·OH
2.5 对DPPH自由基清除能力的测定
DPPH自由基是一种稳定的自由基,在可见光区517 nm处有最大吸收峰,抗氧化剂与DPPH·反应,DPPH溶液变色的程度反映了提取物的清除能力。这一反应已被广泛用于测试化合物自由基清除能力和评价食品、植物提取物的抗氧化活性。
由图5可看出,随着多糖质量浓度的增加,只有香菇多糖对DPPH自由基清除能力呈现出逐渐增长的趋势。当多糖质量浓度为50~300 μg/mL范围内,虫草多糖对DPPH自由基清除能力几乎未发生改变,竹荪多糖的清除能力出现降低趋势,但小于复合多糖以及香菇多糖的清除能力;当多糖质量浓度为500、1 000 μg/mL时,复合多糖、虫草多糖以及竹荪多糖DPPH自由基清除能力逐渐上升,并在多糖质量浓度为1 000 μg/mL时达到最大,复合多糖对DPPH自由基的清除率为12.09%,虫草多糖为6.04%,竹荪多糖为4.95%,远远小于香菇多糖的49.95%。
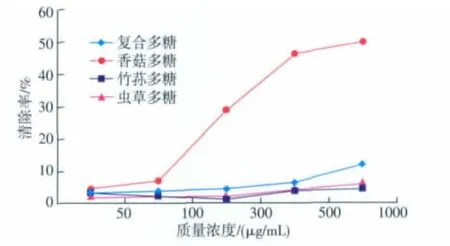
图5 真菌多糖对DPPH自由基的清除能力Fig.5 Effects of polysaccharides on scavenging DPPH·
3 结语
各真菌多糖抗氧化活性在实验浓度范围内均随着多糖质量浓度的增加显示出稳定的增长,且从保健口服液中提取出来并纯化后的真菌复合多糖的抗氧化活性高于竹荪多糖及虫草多糖,但较香菇多糖的活性低或相当。从抗氧化活性来讲,该保健口服液中含有的真菌复合多糖比单一使用竹荪或者虫草菌粉为原料的活性高,比公认高活性的香菇多糖低,但是以香菇为单一原料制作口服液的成本较高,因此,同时考虑活性和成本时,该保健口服液具有更高的抗氧化活性。
[1]DUAN Xiao-juan,ZHANG Wei-wei,LI Xiao-ming,et al.Evaluation of antioxidant property of extract and fractions obtained from a red alga Polysiphoniaurceolata[J].Food Chemistry,2006,95:37-43.
[2]KONG Fan-li,ZHANG Ming-wei,LIAO Sen-tai,et al.Antioxidant activity of polysaccharide-enriched fractions extracted from pulp tissue of Litchi Chinensis Sonn[J].Molecules,2010,15:2152-2165.
[3]Grice H C.Safety evaluation of butylatedhydroxyanisole from the perspective of effects on fore stomach and oesophageal squamous epithelium[J].Food Chemistry Toxicology,1988,26:717-723.
[4]张唐伟,杨乐,刘青海,等.地木耳多糖的抗氧化性与抑菌作用[J].食品与生物技术学报,2011,30(6):868-873.ZHANG Tang-wei,YANG Le,LIU Qing-hai,et al.Antioxidant and antimicrobial activities of nostoc commune polysaccharide[J].Journal of Food Science and Biotechnology,2011,30(6):868-873.(in Chinese)
[5]MAU Jeng-leun,LIN Hsiu-ching,SONG Si-fu.Antioxidant properties of several specialty mushrooms[J].Food Research International,2002,35:519-526.
[6]储鸿,程珊,倪忠斌,等.白芷活性提取物清除自由基与抗氧化作用[J].食品与生物技术学报,2009,28(2):201-205.CHU Hong,CHENG Shan,NI Zhong-bin,et al.Study on scavenging free radical and antioxidation effects of extracts from angelica dahuica[J].Journal of Food Science and Biotechnology,2009,28(2):201-205.(in Chinese)
[7]HU Xu-qiao,HUANG Yuan-yuan,DONG Quan-feng,et al.Structure characterization and antioxidant activity of a novel polysaccharide isolated from pulp tissues of Litchi chinensis[J].Journal of Agriculture and Food Chemistry,2011,59:11548-11552.
[8]TSENG Yu-hsiu,YANG Joan-wah,MAU Jeng-leun.Antioxidant properties of polysaccharides from Ganodermatsμgae[J].Food Chemistry,2008,107:732-738.
[9]YUAN Jiang-feng,ZHANG Zhi-qi,FAN Zhi-chao,et al.Antioxidant effects and cytotoxicity of three purified polysaccharides from LigusticumchuanxiongHort[J].Carbohydrate Polymers,2008,74:822-827.
[10]WANG Jia-tang,DENG Chao,CHEN Jing-hua,et al.Structural characterization,chain conformation,and morphology of a β-(1→3)-d-glucanisolated from the fruit body of Dictyophoraindusiata[J].Journal of Agriculture and Food Chemistry,2009,57:5918-5924.
[11]XU Xiao-juan,WANG Xiao-hua,Zhang Li-na.Renaturation of triple helical polysaccharide lentinan in water-diluted dimethylsulfoxidesolution[J].Carbohydrate Research,2010,345:419-424.
[12]ZHANG An-qiang,XIAO Nan-nan,HE Peng-fei,et al.Chemical analysis and antioxidant activity in vitro of polysaccharides extracted from Boletus edulis[J].International Journal of Biological Macromolecules,2011,49:1092-1095.
[13]颜军,苟小军,邹全付,等.分光光度法测定Fenton反应产生的羟基自由基[J].成都大学学报:自然科学版,2009,28(2):91-93.YAN Jun,GOU Xiao-jun,ZOU Quan-fu,et al.Determination of hydroxyl radical in Fenton reaction by sepectrophotometry[J].Journal of Chengdu University:Natural Science Edition,2009,28(2):91-93.(in Chinese)
[14]Braca A,De-Tommasi N,Di-Bari L,et al.Antioxidant principles from Bauhinia terapotensis[J].The Journal of Natural Products,2001,64(7):892-895.
[15]ZOU Chang,DU Yu-min,LI Yan,et al.Preparation of lacquer polysaccharide sulfates and their antioxidant activity in vitro[J].Carbohydrate Polymers,2008,73(2):322-331.
[16]Nichola S,Quinton J C.Hydroxyl radical scavenging activity of compatible solutes [J].Phytochemistry,1989,28 (4):1057-1060.
