不同宿主来源的α-环糊精葡萄糖基转移酶分离纯化及化学修饰提高其热稳定性
2013-02-19郑贤良
吴 丹, 郑贤良, 吴 敬
(食品科学与技术国家重点实验室,江南大学,江苏 无锡 214122)
环糊精葡萄糖基转移酶或称环状淀粉转移酶(Cyclodextrin Glycosyltransferas, 简 称 CGT 酶 ,EC2.4.1.19)是α-淀粉酶家族(家族13)中的重要成员,CGT酶是一种复合型的多功能酶,能催化4种不同的反应:环化反应、偶合反应和歧化反应3种转糖基化反应以及水解反应[1]。环化反应是CGT酶所催化的特征性反应,是将从底物中酶解下来的低聚糖链自身首尾相连形成环糊精,环化反应是其工业应用的基础[2]。
环糊精(Cyclodextrin,CD)是由环糊精葡萄糖基转移酶通过环化反应将D-吡喃型葡萄糖单元以α-1,4-糖苷键连接而形成[2]。目前工业应用中最常见的环糊精为由6、7、8个葡萄糖单元构成的α-、β-、γ-环糊精。由于环糊精具有表面分布着众多反应性羟基的外部亲水结构,同时具有一个内部疏水性很强的疏水内腔,使其具有与表面活性剂相似的性质,在与许多种客体物质通过分子间相互可起到乳化剂的作用,形成主-客体包合物,比如无机分子、有机分子、络合物甚至惰性气体等,从而对客体物质具有活性保护、控制缓释、包埋等功能;同时,利用环糊精空腔与客体分子大小的匹配性,也可以用于多种异构体分子的识别,制备大分子层析材料等。目前环糊精已经广泛应用于食品、医药、化妆品、农业、生物技术和分析化学等领域[3-4]。
在环糊精的酶法合成中,酶与底物的反应温度一般是50~60℃,这就要求酶在50℃左右仍具有良好的稳定性。关于CGT酶热稳定性研究方面,国内西北大学郭燕等[5]通过海藻酸钠固定化CGT酶,对其稳定性进行了系统分析;田晖等通过在壳聚糖上对CGT酶进行固定化,使其热稳定性和pH稳定性均有所提高[6]。自20世纪70年代末以来,有关用有机物进行蛋白质化学修饰的研究报道越来越多,化学修饰法也日益成为提高酶的稳定性的重要手段[7-8]。通过化学试剂特异性修饰酶分子的某个或某类氨基酸,可稳定蛋白质的构象,从而提高其耐热性或其稳定性。在天然酶分子上接一些化学基团,可以得到多种多样的修饰酶,只要选择合适的修饰剂,利用化学修饰法可快速、廉价地提高酶的稳定性,甚至可合成新的酶种。
枯草芽孢杆菌是食品上允许使用的微生物,而大肠杆菌BL21(DE3)在诱导表达下具有很强的分泌表达能力[9-10],本课题研究中采用了来源于野生型、枯草芽孢杆菌和大肠杆菌的3种不同宿主的α-CGT酶,进行分离纯化得到纯酶后再分析其热稳定性的基础上,研究采用戊二醛交联的化学修饰对热稳定性和酶活力造成的影响,以便为更好地工业化利用CGTase提供应用基础。
1 材料与方法
1.1 材料
1.1.1 菌株 表达α-CGT酶地野生型菌株P aenibacillus macerans、重组型菌株Bacillus subtilis WB600/pGJ103-CGT 和 Escherichia coli BL21(DE3)/pET-20b(+)-cgt均由作者所在实验室保藏和构建。
1.1.2 试剂 胰蛋白胨和酵母粉,购自Oxoid公司;标准分子量蛋白及SDS-PAGE试剂盒,购自碧云天生物技术研究所;其它试剂均为国产分析纯。阴离子交换色谱填料Q-Sepharose和疏水色谱填料phenyl-Superose(HR10/10),购自美国 Amersham 公司。
1.1.3 仪器 紫外可见光分光光度计,日本Shimadzu公司产品;冷冻立式离心机(CF16RX),日本Hitachi公司产品;空气恒温摇床,上海精密仪器仪表有限公司产品;低压层析系统及离子交换柱,上海层析设备厂产品;中空纤维膜超滤设备,AKTA蛋白纯化系统,均为GE healthcare产品。
1.2 实验方法
1.2.1 α-CGT酶粗酶液的制备 摇瓶发酵来源于P.macerans,E.coli和 B.subtilis的 α-CGT 酶,将发酵液于4℃12 000 r/min离心20 min除菌体,收集培养物上清液。
1.2.2 蛋白质浓度的测定 采用Bradford法测定蛋白质浓度[11],使用牛血清蛋白作为标准品。
1.2.3 α-CGT酶环化活力的测定 用甲基橙法测α-CGT酶的环化活力:将发酵液在4℃,12 000 r/min离心20 min,收集上清液。发酵上清液经适当稀释后取100 μL加入装有900 μL底物的5 mL的离心管中,底物为50 mmol/L pH 6.0的磷酸钠缓冲液配制的1 g/dL可溶性淀粉溶液,在40℃水浴保温反应10 min,加入1 mL 1 mol/L的盐酸终止反应,再加入磷酸钠缓冲液配制的0.1 mmol/L甲基橙染色,于20℃保温20 min,在505 nm测定吸光度。一个酶活单位(U)定义为在上述条件下每分钟生成1 μmol的α-环糊精所需的酶量。
1.2.4 α-CGT酶的纯化 采用AKTA蛋白纯化系统对重组蛋白进行纯化,整个纯化过程控制温度为4℃。离心收集含有重组α-CGT酶的发酵上清液,缓慢溶解加入终质量分数为70%的(NH4)2SO4沉淀蛋白质,4℃放置过夜,离心收集沉淀。用20 mmol/L Tris-HCl(pH 7.5)缓冲液复溶沉淀后,在20 mmol/L Tris-HCl(pH 7.5)缓冲液中透析过夜,期间更换2~3次透析缓冲液。
装柱,用10倍柱体积的20 mmol/L Tris-HCl(pH 7.5)缓冲液平衡阴离子交换柱Q-Sepharose;上样,先用0.45 μm的微孔滤膜过滤样品,将10 mL酶液用自动进样器上样,保持体积流量为1 mL/min;洗脱,用平衡缓冲液将未吸附到柱体上的蛋白质洗下来,洗脱体积为4~5个柱体积;吸附到柱上的蛋白质用含 0~1 mol/L KCl的 20 mmol/L Tris-HCl(pH 7.5)缓冲液梯度洗脱,体积流量1 mL/min;收集目的蛋白质。
含α-CGT酶的组分在20 mmol/L Tris-HCl(pH 7.5)缓冲液中透析过夜,缓慢加入终质量分数为 20%的固体(NH4)2SO4,用 10倍柱体积的内含质量分数 20%(NH4)2SO4的 20 mmol/L Tris-HCl(pH 7.5)缓冲液平衡疏水柱phenyl-Superose(HR10/10);1 mL/min上样;吸附到柱上的蛋白质用质量分数 20%~0 的(NH4)2SO4的 20 mmol/L Tris-HCl(pH 7.5)缓冲液反向梯度洗脱,体积流量1 mL/min。
含α-CGT酶的组分在50 mmol/L pH 6.0的磷酸钠缓冲液中透析过夜(4℃),纯化的重组α-CGT酶置于-80℃保存。
1.2.5 不同来源的纯化α-CGT酶热稳定性比较将蛋白质含量为0.4 mg/mL、pH为6.0的纯化源于P.macerans,E.coli和 B.subtilis的 α-CGT 酶,置于50℃水浴30 min,每隔5 min取样一次,测其残酶活,比较其稳定性。
1.2.6 α-CGT酶的化学修饰 将纯化的E.coli α-CGT酶用终质量分数为0.5%和1%的戊二醛进行交联,向4 mL蛋白质含量为0.4 mg/mL的α-CGT酶液中加入质量分数25%的戊二醛,其终质量分数分别为0.5%和1%,在4℃交联1 h,然后将交联后的α-CGT酶在50 mmol/L pH 6.0的磷酸钠缓冲液中透析过夜(4℃),去掉残余的戊二醛,SDS-PAGE验证其交联度,50℃水浴30 min,每隔5 min取样一次,测其残酶活,比较其稳定性。
α-CGT酶粗酶制剂的交联方法:先将粗酶液用终质量分数为70%的(NH4)2SO4沉淀蛋白质,4℃放置过夜,离心收集沉淀。然后加入质量分数为1%的戊二醛,对其进行交联,将交联后的α-CGT酶在50 mmol/L pH 6.0的磷酸钠缓冲液中透析过夜(4℃),去掉残余的戊二醛,50℃水浴30 min,测其稳定性。
2 结果与分析
2.1 不同来源的α-CGT酶的纯化
作者所研究的α-CGT酶由野生型和两种重组型的宿主分别表达,由于不同的宿主之间的生理代谢、蛋白质合成及修饰、蛋白质转运过程各自不同,因此有可能导致所表达的酶的性质也有所不同。为了分析3种不同来源的α-CGT酶的性质,首先对其进行了分离纯化研究。将E.coli,B.subtilis和P.macerans 3种来源的发酵上清液通过盐析、QSepharose阴离子交换色谱和phenyl-Superose(HR10/10)疏水色谱纯化α-CGT酶。纯化结果见表1,纯化后的蛋白质电泳图见图1。
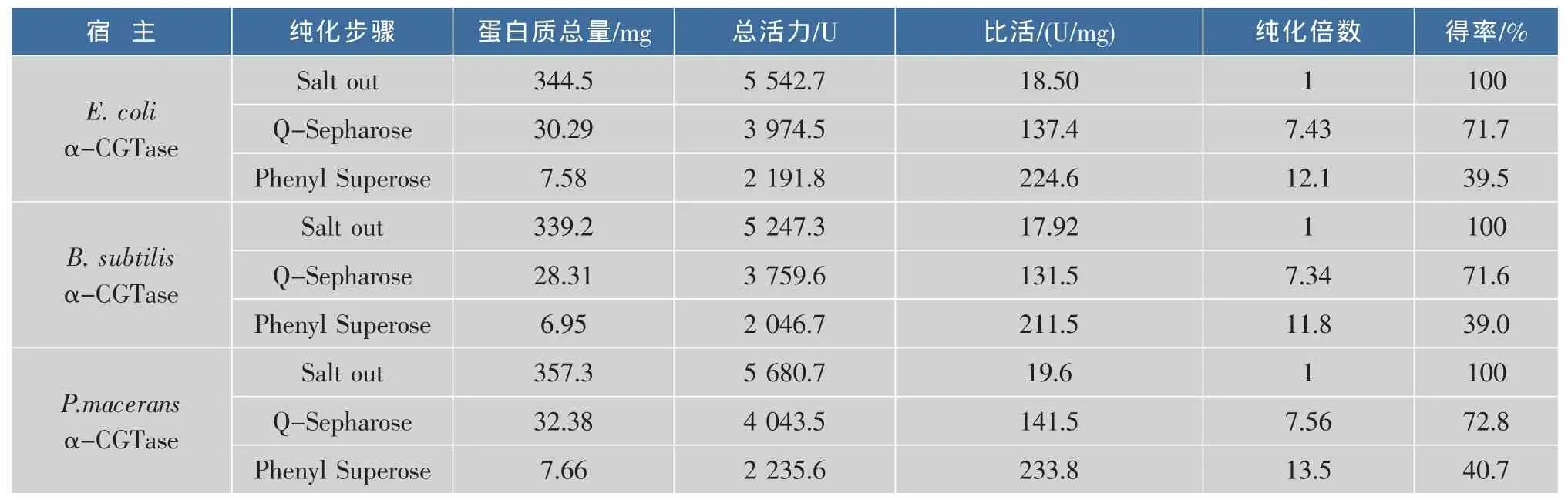
表1 α-CGT酶的纯化工艺Table 1 Purification scheme for α-CGTase
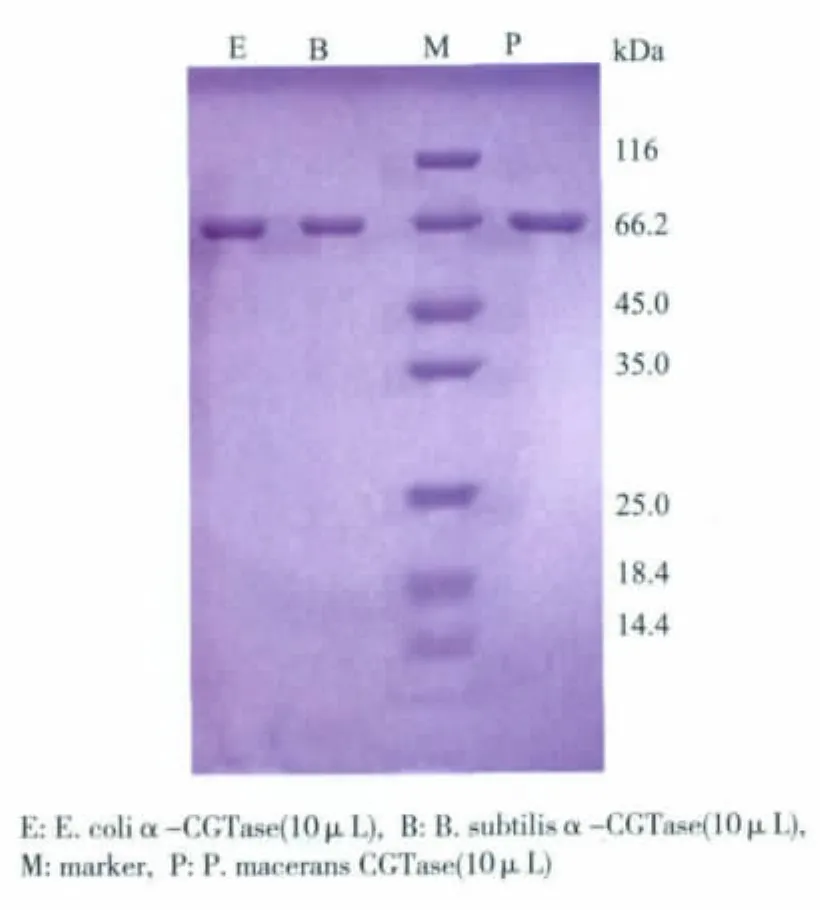
图1 纯化的α-CGT酶的SDS-PAGEFig.1 SDS-PAGE analysis of the purification of α-CGTase
从表1可见,3种来源的α-CGT酶均得到了相对较高的回收率,SDS-PAGE证明了纯化后酶蛋白的均一性,3种来源的α-CGT酶的比活相似,分别为 224.6 U/mg,211.5 U/mg和 233.8 U/mg。由此认为另外两种宿主 E.coli,B.subtilis重组表达的 α-CGT酶的催化活性没有受到宿主本身的影响。
2.2 不同来源的纯化α-CGT酶的热稳定性比较
将纯化后的来源于 E.coli,B.subtilis和 P.macerans的α-CGT酶分别在50℃水浴30 min,每隔5 min取样一次,测定其残酶活,结果如图2所示。
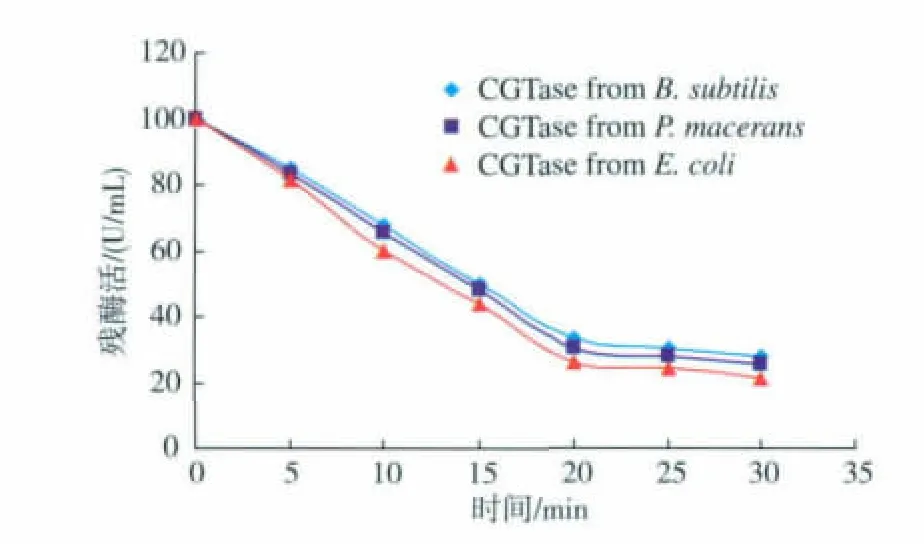
图2 3种不同来源的纯化α-CGT酶热稳定性比较Fig.2 Thermal stability of purified E.coli,B.subtilis and P.macerans α-CGTase culture supernatant
由图 2可见,纯化后的来源于 E.coli,B.subtilis和P.macerans的α-CGT酶的热稳定性稍有差别,50℃水浴30 min后,来源于E.coli的α-CGT酶还有21%的残酶活,来源于B.subtilis的α-CGT酶还有28%的残酶活,来源于P.macerans的α-CGT酶还有25%的残酶活。因此来源于B.subtilis的热稳定性较好,但差别不显著。Jeang等[12]的研究认为可能是不同菌种周质空间中决定酶折叠的催化蛋白质种类不同造成了酶结构的细微差别,最终导致其稳定性的差异;Wulfing等[13]的研究也认为,蛋白质在周质空间中折叠获得独特的构象是由细胞的独特生理环境所决定的,不同来源的同种蛋白质构象的差异或许可以反映不同细菌其细胞内环境的差异。但是,可以看出3种来源的α-CGT酶稳定性均不是很好,不能满足工业化生产要求。考虑到E.coli的发酵产量远远高于B.subtilis和P.macerans,因此下面的研究采用E.coli发酵所产的α-CGT酶进行。
2.3 化学修饰对重组α-CGT酶稳定性的影响
在蛋白质的化学修饰中,交联酶聚集体技术[14]是一种新型化学修饰方法,近几年被划分到无载体固定化酶范畴,是采用物理方法使酶分子聚集,再经交联剂交联而成。常用的交联剂是戊二醛,其作用机理目前还未有准确合理的解释,但其对酶的交联效果已有报道,Yamazaki等[15]对葡萄糖脱氢酶进行交联,发现经戊二醛交联后可获得耐热性较好的交联酶聚集体。因此作者拟研究液体纯化α-CGT酶的戊二醛交联以提高其稳定性。
重组酶的化学修饰具体方法如材料与方法中所述。用终质量分数为1%的戊二醛对α-CGT酶进行交联,4℃反应1 h,用pH 6,50 mmol/L的磷酸盐缓冲液透析过夜,除去残留的戊二醛,并用SDSPAGE检验交联效果,见图3。结果显示,大部分α-CGT酶被成功交联成大分子,并聚集在SDS-PAGE的顶端。
对其热稳定性进行分析,将交联与未交联的α-CGT酶置于50℃水浴30 min,结果如图4所示。可知,α-CGT酶交联后相比于未交联的α-CGT酶在50℃其热稳定性有所提高。交联酶置于50℃水浴30 min后,仍有78%的酶活,而未交联的α-CGT酶仅剩20%的残酶活。但该过程存在一个缺点,就是交联后的α-CGT酶其酶活损失过大,交联后的α-CGT酶与原酶液相比,仅剩20%的残酶活。有可能是戊二醛浓度过高,导致酶失活,因此考虑降低戊二醛的浓度,研究α-CGT酶的交联。
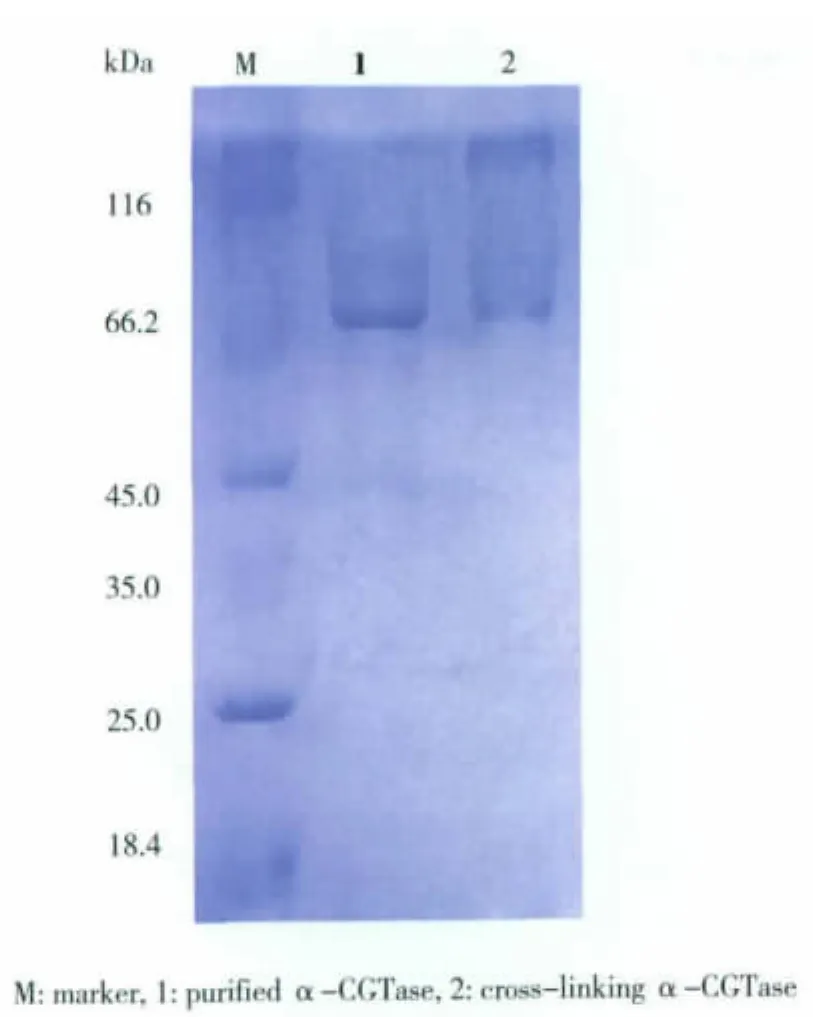
图3 戊二醛(1%)交联α-CGT酶的SDS-PAGEFig.3 SDS-PAGE analysis of cross-linking α-CGTase
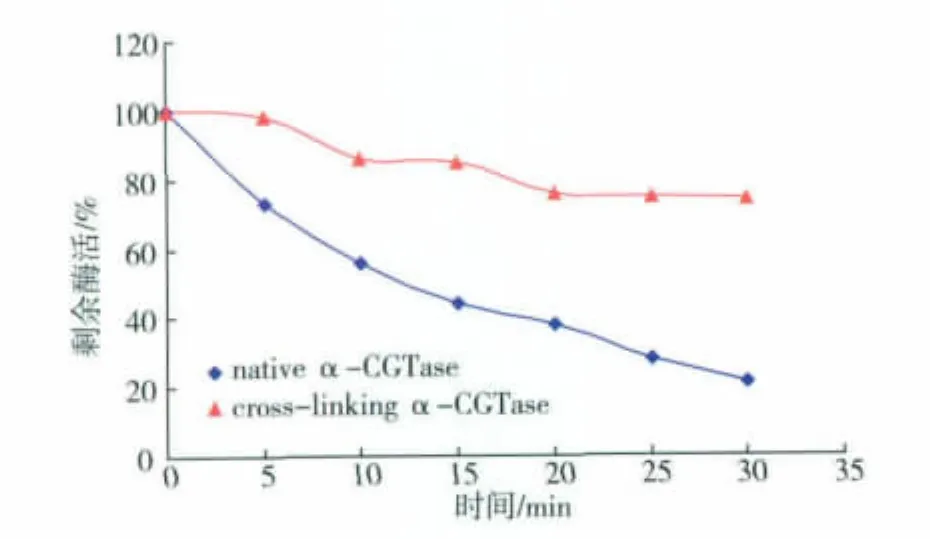
图4 戊二醛(1%)交联α-CGT酶与重组α-CGT酶的热稳定性Fig.4 Thermal stability of cross-linking α-CGTase and recombinant α-CGTase
采用终质量分数为0.5%的戊二醛对纯化α-CGT酶进行交联,方法同质量分数1%的戊二醛交联方法,SDS-PAGE检测交联效果,如图5所示。可见,质量分数为0.5%的戊二醛交联效果与质量分数为1%的戊二醛交联效果差不多,大部分α-CGT酶被成功交联成大分子,聚集在SDS-PAGE的顶端,但仍有部分游离的α-CGT酶。
将交联与未交联的α-CGT酶置于50℃水浴30 min,结果如图6所示。可知,用终质量分数为0.5%的戊二醛对α-CGT酶交联后与用终质量分数为1%戊二醛交联的α-CGT酶在50℃的热稳定性基本一致,与未交联的α-CGT酶相比明显提高。交联后的α-CGT酶还有50%的酶活,与用终质量分数1%的戊二醛交联相比其酶活保留率有所提高,仍然存在交联过程中酶活损失过大的问题,但可以肯定的是α-CGT酶的戊二醛交联能够明显提高其热稳定性。作者还继续进行了质量分数0.25%戊二醛来交联α-CGT酶的稳定性研究实验,但是由于0.25%质量分数的戊二醛交联效果较差,导致交联前后α-CGT酶的稳定性几乎没有变化。
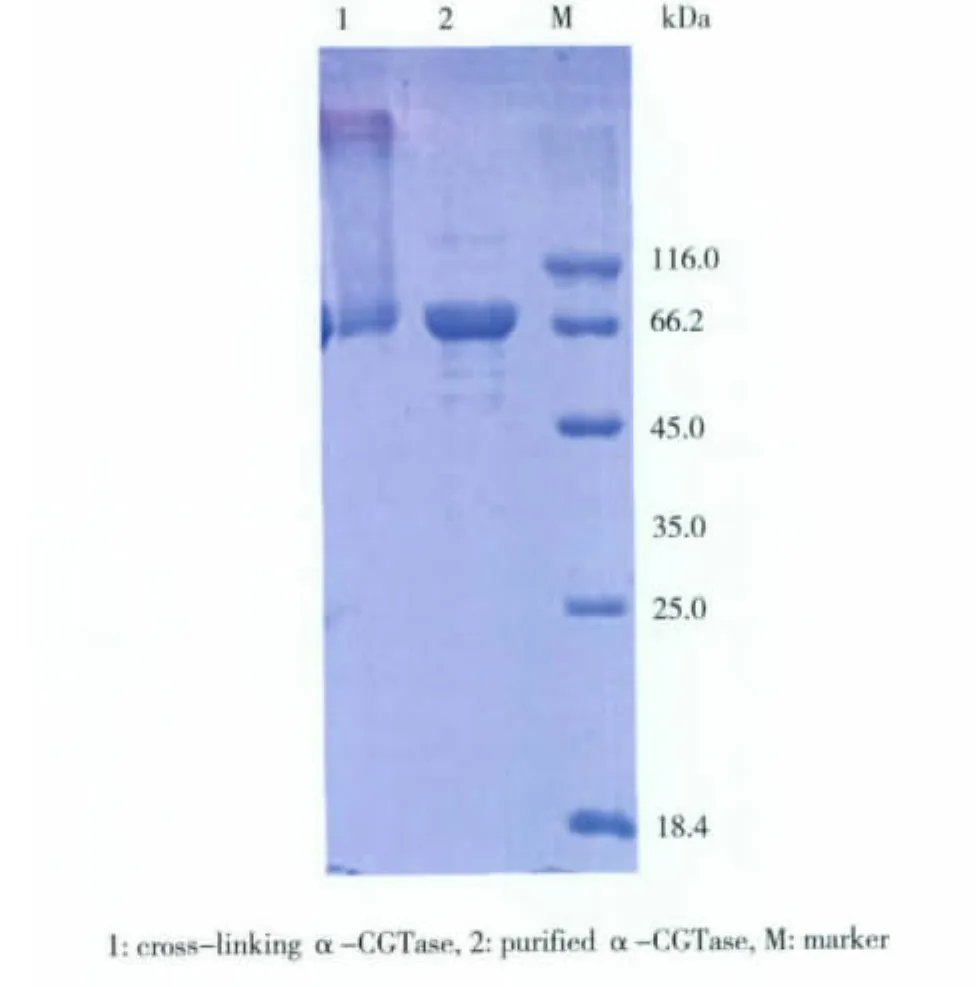
图5 戊二醛(0.5%)交联α-CGT酶的SDS-PAGEFig.5 SDS-PAGE analysis of cross-linking α-CGTase
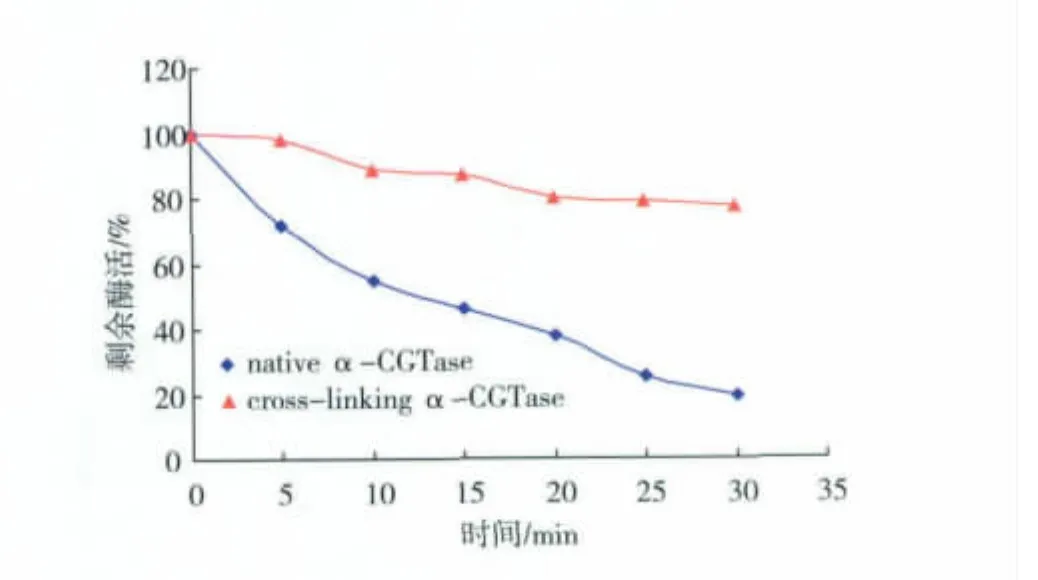
图6 戊二醛(0.5%)交联α-CGT酶与重组α-CGT酶的热稳定性Fig.6 Thermal stability of cross-linking α-CGTase and recombinant α-CGTase
3 结语
作者在实验室前期工作实现了α-CGT酶高效表达的基础上,针对重组酶存在的稳定性问题开展研究。发现3种不同来源的α-CGT酶的酶活和热稳定性差别不大,对E.coli重组表达的α-CGT酶首次采用戊二醛进行交联修饰,将α-CGT酶交联成大分子后,50℃水浴30 min仍有78%的酶活,而未交联的α-CGT酶仅剩20%的残酶活,交联后酶活保有率提高了2.9倍。虽然由于交联的无序性,导致较多的酶活性中心可能受到修饰而降低了酶活力,但是化学修饰却可以明显提高酶的热稳定性,为下一步大规模开发α-CGT酶工业应用奠定了良好的基础。此外,为了更精确地控制生物催化剂的性能,仍然需要开发更加特异性的修饰方法。如建立在准确了解蛋白质的结构和功能关系上的酶的化学修饰法与基因工程技术相结合的酶的定向修饰技术,或许是值得尝试的方法之一。
[1]van der Veen B A,van Alebeek G J,Uitdehaag J C,et al.The three transglycosylation reactions catalyzed by cyclodextrin glycosyltransferase from Bacillus circulans (strain 251) proceed via different kinetic mechanisms[J].European Journal of Biochemistry,2000,267(3):658-665.
[2]金征宇,徐学明,陈寒青,等.环糊精化学-制备与应用[M].北京:化学工业出版社,2005:1-35.
[3]Li Z F,Wang M,Wang F,et al.α-Cyclodextrin:a review on enzymatic production and applications[J].Applied Microbiology and Biotechnology,2007,77:245-255.
[4]Szente L,Szejtli J.Cyclodextrins as food ingredients[J].Trends in Food Science&Technology,2004,15(3-4):137-142.
[5]郭燕,王卫卫,郭利伟,等.海藻酸钠固定化环糊精葡萄糖基转移酶的研究[J].食品与发酵工业,2007,33(9):33-36.GUO Yan,WANG Wei-wei,GUO Li-wei,et al.Immobilization of cyclodextrin glycosyl transferase in sodium alginate[J].Food and Fermentation Industry,2007,33(9):33-36.(in Chinese)
[6]田晖,谢伯泰,孙连魁,等.环糊精葡萄糖基转移酶在壳聚糖上的固定化[J].西北大学学报,1995,25(3):223-226.TIAN Hui,XIE Bo-tai,SUN Lian-kui,et al.Immobilization of cyclodextrin glucanotransferase on chitosan[J].Northwest University Acta,1995,25(3):223-226.(in Chinese)
[7]Gómez L,Villalonga R.Functional stabilization of invertase by covalent modification with pectin[J].Biotechnology Letter,2000,22:1191-1195.
[8]张继娟,吴梧桐.聚乙二醇(PEG25000)对胰激肽释放酶化学修饰的初步研究[J].药物生物技术,2006,13(6):409-412.ZHANG Ji-juan,WU Wu-tong.Primary study on the modification of porcine pancreas kallikrein with PEG-5000[J].Pharmaceutical Biotechnology,2006,13(6):409-412.(in Chinese)
[9]丁岚,侯晓彦,王小红,等.乳糖诱导葡萄球菌肠毒素A基因在大肠杆菌中的表达[J].食品与生物技术学报,2011,30(2):255-261.DING Luan,HOU Xiao-yan,WANG Xiao-hong,et al.Lactose-induced expression of Staphylococcus aureus enterotoxin A in Escherichia coli BL21(DE3)[J].Journal of Food Science and Biotechnology,2011,30(2):255-261.(in Chinese)
[10]陈晓明,陈静,陈寒青,等.Aspergillus ficuum内切菊粉酶基因在大肠杆菌中表达[J].食品与生物技术学报,2011,30(3):388-394.CHEN Xiao-ming,CHEN Jing,CHEN Han-qing,et al.Expression of endo-inulinase gene from Aspergillus ficuum in Escherichia coli[J].Journal of Food Science and Biotechnology,2011,30(3):388-394.(in Chinese)
[11]Li Z F,Zhang J Y,Wang M,et al.Mutations at subsite-3 in cyclodextrin glycosyltransferase from Paenibacillus macerans enhancing-cyclodextrin specificity[J].Applied Microbiology Biotechnology,2009,83:483-490.
[12]Jeang C L,Lin D G,Hsien S H.Characterization of cyclodextrin glycosyltransferase of the same gene expressed from Bacillus macerans,Bacillus subtilis,and Escherichia coli[J].Journal of Agricultural and Food Chemistry,2005,53:6301-6304.
[13]Pluckthun W.Protein folding in the periplasm of Escherichia coli[J].Molecular Microbiology,1994,12:685-692.
[14]武仙山,何立千,叶磊.交联酶聚集体——一种无载体酶固定化方法[J].生物技术,2005,2(15):90-92.WU Xian-shan,HE Li-qian,YE Lei.Cross-linked enzyme aggregates-a way of enzyme immobility without carrier[J].Biotechnology,2005,2(15):90-92.(in Chinese)
[15]Yamazaki T,Tsugawa W,Sode K.Increased thermal stability of glucose dehydrogenase by cross-linking chemical modification[J].Biotechnology Letter,1999,21:199-202.
