原料乳中产耐热蛋白酶细菌的鉴定及其酶学特性研究
2013-05-21母智深
张 熙, 母智深
(1.华南理工大学 生物科学与工程学院,广东 广州510006;2.内蒙古农业大学 食品科学与工程学院,内蒙古呼和浩特010018)
荧光假单胞菌是低温冷藏原料乳中常见的一类细菌[1],其种类繁多,广泛存在于低温环境中。已经了解的嗜冷菌中,细菌就有30多个属,其中属于革兰氏阴性的Pseudomoas属和革兰氏阳性Bacillus属的较多[2]。而原料乳中以兼性嗜冷菌为主,从原料乳中分离到的嗜冷菌以假单胞菌属(Pseudomonas),特别是荧光假单胞菌(P.fluorescens)居多。产生热稳定性蛋白酶和脂肪酶的主要是假单胞菌属[3],这类菌增长速度快,在2℃条件下仍能生长良好[4]。该类细菌其本身不耐热,一般巴氏杀菌条件可以将其杀死,但它们分泌的胞外耐热性蛋白酶可以耐受UHT杀菌条件(140℃,4 s)。该类蛋白酶经常引起UHT乳及其它乳制品在货架期内发生水解、凝块、变苦等品质劣变现象[5]。
研究中从原料乳中分离得到一株产耐热蛋白酶的嗜冷细菌,采用多项鉴定方法对其进行了鉴定。在此基础上研究耐热蛋白酶的部分酶学特性和耐热性。为在乳品工业中如何控制以及耐高温蛋白酶将来利用提供理论依据。
1 材料与方法
1.1 产耐高温蛋白酶菌株分离与筛选
1.1.1 嗜冷菌分离 原料乳取自内蒙古呼和浩特市周边奶站。原料乳用划线法直接涂布于固体培养基[6-7](胰蛋白胨 5 g/L,酵母浸膏 2.5 g/L,葡萄糖 1 g/L,琼脂 20 g/L,pH 7.2),6.5℃条件下恒温培养7 d。挑取单个菌落,观察菌落大小、形状、色泽、色素产生、表面光滑程度、边缘整齐度。选取形态差异的菌落,结合革兰氏染色进行嗜冷菌筛选。平板上划线纯化2~3次后得到纯培养物。
1.1.2 嗜冷菌筛选 将分离纯化的嗜冷菌菌株分别接种于1.0 g/dL的酪蛋白琼脂培养基上置于20℃培养5 d。选择水解圈大而明显的菌株,进一步纯化并保存。将产生水解圈的菌株,接入50 mL上述液体培养基中,20℃,培养48 h,然后取5 mL接种到100 mL相同液体培养基中,于20℃条件下,摇床(120 r/min)培养5 d。将发酵液在15 000 g条件下低温(4℃)离心20 min,上清液即为胞外蛋白酶粗酶液。分别测定上清液酶活和经过95℃,5 min加热后酶的剩余活力。根据上述两项指标选择一株目标菌株。
1.2 形态学和生理生化鉴定
将入选菌株划线于上述固体培养基,在20℃下培养2 d,观察其菌落形态;并在电子显微镜下观察菌株的细胞形态。形态观察、生理生化试验参照《伯杰氏细菌鉴定手册(第九版)》[8]和《工业微生物实验技术手册》[9]。
全细胞脂肪酸分析采用GC-MS[10]。2 000 mL的锥形瓶盛1 000 mL灭菌NB培养液。按体积分数5%接种,20℃摇床(120 r/min)培养36 h。培养菌液于5 000 g离心15 min。弃去上清液。沉淀菌体用超纯水洗涤3次。取出菌体约400 mg(湿重)细胞移入有Teflon盖的试管中。向样品管中加入体积分数15%NaOH-甲醇10 mL,100℃水浴30 min,然后加入体积分数25%HCL-甲醇20 mL,水浴80 ℃,10 min,冷却后分别加入10 mL的水和乙醚提取细胞脂肪酸甲酯(FAMEs),将乙醚提取物用氮气流吹干,加入100 μL正己烷溶解。取2 μL正己烷作GC-MS分析。
1.3 16S及16S-23S rDNA间区的PCR扩增及分析
细菌基因组DNA的提取见参考文献[11]。引物采用革兰氏阴性细菌通用引物,由大连宝生物公司提供,引物序列见表1、表2。

表1 16S rDNA PCR扩增引物Table 1 16S rDNA sequencing primers used in PCR
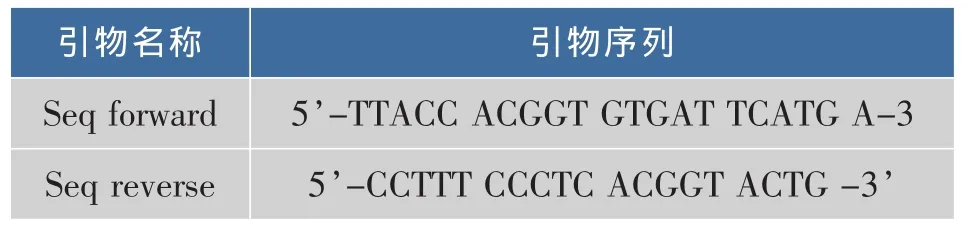
表2 16-23S rRNA扩增引物Table 2 16S-23S rRNA sequencing primers used in PCR
PCR反应见文献[12-14]。将测序结果在NCBI中进行Blast后交送GeneBank数据库,与数据库中已有序列对比,进行系统发育分析。
1.4 蛋白酶催化温度和pH确定及耐热性研究
1.4.1 蛋白酶最适作用温度 将蛋白酶与底物溶液(偶氮酪蛋白)混合,分别置于 20,25,35,40,45℃和50℃下反应2 h,测定蛋白酶活力。
1.4.2 蛋白酶最适作用pH确定 配置pH值范围在4.6到10.6的多种缓冲溶液,pH值间隔为0.5。其中乙酸-乙酸钠缓冲液 pH 4.6~5.8,磷酸二氢钠-磷酸氢二钠缓冲液 pH 6.0~7.0,Tris-HCl缓冲液 pH 7.2~8.8,甘氨酸-氢氧化钠缓冲液 pH 9.0~10.6。 用上述缓冲液分别代替Tris-HCl(pH 7.5)缓冲溶液,测定蛋白酶活力。
1.4.3 酶热稳定性测定 取60 μL酶液,置于4 mm×40 mm密封玻璃管中,用油浴加热。热电偶置于另一玻璃管中,测定酶液加热到指定温度所需的时间。 加热温度分别为 80,90,100,110,120,130 和140℃,酶受热时间4 s。酶液加热结束后,将玻璃管置于20℃水中快速冷却。取热处理后酶液40 μL,测定蛋白酶剩余活力。
1.5 酶活力测定方法
以偶氮酪蛋白(azocasein)为底物,测定蛋白酶水解活性[15]。先将酶溶液,底物,缓冲液在40℃水浴中预热,然后将 1 250 μL 酶溶液(pH 7.5,20 mmol/L Tris-HCl缓冲液稀释)添加到1 750 μL偶氮酪蛋白溶液中(1.5 g/dL),40℃水浴2 h后,加入 3 000 μL 10 g/dL三氯醋酸中止反应。混合物立即在4℃下离心(10 000 g,10 min),取 2 400 μL 上清液,用600 μL 1.8 mol/L NaOH溶液中和,在420 nm处测定其吸光度值。1个酶活力单位(unit)定义为:在上述实验条件下,2 h内,每毫升酶液,每增加0.01个OD420nm定义为1个酶活力单位。酶活力计算公式为:酶活(U/mL)=OD420nm×100×K/V。 其中 U 为酶活力单位,OD420nm为420 nm下酶的吸光度值,K为酶的稀释倍数,V为酶液量。
1.6 数据统计
采用软件SSPS12.5进行数据分析,所有数据来自最少3个独立实验,并各重复3次。
2 结果
2.1 形态学鉴定
在培养基上,被选菌株菌落呈现淡白色圆形,表面光滑,边缘整齐。从透射电镜的照片(图1,图2)可以看出,该菌株为杆菌,大小为0.6 μm×2.0 μm,无菌柄也无鞘,不产芽孢,有鞭毛,且鞭毛数大于1。依菌株的菌落形态和细胞形态,可以初步判定该菌归属于荧光假单胞菌,并编号Rm12。
2.2 生理生化鉴定
生理生化特征鉴定见表3。该菌为革兰氏阴性细菌,产荧光色素,不产非荧光色素,产果聚糖,反硝化实验阴性,卵磷脂酶,脂酶阳性,能在4℃下生长,41℃不生长。其大部分生理生化特性与荧光假单胞菌(P.fluorescens)最为接近。
菌株Rm12的细胞脂肪酸(CFAs)分析结果见表4。其中具有鉴别意义的脂肪酸分别是3-羟基癸酸(C10:0)、2-羟基月桂酸(C12:0)、3-羟基月桂酸(C12:0)、肉豆寇酸(C14:0)、棕榈油酸(C16:1)、反式棕榈油酸(C16:1)、棕榈酸(Cl6:0)、油酸(C18:1)、反油酸(C18:1)和 硬脂酸(C18:0)。Rm12不仅含有假单胞菌所共有的饱和脂肪酸 C16:0,及不饱和脂肪酸 C16:1及 C18:1,同时也含有被认定假单胞杆菌的特征脂肪酸的 C10:03OH和 C12:03OH。

图1 菌株Rm12的电镜扫描图片Fig.1 TEM micrograph of Rm12 cell
2.3 分子鉴定
2.3.1 16S鉴定结果
用革兰氏阴性细菌通用引物扩增菌株Rm12的16S rDNA基因,获得1 455 bp的片段,并测序。采用NCBI网站中的Blast工具,将菌株Rm12的16S rDNA基因序列与GenBank中查得的相关序列进行比较,得到与其序列同源性较高的相关菌株的16S rDNA序列,采用CLUSTALX 1.8软件对所测定的核苷酸序列进行排列,用系统发育推断软件包PHYLIP 3.5 c中的距离依靠法构建系统发育树。结果表明,Rm12菌株与假单胞菌属(Pseudomonas)一些种的序列同源性高。与AM410618,DQ279328,DQ279327的最大相似度高达100%。与AY747594,AM411619,DQ219372,DQ200857,DQ314540,DQ31 4541,DQ200851,DQ314546 的相似度高达 99%,除AY747594被鉴定为P.reactans,其它菌株均被鉴定为假单胞杆菌的变种。因此,从分子分类学的角度来看Rm12菌株属于假单胞菌属的菌种。
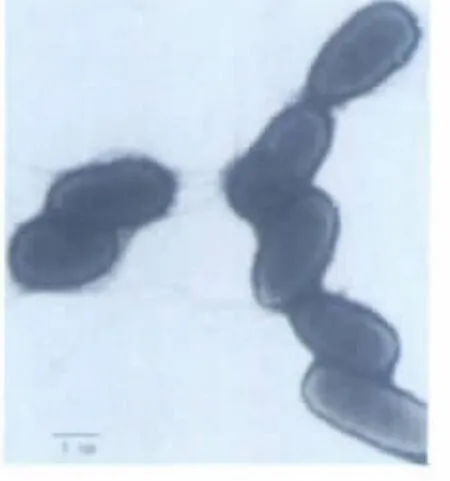
图2 菌株Rm12多个菌体电镜扫描图片Fig.2 TEM micrograph of Rm12 cells
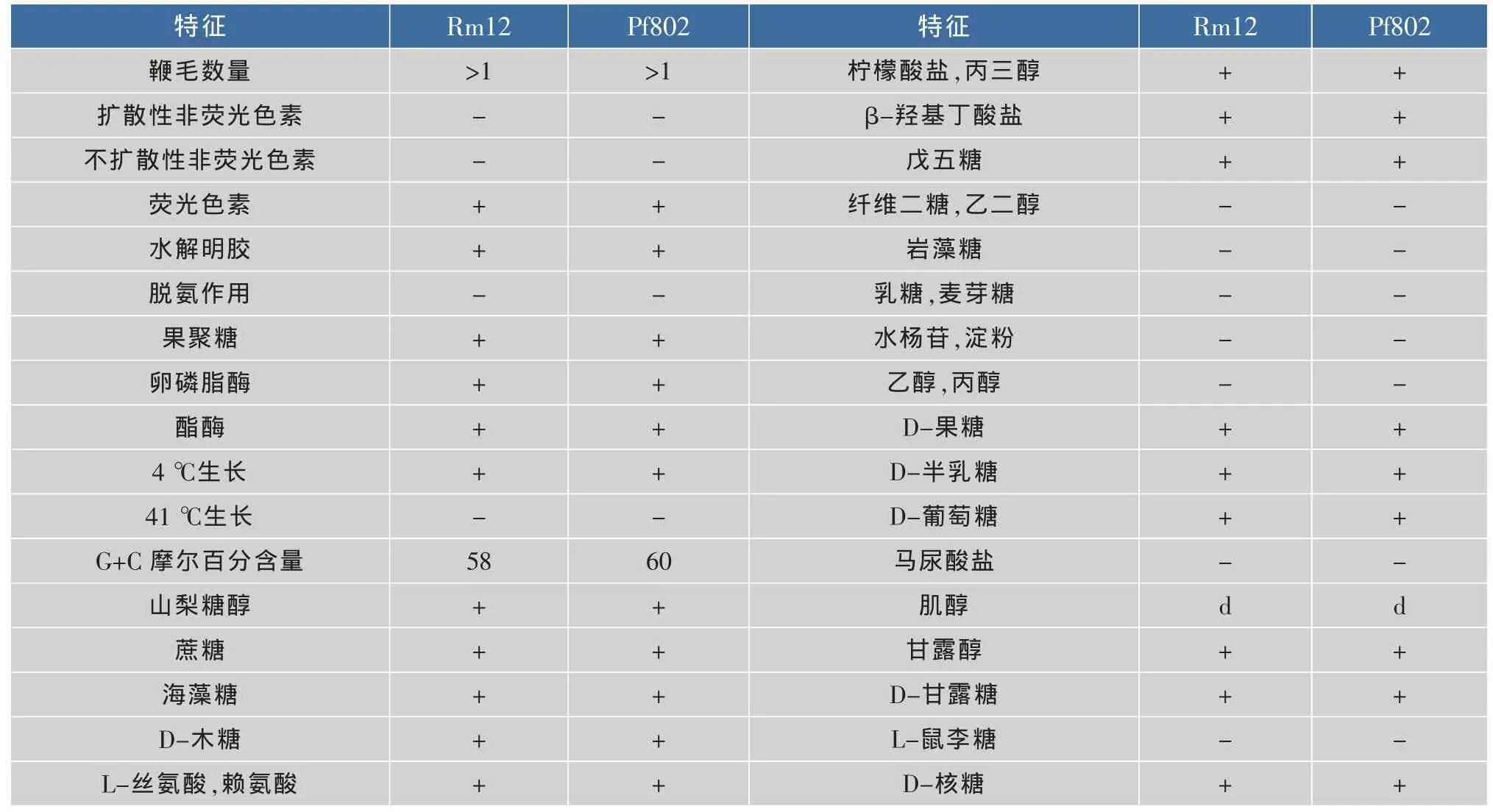
表3 Rm12菌株的生理生化特征Table 3 Physiological and biochemical character of Rm12
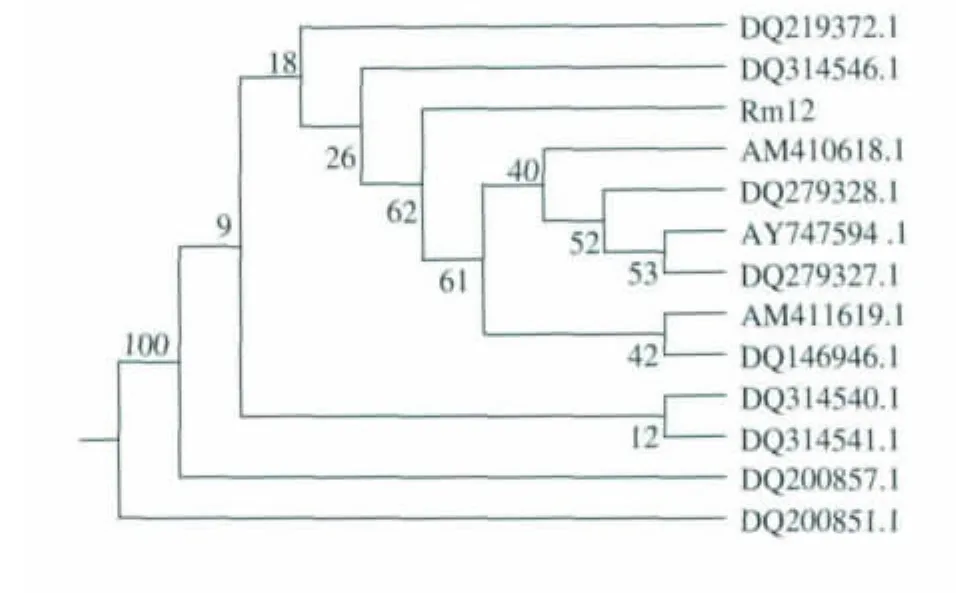
图3 根据16S rDNA序列建立的系统发育树Fig.3 Phylogenetic tree of Rm12 based on 16s rDNA
2.3.2 16-23S rRNA间区鉴定结果 通过对Rm12菌株的16S-23S rRNA间区序列测定,获得1056 bp基因片段。将菌株Rm12的16S-23S rRNA间区序列与GenBank中查得的相关序列进行比较。结果是,Rm12菌株与假单胞菌属(Pseudomonas)中的荧光假单胞杆菌(P.fluorescens)的一些菌株的序列同源性较 高 。 该 菌 株 与 AF127587.1,AF127586.1,AF127585.1的最大相似度高达100%,与AY582369.1,AY582380.1,AY582371.1 的相似度也高达99%,与其它菌株的最大相似度均达到了95%以上。因此,从分子分类学的角度进一步确定Rm12菌株属于荧光假单胞杆菌。
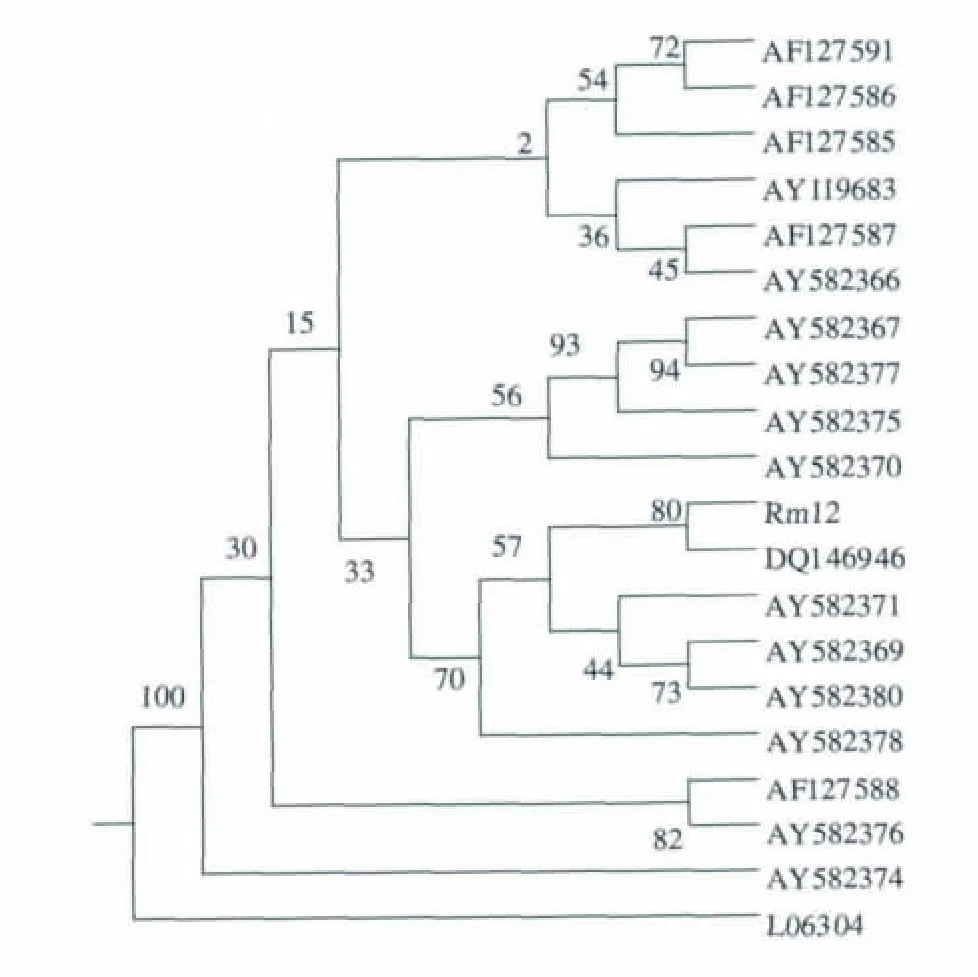
图4 根据16-23S rRNA序列建立的系统发育树Fig.4 Phylogenetic tree of Rm12 based on 16~23S rRNA
2.4 蛋白酶的最适温度和最适pH
在不同温度下测定蛋白酶活力。结果(图5)表明,该酶的最适反应稳定为40℃,活力达到5 403 U/mL,酶的温度影响曲线并不对称,低于最适温度时,酶活力上升较为平缓,高于最适温度时,酶活力下降相对较快。
不同pH下蛋白酶活力测定结果(图6)表明,该酶的最适pH为7.5。在pH值低于7.5或高于7.5时,酶活力下降的速度较快。

图5 不同温度对蛋白酶的影响Fig.5 Effect of temperature on the protease
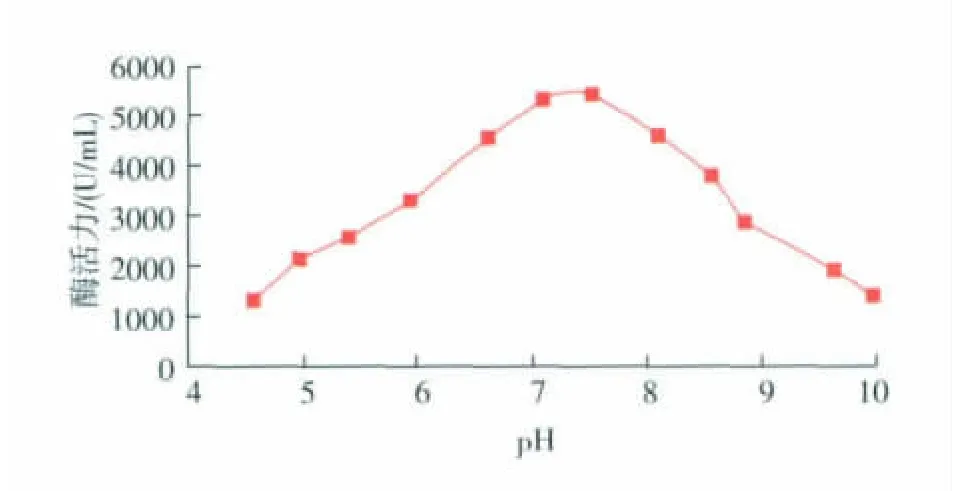
图6 不同pH对蛋白酶活力的影响Fig.6 Effect of pH value on protease
2.5 酶的热稳定性
原 酶液 在 80,90,100,110,120,130 和 140 ℃条件下加热4 s,测定剩余活力。见图7,从80℃到140℃,随着温度升高,酶的活力呈明显下降趋势。原酶液在140℃下加热4 s,剩余活力为321.55 U/mL。剩余活力为原酶液活力的6.66%。
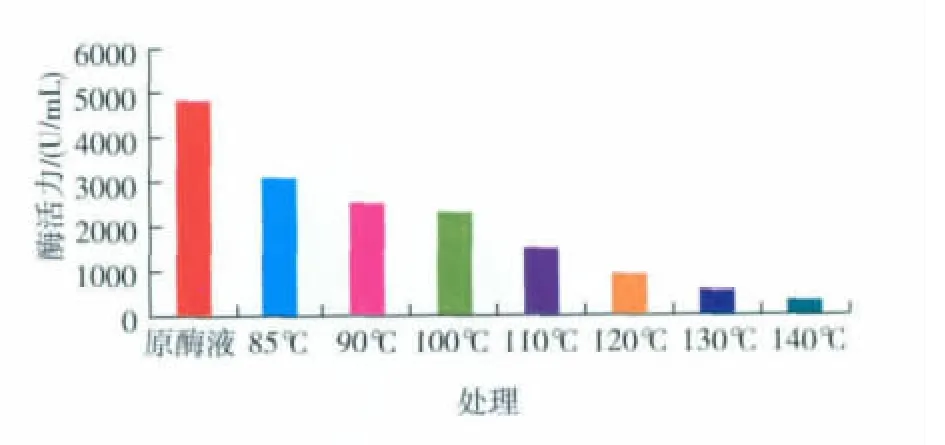
图7 酶的热稳定性测定Fig.7 Effect of high temperature on the protease
3 讨论
根据形态鉴定,生理生化特性,菌体脂肪酸含量和种类测定,16S rDNA及16-23S rRNA区间基因序列分析,从原料乳中分离得到的菌株Rm12属于荧光假单胞菌(P.fluorescens)。
脂肪酸是微生物细胞组分中一种较为稳定的重要成分,它和细菌的遗传变异、毒力、耐药性等有极为密切的关系,它的种类和含量是细胞化分类法的重要依据之一。Gundlapalli[16]等人分离的嗜冷假单 胞 杆 菌 CMS35T,CMS38T 和 CMS64T 中 ,C16:0,C16:1, 和 C18:1均 为 它 们 的 主 要 脂 肪 酸 。 1987 年Ikemoto等人研究了50株不同假单胞杆菌,所有菌株中都存在直链的饱和脂肪酸C16:0,及不饱和脂肪酸 C16:1及 C18:1。Vancaneyt的实验进一步支持了这一观点。 C10:03OH和 C12:03OH被作为假单胞杆菌的特征脂肪酸[17]。
从实验结果可以看出,Rm12不仅含有假单胞菌所共有的饱和脂肪酸C16:0,及不饱和脂肪酸C16:1及C18:1,同时也含有被认定假单胞杆菌的特征物质的 C10:0 3OH 和 C12:0 3OH。
大多数耐热蛋白酶作用最佳温度多数在60~80℃之间,少数例外也在80℃以上[18-19]。而作者所分离得到的蛋白酶最适温度在40℃,与常规耐热蛋白酶的情况不一致,这可能与该蛋白酶的分子结构有一定的关系。pH值对酶反应的影响是多方面的,通过影响酶的构象和底物的荷电性质,从而影响酶的活性中心与底物的接近和结合程度。酶是一种两性化合物,在不同的pH下会以不同的解离状态存在,往往只有一种解离状态最适合酶促反应的进行,这就是最适pH值。此外,pH值还会影响酶的稳定性,极端pH值下能够导致酶的不可逆变性。
4 结语
通过以上分析,从原料乳中分离的菌株Rm12属于荧光假单胞杆菌(P.fluorescens),是一种产耐热蛋白酶的嗜冷菌。该菌所产的耐热蛋白酶可以耐受一般UHT灭菌条件 (140℃,4 s)。
[1]Haryani S,Datta N,Anthony J,et al.Production of proteases by psychrotrophic bacteria in raw milk stored at low temperature[J].Aust J Dairy Technol,2003,58(1):15-50.
[2]李广武.低温生物学[M].长沙:湖南科学技术出版社,1998.
[3]Cusion M A.Presence and activity of psychrotrophic microoganismis in milk and dairy products:a review[J].Food Prot,1982,45:172-207.
[4]Griffiths M W,Phillips J D,West I G,et al.The effect of extended low temperature storage of raw milk on the quality of pasteurized and UHT milk[J].Food Microbiol,1988(5):75-87.
[5]Fairbairn D J,Law B A.The elect of nitrogen and carbon sources on proteinase production by Pseudomonas fluorescens[J].Journal of Applied Bacteriology,1987,62:105-113.
[6]惠艺.原料乳中嗜冷菌的测定 [J].中国乳品业,1998(5):35-39.HUI Yi.Determination of Psychrophilic bacteria in raw milk[J].China Dairy Industry,1998(5):35-39.(in Chinese)
[7]王克新,房玉国,张丽宏.液体乳中嗜冷菌的测定[J].乳品工业,2001(5):31-32.WANG Ke-xin,FANG Yu-guo,ZHANG Li-hong.Determination of numbers of psychrotrophic mi-croorganisms in milk[J].China Dairy Industry,2001(5):31-32.(in Chinese)
[8]John G H,Noel R K,Peter H A,et al.Bergey’s manual of determinative bacteriology[M].Ninth Edition.[S.I.]:Lippincott Williams&Wilkins,2000.
[9]诸葛健,王正祥.工业微生物实验技术手册[M].北京:中国轻工业出版社,1994:145-178.
[10]卢焱,叶萍,王靖,等.铜绿假单胞菌全细胞脂肪酸气相色谱分析及应用[J].中华医院感染学杂志,1997,7(1):7-10.LU Yan,YE Ping,WANG Jin,et al.Gas chromatographic whole-cell fatty acid analysis and its application for the identification of Ps.Aeruginosa[J].Chinese Journal of Nosocomiology,1997,7(1):7-10.(in Chinese)
[11]颜子颖,王海林译.精编分子生物学实验指南[M].北京:科学出版社,1998.
[12]钱斯亮,蔡宇杰,廖祥儒,等.热稳定性过氧化氢酶高产菌的筛选、鉴定及酶学性质研究[J].西北农业学报,2008,17(2):238-242.QIAN Si-liang,CAI Yu-jie,LIAO Xiang-ru,et al.Screening,identification and enzymatic properties of the thermal stability Catalase-Producing strain[J].Acta Agriculturae Boreali-Occidentalis Sinica,2008,17(2):238-242.(in Chinese)
[13]李玲,陈林,杨文革,等.一株他克莫司产生菌的筛选及鉴定[J].食品与生物技术学报,2010,29(3):416-420.LI Ling,CHEN Lin,YANG Wen-ge,et al.Isolation and Identification of a tacrolimus producing strain[J].Journal of Food Science and Biotechnology,2010,29(3):416-420.(in Chinese)
[14]于洁,孙志宏,张家超,等.16S rDNA-RFLP技术鉴定西藏地区乳制品中的乳杆菌[J].食品与生物技术学报,2009,28(6):804-810.YU Jie,SUN Zhi-hong,ZHANG Jia-chao,et al.Identification of lactobacillus isolated from Home-Made fermented milk in tibet by 16S rDNA-RFLP[J].Journal of Food Science and Biotechnology,2009,28(6):804-810.(in Chinese)
[15]Secades P,Alvarez B,Guijarro J A.Purification and characterization of a psychrophilic,calcium-Induced,Growth-Phase-Dependent metalloprotease from the Fish pathogen Flavobacterium psychrophilum[J].Appl Environ Microbiol,2001,67:2436-2444.
[16]Gundlapalli S N,Reddy G I,Matsumoto P S,et al.Psychrophilic pseudomonads from antarctica:Pseudomonas antarctica sp.nov.,Pseudomonasmeridiana sp.nov.and Pseudomonas proteolyticasp.nov[J].Int J Syst Evol Micr,2004,54,713-719.
[17]Garrity G M.Bergey’s Manual of Systematic Bacteriplogy[M].Second Edition.[S.I.]:Springer Publisher,2005.
[18]Fujiwara N,Masui A,Lmanaka T,et al.Purification and properties of the highly thermostable alkaline protease from and alkaliphilic a thermophilic Bacillus sp.[J].J Biotechnol,1993,30(2):245-246.
[19]Beadell J S,Clark D S.Probing stability-activity relationship in the thermophilic protease from Thermoplasma acidphilum by random mutagenesis[J].Extremephiles,2001,5(1):3-10.
