桃果实总蛋白质双向电泳优化体系的建立
2013-02-19康若祎王利斌郁志芳
张 丽, 姜 丽, 石 韵, 康若祎, 王利斌, 郁志芳*
(1.南京农业大学 食品科技学院,江苏 南京 210095;2.苏州市农业科学院,江苏 苏州 215155;3.南京农业大学生命科学院,江苏 南京 210095)
基因组学提供了细胞中大量或全部基因表达的快速检测,但是mRNA水平并不一定能预测细胞中相对蛋白质表达[1]。在蛋白质的表达过程中,各种mRNA不同的稳定性和不同的翻译效率都会影响蛋白质的表达。蛋白质形成后,许多参与信号传导、转录因子调节和细胞周期控制的蛋白质会迅速转换,而且蛋白质在内源翻译后也会因环境因素而改变[2-3]。所以,蛋白质组学的研究变得尤为重要。
如今,蛋白质组学技术已经被广泛地应用于动物和微生物领域的研究,在植物生物学方面也有广泛的应用[4]。而由于水果中蛋白质含量相对较低,并且含有大量干扰性物质,如色素、淀粉、多酚、多聚糖、单宁和有机酸类等,从果实组织中提取蛋白质更加困难[5-6]。因此,果实蛋白质组学具有很大的难度。
目前桃的采后保鲜研究大多数都集中在应用方面,对于深入的机理研究还不透彻,应用蛋白质组学的研究也较少[7-8]。随着蛋白质组学技术的迅猛发展,作者希望运用蛋白质组学的方法和手段研究桃果实在成熟衰老过程中特异性蛋白质的表达,进而更深入地探讨桃果实的成熟衰老的机理。但是目前桃果实蛋白质组学的研究技术不是很成熟,包括桃果实蛋白质的提取方法、双向电泳技术都需要改进和优化,本研究的目的是探索和掌握桃果实总蛋白质双向电泳的方法,为后续的研究提供更好的技术平台。
1 材料与方法
1.1 材料
供试材料为‘晖雨露’桃果实,采自江苏农科院桃园。取成熟期果实若干,去皮后,用水果刀取适量果肉,在液氮中速冻后保存在-20℃备用。
1.2 试剂
固化IPG线性干胶条 pH 3~10和pH 4~7、两性电解质,购自美国Bio-Rad公司;丙烯酰胺、甲叉丙烯酰胺、尿素、二硫苏糖醇(DTT)、碘乙酰胺、甘氨酸、CHAPS、三羟甲基氨基甲烷(Tris)、四甲基乙二胺(TEMED)、过硫酸铵、低分子量标准蛋白质、牛血清蛋白(BSA)、EGTA、苯甲基磺酰氟( PMSF )、考马斯亮蓝G-250、溴酚蓝、低熔点琼脂糖、十二烷基磺酸钠(SDS)、硫脲,购自 Amerisco公司;三氯乙酸(TCA)、蔗糖等其他所用药品或试剂均为国产分析纯级。
1.3 仪器与设备
高速离心机,美国 Thermo电子公司制造;UV/VIS 2802PC分光光度计,中国上海尤尼柯公司制造;Ettan DALT six垂直电泳系统,美国GE Healthcare公司制造;Protean IEF System水平电泳系统,美国Bio-Rad公司制造;Versdoc 3000凝胶成像系统,美国Bio-Rad公司制造;PDQuest 7.2.1分析软件,美国Bio-Rad公司研发。
1.4 方法
1.4.1 蛋白质提取方法
1)TCA-丙酮法[3]:称取6 g果肉,用液氮在研钵中将其研磨成粉。然后入5倍体积-20℃预冷的10 g/dL TCA(含0.07%体积分数的β-巯基乙醇),匀浆液于-20℃下过夜培养。20 000×g离心30 min,收集沉淀。沉淀用冷丙酮冲洗3次,并在4℃下干燥,之后溶于裂解缓冲液中,保存于-20℃备用。
2)匀浆法:参照Chan等的方法[4]并稍加改进。称取6 g果肉,用液氮在研钵中研磨成粉。加入3 mL的匀浆缓冲液,匀浆液中含有20 mmol/L的Tris-HCl (pH 8.0),250 mmol/L 的蔗糖,10 mmol/L的 EGTA,1 mmol/L 的 PMSF,1 mmol/L 的 DTT,以及1%体积分数的Triton X-100,继续研磨。匀浆液以20 000×g离心30 min。将上清液转移到新的离心管中,加入终质量浓度为10 g/dL的TCA溶液,-20℃下放置 2 h,20 000×g离心 30 min,收集沉淀。 用冷丙酮冲洗3次,4℃下干燥后溶于裂解缓冲液中,保存于-20℃备用。
3)酚抽法:根据Zhang等[5]的方法。称取5 g果肉,用液氮在研钵中研磨成粉。然后加入5 mL的匀浆缓冲液,匀浆液中含有60 mmol/L Tris,1.05 mol/L的蔗糖,10 mmol/L 的 EGTA,1 mmol/L 的 PMSF,1 mmol/L的DTT以及1%体积分数Triton X-100,pH为8.35,继续研磨。匀浆液以20 000×g离心30 min。上清液中加入三倍体积的pH为7.8的Tris-饱和酚,充分摇荡,混匀,10 000×g,4 ℃下离心 30 min,上层为酚相,中间白色物质为杂质,下层为水相。回收酚相,加入5倍体积预冷丙酮,充分混匀,-20℃下过夜培养,沉淀蛋白。沉淀分别用预冷的甲醇和丙酮冲洗2次,4℃下干燥后溶于裂解缓冲液,-20℃保存备用。
1.4.2 蛋白质的溶解 每毫克蛋白质干粉加入10 μL的蛋白质裂解缓冲液 (7 mol/L的尿素,2 mol/L的硫脲,4%体积分数的两性离子去污剂CHAPS,1 g/dL的二硫苏糖醇 (DTT)和0.5%体积分数的pH 4~7 IPG buffer)溶解。 4℃溶解过夜后,4℃条件下5 000×g离心10 min后,取上清液即为蛋白质样品溶液,100 μL的离心管分装,-20℃保存备用。
1.4.3 蛋白质含量的测定 蛋白质含量的测定采用Bradford方法[6],但略作修改。染色剂为Bradford工作液:考马斯亮蓝G-250溶于5 mL的95%体积分数的乙醇中,与10 mL 85%体积分数的磷酸混合定溶到100 mL,配好后用普通滤纸过滤,4℃ 避光保存。标准蛋白质溶液:1 mg/mL牛血清白蛋白,-20℃分装在1 mL的离心管中,每次定量取出一管。实验操作:取9只大于10 mL的试管,每管加入3 mL染色剂,在1—6管中分别加入0~80 μL不等的标准蛋白质溶液,另外3个管子分别加入10 μL的待测样品。测定每管的溶液在595 nm下的吸光值,根据前6管的吸收值和浓度的关系绘制蛋白质含量与相应吸收值的关系的标准曲线(R2>0.999)。
1.5 双向电泳
1.5.1 等电聚焦 在IPG胶条槽中加入350 μL溶有样品的IPG胶条溶胀液后,将17 cm pH分别为3~10和4~7的IPG胶条胶面向下放入槽内,胶面与溶胀液间不要产生气泡,盖上胶条槽的盖子,放于IPG等电聚焦仪上,以50 V低电压泡胀12 h后进行等电聚焦(IEF),溶胀1 h后每根胶条滴加3 mL矿物油。50 V主动水化后,等电聚焦的参数参照Zhang等[5]的方法(表1),每根胶条最大电流设置50 μA,温度设置20℃。

表1 桃果实蛋白质17 cm胶条等电聚焦程序设置Table 1 Program of isoelectric focusing of total protein of peach fruit with 17 cm IPG strip
1.5.2 IPG胶条的平衡 取出含样品的胶条先后置于5 mL胶条平衡缓冲液Ⅰ(6 mol/L的尿素、4 g/dL的 SDS、50 mmol/L 的 Tris-HCl (pH 8.8),20%体积分数的甘油、2 g/dL的DTT)和5 mL胶条平衡缓冲液Ⅱ (6 mol/L的尿素、4 g/dL的 SDS、50 mmol/L的Tris-HCl(pH 8.8),20%体积分数的甘油、2.5 g/dL 的碘乙酰胺)中各平衡20 min,用去离子水冲洗干净。
1.5.3 第二向SDS-PAGE 垂直板电泳采用Ettan DALT six垂直电泳系统,胶质量浓度为12 g/dL,电泳方式为恒功率,16℃冷水循环,每根胶条5 W进行90 min,然后每根胶条15 W运行6 h,直至溴酚蓝前沿距离玻璃板下缘1 cm时停止电泳。
1.5.4 染色 分别采用改良胶体考马斯亮蓝G-250染色法和银染法对蛋白质进行染色。
改良胶体考马斯亮蓝染色法:凝胶先经超纯水漂洗3次,每次1 min,再用胶体考马斯亮蓝G-250染色液 (0.12 g/dL的考马斯亮蓝G-250、10%体积分数的磷酸,10 g/dL的硫酸铵,20%体积分数的甲醇)染色1 h,然后用超纯水洗涤至背景清晰。胶体考染液的配置:200 mL蒸馏水与118 mL 85%体积分数的磷酸混匀,加入100 g硫酸铵搅拌溶解,另取一烧杯加入200 mL甲醇,加入1.2 g G-250搅拌溶解,然后将其缓慢加入上述硫酸铵溶液,并不断搅拌,定容至1 000 mL,置于棕色试剂瓶室温保存。
银染法:参考马洪雨等[7]的方法进行。
1.6 图像采集与分析
采用Verser-doc 3000型凝胶成像系统对双向凝胶电泳图谱进行扫描,并用PDQuest-7.1.2分析软件进行图像分析处理[5]。
2 结果与分析
2.1 不同蛋白质的提取方法对桃果实电泳图谱的影响
本次实验中比较了3种不同的蛋白质提取方法对桃果实双向电泳图谱的影响,见图1。结果表明,在相同条件下进行双向电泳,用TCA/丙酮法和匀浆法提取蛋白质,得到的图谱不清晰,蛋白点很少,而且横纹较多。在第一向的聚焦过程中,电流一直超过限定的最大电流50 μA,导致电压很难上去,所以聚焦效果不好,分析原因可能是因为这两种方法均使用TCA沉淀蛋白质,导致蛋白质中的离子强度较高,而且糖类、酚类或者脂类等杂质没有完全除去,且提取的蛋白质较难溶解,这样就影响了蛋白质的聚焦。而利用酚抽法得到的蛋白点相对较多,且横纹较少,点的分布相对均匀,比较清晰,同时在试验过程中电流强度也较小,程序升压很正常,这说明用酚抽法提取的蛋白离子强度低,蛋白质纯度较高,质量较好,无背景干扰,图谱较清晰。最终结果也证实了利用酚抽法确实能得到较好的电泳图谱,条带清晰,而且分离的效果最好。因此,综合考虑,确定了后期实验采用酚抽法来提取蛋白质。

图1 桃果实经3种不同蛋白提取方法后的双向电泳图Fig.1 Comparison of 2-DE maps of peach fruit with different protein extraction methods
2.2 不同pH范围胶条对桃果实2-DE图谱的影响
为了更深入了解桃果实2-DE蛋白质图谱,使用不同pH范围的IPG胶条进行实验。分别采用pH 3~10和pH 4~7长为17 cm的IPG胶条来显示桃果实蛋白质在2-DE图谱上的整体分布情况,实验结果见图2。

图2 两种pH范围的IPG胶条对桃果实2-DE图谱的影响Fig.2 Comparison of 2-DE maps of peach fruit with two IPG strips with different gradients
由图可知,在相同条件下双向电泳,两张图均有较好的图谱,但是pH3~10图谱的蛋白点均集中在pH 4~8的范围内,使得胶条没有得到很好的利用,而且蛋白点出现了堆积,蛋白质没有很好的分离,而pH 4~7的图谱点分散得比较开,分布比较均匀,但在碱性端出现了一条纵条纹,这是因为胶条pH范围的限制,使得pI等电压大于7的蛋白质被压缩,这个垂直的条纹包括了所有等电点大于7的蛋白质[8]。王一鸣[3]分析桃果实硬核期的蛋白质选用了pH 5~8的胶条,可能是为了避免碱性端蛋白质的堆积。王清等[9]分析桃果实蛋白质组学选用pH 4~7的胶条,国外研究水果的蛋白质组学文献中,很多也是选用了 pH 4~7 的胶条[3,7,11-13]。 因此,综合前人的经验、本实验中蛋白点的分布情况,以及图谱的清晰度,确定在以后的实验中选择pH 4~7的胶条进行双向电泳。
2.3 不同染色方法对桃果实蛋白质双向电泳图谱的影响
试验中采用两种经典的染色方法,即胶体考染和银染。由图3可以看出,与胶体考染相比,银染的灵敏度高,而且与背景的反差大,容易识别。但是银染法的灵敏度较高,操作却比较繁琐,而且银染过程中使用的醛类物质会对蛋白质起修饰作用,影响质谱鉴定。本试验中有足够的蛋白质上样量,故用考马斯亮蓝胶体考染分别对两张同样条件下跑的胶进行染色。由图可见,银染虽然能提高蛋白质着色的灵敏度,但只要有足够的蛋白质上样量,胶体考染也可以达到同样的效果。

图3 不同染色方法对桃果实蛋白双向电泳图谱的影响Fig.3 Comparison of 2-DE maps of peach fruit with different staining protocols
当然,电泳图谱的染色方法还有很多,如铜染、锌染和荧光染色等等,虽然其灵敏度都很高,但是由于成本较高,应用不是很广,因此作者采用胶体考染作为实验的染色方法。
2.4 不同上样量对桃蛋白质双向电泳图谱的影响
蛋白质的上样量也直接影响着电泳图谱的好坏,合适的蛋白质上样量才能跑出蛋白点清晰并且分布均匀的2-DE图谱,故确定蛋白质上样量也是双向电泳的一个关键步骤[10]。由图4可见,当蛋白质上样量达到1.0 mg时,呈现出的蛋白点较多,但由于蛋白质浓度过高,影响了蛋白质的聚焦,一些蛋白点堆积在一起,分离效果不是太好,这样很难判断差异点的表达量变化,给结果分析带来不利影响。而800 μg上样量的图谱,胶上的蛋白点分布均匀,且低丰度蛋白质能呈现,蛋白点间边界清晰,无扩散和拖尾现象。故本实验确定的桃果实蛋白质的最佳上样量是 800 μg。

图4 不同上样量对桃蛋白双向电泳图谱的影响Fig.4 Comparison of 2-DE maps of peach fruit with different loaded proteins
2.5 桃果实总蛋白质双向电泳图谱重复性的讨论
双向电泳的试验需要做3个以上的生物重复以减少试验操作对电泳图谱重复性的影响,本试验中以上述建立的方法,利用酚抽法提取蛋白质,蛋白质上样量为800 μg,采用 pH 4~7的IPG胶条、考马斯亮蓝G-250胶体考染,比较了桃果实总蛋白质双向电泳图谱的重复性。由图5可以看出,3个重复样品的电泳图谱具有很清晰的分辨率,蛋白质分离效果较好。利用PDQuest软件 (美国伯乐公司)分析,蛋白斑点的匹配率可以达到90%以上,证明了利用本试验建立的方法不仅可以得到高质量的双向电泳图谱,同时具有较好的重复性。
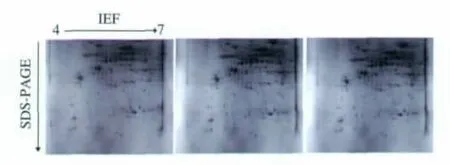
图5 桃果实总蛋白双向电泳图谱的重复性Fig.5 Repeatability of the 2-DE maps with the total proteins separated from peach fruit
3 讨论
双向电泳技术的应用为果实采后生物学的深入研究开创了新的篇章,但是双向电泳技术步骤繁多,操作过程复杂,所以在操作过程中会出现各种各样的问题,所以不同的样品需要进行双向电泳方法的建立,并不断摸索和优化。
3.1 样品的提取方法
目前,植物材料的蛋白质提取方法有很多,但是最常用的是3种:TCA/丙酮法,匀浆法,酚抽法。王清等[9]分别研究了利用这3种方法对不同的水果果实(甜樱桃,桃子,苹果,芒果)进行蛋白质提取,结果证明,对于不同的水果而言,3种方法各有利弊:TCA/丙酮法对于4种果实得到的图谱都不太理想,而匀浆法对桃子、苹果、芒果提取蛋白质可以得到清晰的双向电泳图谱,相对而言酚抽法对于不同的果实均能得到较好的图谱。王一鸣[3]利用TCA/丙酮法提取桃果实全蛋白质也得到了较好的图谱。王卓[11]利用酚抽法和TCA/丙酮法提取香蕉果实总蛋白质,结果表明,TCA/丙酮法提取能够得到较高的蛋白质产量,但是利用酚抽法得到的电泳图谱最清晰,这与王清的研究结果一致。刘浩等[12]利用TCA/丙酮法提取龙眼幼果胚胎也得到了较好的图谱。在国外的研究报道中,果实蛋白质的提取方法主要以酚抽法为主[13],不同果实最适的蛋白质提取方法各不相同,而蛋白质的提取方法以及提取蛋白质的纯度和质量对于整个双向电泳过程来说具有相当重要的意义。所以,需要具体的试验来摸索和确定各种果实的最佳的蛋白质提取方法。
3.2 不同裂解液对样品的溶解
不同的裂解液溶解蛋白质对双向电泳的影响也是很大的[14]。在双向电泳的过程中,为了使蛋白质得到最大程度的溶解,必须加入一些促溶剂、去污剂、还原剂和两性电解质等破坏蛋白质分子之间的相互作用,把蛋白质解聚和变性成单体,使得蛋白质在整个分离过程中以多肽链的形式存在,这样得到的样品不仅纯度高,而且离子去除得比较彻底,如果样品没有得到很好的较稳定地溶解,会造成蛋白质的缺失或者蛋白质点的不完全聚焦和一些水平条纹[15]。尿素是最常用的离液剂,主要作用是改变或者破坏氢键等次级键的结构,使得蛋白质变性并使蛋白酶失活[16]。硫脲不易溶于水,但溶于高浓度的尿素溶液中,通常情况下,尿素和硫脲一起使用,可以促进蛋白质的溶解,尤其是膜蛋白质的溶解。这两者可以有效的破坏蛋白质的疏水键,防止聚集作用和二级结构的形成。另外,含有尿素的溶液应在10~37℃的温度范围内操作,低于10℃,尿素会析出;而高于37℃,尿素中的氰酸盐会引起蛋白质的甲酰化[17]。
DTT或者β-巯基乙醇是常用的还原剂。它们的主要作用是用于蛋白质分子中的二硫键,增加蛋白质的溶解性[18]。由于β-巯基乙醇气味非常重,通常选用DTT作为还原剂。此外需要注意的是,DTT在室温的半衰期很短,因此在操作过程中需要现用现加,而且一定要保存在-20℃。还有一种新型的还原剂TBP,它可以在很低的浓度下将蛋白质还原,使用的效果比DTT还要好,能大大地增加蛋白质的溶解性[19]。Triton X-100和NP-40是常用的非离子去污剂,CHAPS是兼性离子去污剂。它们的主要作用是破坏蛋白质分子之间的疏水作用,提高蛋白质的溶解性。还有一种新型的兼性离子去污剂ASB-14,也能增加蛋白质的溶解性[12]。
除此之外,在裂解液中还经常加入一些蛋白酶抑制剂,最常用的是PMSF,它不可逆抑制丝氨酸水解酶和一些半胱氨酸水解酶,它的毒性相当大,因此要做好防护措施[20]。另外,它在水溶液中很快失活,需要现用现配,它在含有巯基试剂(DTT或者β-巯基乙醇)时效果不好。还有一种蛋白酶抑制剂是AEBSF,它是一种丝氨酸水解酶的抑制剂,易溶于水而且毒性小,但是它具有修饰能力,会改变蛋白质的等电点。有时候,也在裂解液中加入一些金属离子螯合剂如EDTA或者EGTA,它们是通过螯合蛋白酶维持活性所必需的金属离子来抑制金属蛋白酶[21]。
因此,要对裂解液进行优化,本实验中采用的裂解液为裂解液I(7 mol/L的尿素,2 mol/L的硫脲,4 g/dL的CHAPS,65 mmol/L的 DTT,0.5%体积分数的IPG Buffer),也采用裂解液Ⅱ(9 mol/L的尿素,4 g/dL 的 CHAPS,65 mmol/L 的 DTT,0.5%体积分数的IPG Buffer。比较结果发现,裂解液I的使用得到的双向电泳图谱背景清晰,而且蛋白点多(未公开数据)。分析原因是裂解液I中加入了硫脲,两者的结合使用使得蛋白质的溶解性增加。
3.3 等电聚焦和IPG胶条的选择
IEF是蛋白质在pH梯度胶条中根据等电点的不同而进行分离。等电聚焦的参数和IPG胶条的选择直接影响着双向电泳图谱的质量。如果聚焦参数设置不当,会导致聚焦时电压上不去从而导致聚焦不完全,或者导致过度聚焦,使得电泳图谱出现水平条纹或者垂直条纹,蛋白质拖尾,有时会出现模糊不清的情况。因此,需要对等电聚焦的运行参数进行试验和摸索[22]。
一般情况下,刚开始都是属于除盐的过程,都选择较低的电压,而且要缓慢上升,这样不仅能使样品充分地进入凝胶,而且能够去除样品中的盐离子和其他的杂质,达到充分除盐的目的。这个低电压的选择根据不同的样品而定。在除盐结束后,就是升压过程,这个一般选择线性升压,如果样品很纯的话,这个升压过程会很顺利,但是经常会遇到电压上不去的情况,这就要根据试验的步骤来分析原因,可以调整升压的程序,或者在水化结束后在胶条的两极搭上盐桥,或者改用杯上样的方式,来去除盐离子和杂质的干扰。最后聚焦过程也要合适,聚焦太短,样品不能很好的分离,会出现横纹,降低分辨率,而聚焦时间太长的话,会造成过度聚焦,也造成横纹的出现,甚至是蛋白质的丢失。
试验中使用不同pH范围的IPG胶条得到了不同的双向电泳图谱,因此要根据不同的情况选择不同的p H范围的IPG胶条。窄pH范围的IPG胶条有利于提高蛋白质的分辨率。由本实验可以看出,桃果实的蛋白质主要分布在pH 4~7之间,因此实验中采用pH 4~7的IPG胶条。
3.4 平衡液的成分及平衡时间
等电聚焦之后,影响双向电泳的就是平衡,如果平衡不好,可能会在图谱上产生条纹,影响图谱的质量。在本实验中,将平衡液中的SDS的量由2 g/dL改为4 g/dL,而且延长了平衡的时间,由原来的15 min改为20 min,将DTT的使用量增加到200 mg/10 mL,这样使得等电聚焦的蛋白质得到了充分的平衡,从而得到了质量较高的双向电泳图谱。在国外的文献报道中,选用TBP来代替DTT,增加了等电聚焦中的溶解性,也增加了蛋白质从第一向向第二向转移的效率。TBP不带电荷,在第二向电泳过程中不迁移,使得电泳图谱的背景较浅,蛋白质的分离效果好。
3.5 图谱上的水平横纹和垂直横纹
在双向电泳的过程中,常常会在图谱上产生水平条纹,垂直条纹,或者是横竖交叉的条纹,这些条纹出现的原因很多,现结合前人经验和自己试验过程中的所得做一讨论和分析。
一般情况下,水平条纹的产生有以下几种原因:一是蛋白质没有充分提纯,蛋白质中含有大量的杂质和盐离子,因此要在样品制备这一过程中做好文章;二是上样量太大,会影响等电聚焦,尤其是在高相对分子质量的区域蛋白质展现不好,因此在蛋白质定量的时候应特别精准;三是聚焦不充分,如果横条纹主要集中在高分子区域的话,就要延长聚焦的时间,如果是整个胶上都是横条纹的话,就要大量的延长第一向的运行时间,而不仅仅是聚焦时间;四是由于过度聚焦,这些蛋白质主要存在于靠近电极的地方(是因为电内渗现象干扰导致),由于过度聚焦导致蛋白质降解,所以这些条纹存在于降解蛋白质的一侧,因此要适当缩短聚焦时间。
双向电泳图谱上产生垂直条纹,主要是因为平衡和SDS-PAGE过程中的操作不当造成的。一是平衡过程中,DTT的含量不够或者平衡时间不够,就会在二向上造成垂直拖尾;二是在加入烷基化平衡液之前,一定要沥干DTT平衡液,不然会大大减低效力;第三,这两个过程中的药品出现问题或者过期,会造成垂直条纹的产生[23]。如果图谱上出现了横竖交叉的条纹,可能是覆盖IPG胶条的琼脂糖或者平衡液中存在杂质,需要用新鲜配制的试剂,平衡过程中的DTT和碘乙酰胺也一定要现用现配和充分溶解。
除了水平和垂直条纹,在双向电泳图谱上还会出现一些图像弯曲变形,主要是因为SDS-PAGE的胶没有配均匀或者胶面没有压平导致。因此,在平衡转移和SDS-PAGE的时候,一定要克服各种操作问题,从而得到分离效果很好的双向电泳图谱,提高蛋白质分离的效率。
4 结语
通过上述试验,最后确定采用酚抽法作为实验中桃果实蛋白质的提取方法,蛋白质上样量为800 μg,试验确定采用 pH 4~7的IPG胶条,采用考马斯亮蓝G-250胶体考染为实验中采用的染色方法。本研究成果为以后桃果实的蛋白质组学研究提供了有力的技术支持。
[1]Bianco L,Lopez L,Scalone A G,et al.Strawberry proteome characterization and its regulation during fruit ripening and in different genotypes[J].Journal of Proteomics,2009,72(4):586-607.
[2]武春飞,范海延,赵大伟,等.植物膜蛋白质组学研究进展[J].湖北农业科学,2009(1):223-226.WU Chun-fei,FAN Hai-yan,ZHAO Da-wei,et al.Research progress in plant membrane proteomics[J].Hubei Agricultural Sciences,2009(1):223-226.(in Chinese)
[3]王一鸣,花宝光,王有年,等.桃果实蛋白质双向电泳影响因素的研究[J].园艺学报,2007(6):244-249.WANG Yi-ming,HUA Bao-guang,WANG You-nian,et al.Studies on influence factors of protein two-dimensional electrophoresis in prunus persica fruit[J].Acta Horticulturae Sinica,2007(6):244-249.(in Chinese)
[4]产祝龙.果实对酵母拮抗菌和外源水杨酸诱导的抗病性应答机理[D].北京:中国科学院研究生院,2006.
[5]ZHANG Li,YU Zhi-fang,JIANG Li,et al.Effect of post-harvest heat treatment on proteome change of peach fruit during ripening[J].Journal of Proteomics,2011,74:1135-1149.
[6]Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of Protein-Dye binding[J].Analytical Biochemistry,1976,72:248-254.
[7]马洪雨,王占奎,俞阗,等.适用于黄麻根部蛋白质组学分析的双向电泳技术[J].西北植物学报,2010,30(1):0195-0202.MA Hong-yu,WANG Zhan-kui,YU Tian,et al.Two-Dimensional electrophoresis protocol for root proteomics analysis of orchorus olitorius[J].Acta Botanica Boreali-Occidentalia Sinica,2010,30(1):0195-0202.(in Chinese)
[8]Barraclough D,Obenland D,Laing W,et al.A general method for two-dimensional protein electrophoresis of fruit samples[J].Postharvest Biology and Technology,2004,32(2):175-181.
[9]王清,产祝龙,秦国政,等.果实蛋白质组学研究的实验方法[J].植物学报,2009(1):109-118.WANG Qing,CHAN Zhu-long,QIN Guo-zheng,et al.Comparison of 2-DE techniques for improved proteomic analysis of fruit tissues[J].Chinese Bulletin of Botany,2009(1):109-118.(in Chinese)
[10]陈伟,游向荣,梁文裕,等.龙眼成花逆转不同时期花芽差异蛋白的研究[J].农业生物技术学报,2009(4):722-727.CHEN Wei,YOU Xian-grong,LIANG Wen-yu,et al.Analysis of differential proteins of floral reversion buds during different period in longan[J].Journal of Agricultural Biotechnology,2009(4):722-727.(in Chinese)
[11]王卓,贾彩虹,金志强,等.香蕉果实高质量总蛋白的提取方法[J].果树学报,2009(3):154-157.WANG Zhuo,JIA Cai-hong,JIN Zhi-qiang,et al.Methods for total high-quality protein extraction from banana fruit[J].Journal of Fruit Science,2009(3):154-157.(in Chinese)
[12]刘浩.龙眼种子败育过程中的蛋白质组学[D].福州:福建农林大学,2009.
[13]张丽,罗海波,姜丽,等.果实成熟衰老过程中蛋白质组学研究进展[J].植物生理学报,2011,47(9):861-871.ZHANG Li,LUO Hai-bo,JIANG Li,et al.Advances in proteomics related to fruit ripening and senescence[J].Plant Physiology Journal,2011,47(9):861-871.(in Chinese)
[14]孔令琼,管政兵,陆健,等.绍兴黄酒成品麦曲中微生物胞外酶的双向电泳技术的建立[J].食品与生物技术学报,2011,30(5):453-457.KONG Ling-qiong,GUAN Zheng-bing,LU Jian,et al.Establishment of a Two-Dimensional electrophoresis protocol for extracellular enzymes excreted by microorganisms from Shaoxing rice wine wheat Qu[J].Journal of Food Science and Biotechnology,2011,30(5):453-457.
[15]Hennan J K,Diamond J.An updated two-dimensional gel electrophoresis technique for the detection of drug-induced changes in protein phosphorylation in intact smooth muscle[J].Journal of Pharmacological and Toxicological Methods,1999,42(1):49-57.
[16]Katz E,Fon M,Lee Y J,et al.The citrus fruit proteome:insights into citrus fruit metabolism[J].Planta,2007,226(4):989-1005.
[17]张建秋,陆海,王智,等.双向电泳技术分析白刺盐胁迫蛋白的表达[J].吉林农业大学学报,2004(5):42-45.ZHANG Jian-qiu,LU Hai,WANG Zhi,et al.2D Electrophoresis analysis of expression of Salt-Induced protein in nitraria sibirica pall[J].Journal of Jilin Agricultural University,2004(5):42-45.(in Chinese)
[18]吴满成,胡海涛,余有见,等.牛奶子果实中蛋白质的提取和双向电泳分析方法的改良[J].植物生理学通讯,2009(7):65-68.WU Man-cheng,HU Hai-tao,YU You-jian,et al.Extraction and improvement of Two-Dimensional electrophoresis analysis of proteins from berries of elaeagnus umbellate thunb[J].Plant Physiology Communications,2009(7):695-698.(in Chinese)
[19]王凤华,赖钟雄,郭志雄,等.龙眼胚性培养物蛋白质水平双向电泳技术体系的建立[J].福建农林大学学报:自然科学版,2003(2):61-65.WANG Feng-hua,LAI Zhong-xiong,GUO Zhi-xiong,et al.Technique of horizontal two-dimensional electrophoresis of proteins in longan embryogenic cultures[J].Journal of Fujian Agricultural and Forest University:Natural Science,2003(2):61-65.(in Chinese)
[20]庞国彩,谢东丽,陈清西,等.龙眼花芽与叶芽差异蛋白分析[J].热带亚热带植物学报,2009(3):242-248.PANG Guo-cai,XIE Dong-li,CHEN Qing-xi,et al.Analysis of differential proteins during development stages of flower bud and leaf bud in Longan[J].Journal of Tropical and Subtropical Botany,2009(3):242-248.(in Chinese)
[21]谷瑞升,刘群录,陈雪梅,等.木本植物蛋白提取和SDS-PAGE分析方法的比较和优化[J].植物学通报,1999(2):76-82.GU Rui-sheng,LIU Qun-lu,CHEN Xue-mei,et al.Comparison and optimization of the methods on protein extraction and SDS PAGE in woody plants[J].Chinese Bulletin of Botany,1999(2):76-82.(in Chinese)
[22]盖颖,王文棋,蒋湘宁.一种改进的双色SDS-PAGE凝胶和可视化上样电泳方法[J].北京林业大学学报,2006(1):106-109.GAI Ying,WANG Wen-qi,JIANG Xiang-ning.An improved dual-color SDS-PAGE gel and visible-sample-loading electrophoresis method[J].Journal of Beijing Forestry University,2006(1):106-109.(in Chinese)
[23]曹尚银,张秋明,朱志勇,等.苹果花芽孕育蛋白质组学初步分析[J].中国农业科学,2007(10):172-179.CAO Shang-yin,ZHANG Qiu-ming,ZHU Zhi-yong,et al.Preliminary proteomics analysis of the total proteins of Flower-Bud induction of apple trees[J].Scientia Agricultura Sinica,2007(10):172-179.(in Chinese)
