微胶囊形成过程中酪蛋白与麦芽糊精相互作用研究
2013-02-13郑为完
石 燕,刘 凡,郑 燚,郑为完,3,葛 辉
(1.南昌大学食品科学与工程系,食品科学与技术国家重点实验室,江西 南昌 330047;2.江西师范大学计算机信息工程学院,江西 南昌 330027;3.江西维尔宝食品生物有限公司,江西 高安 330800)
微胶囊具有将液体粉末化、保护活性组分和控制芯材释放等功能,其结构形态特征,如颗粒的孔隙、表面完整性会影响微胶囊品质,从而决定产品货架期[1-3]。选择合适的壁材是生产高稳定性微胶囊的关键,油脂微胶囊的壁材成分主要有蛋白质与多糖[4]。蛋白质是表面活性剂,具有乳化剂的特征结构;多糖则有良好的增稠性和持水性[5]。蛋白质在微胶囊加工过程中与多糖共混,多糖的加入会对蛋白质的乳化性及乳化稳定性产生影响[6-7],可能原因是蛋白质和多糖之间发生了交互作用,对蛋白质的构象产生了影响。
蛋白质的构象决定其功能,傅里叶变换红外光谱是研究蛋白质结构和功能相互关系的有力手段,蛋白质二级结构与其分子内形成的氢键密切相关。蛋白质的红外吸收光谱由9个酰胺吸收带组成,其中酰胺Ⅰ带(1700~1600cm-1)主要包含了C=O的伸缩振动,已广泛应用于二级结构变化的研究,但水汽在1640cm-1附近的吸收很强,对结果准确性造成很大的影响[8]。蛋白质的酰胺Ⅲ带(1330~1220cm-1)由于信号较弱,过去很少用于蛋白质二级结构的分析,但由于H2O在此区间无吸收,解决了水汽干扰问题,而且蛋白质不同二级结构的酰胺Ⅲ带的光谱性质特征明显,拟合过程中易于将其分离,弥补了酰胺Ⅰ带中α-螺旋结构无规则卷曲难以区分的缺点[9-10]。
本实验拟利用傅里叶红外光谱酰胺Ⅰ带及酰胺Ⅲ带研究麦芽糊精与酪蛋白相互作用情况,采用吸光度光谱差减法,结合去卷积、二阶导数谱和曲线拟合等数学处理方式分析酪蛋白酰胺Ⅲ带的谱图变化,观察酪蛋白与麦芽糊精在微胶囊壁形成过程中酪蛋白二级结构变化情况,并比较酪蛋白与麦芽糊精相互作用后对其乳化稳定性的影响,分析其产生原因,对微胶囊壁形成过程中麦芽糊精与酪蛋白相互作用机理进行初步探讨。
1 材料与方法
1.1 材料与试剂
酪蛋白 美国Sigma公司;麦芽糊精(分析纯) 上海青析化工科技有限公司;大豆油 中粮集团;十二烷基硫酸钠(分析纯) 天津市大茂化学试剂厂。
1.2 仪器与设备
Nicolet Nexus FT-IR傅里叶红外光谱仪 美国Nicolet公司;SLS高压均质机 上海申鹿均质机有限公司;压力喷雾干燥机 锡山市干燥机厂;BT00-100M蠕动泵常州科健蠕动泵;721型分光光度计 上海第三仪器分析厂。
1.3 方法
1.3.1 酪蛋白-麦芽糊精复合物制备
将酪蛋白与麦芽糊精以质量比1:2.5进行复配作为微胶囊壁材,经80℃水浴溶解,40MPa高压均质后,进风温度200℃、出风温度95~97℃、蠕动泵转速15.5r/min喷雾干燥法制备酪蛋白-麦芽糊精复合物。
1.3.2 谱图收集
酪蛋白及其复合物在100℃烘箱中干燥2h。用KBr压片法制样,采用Nicolet Nexus FT-IR傅里叶变换红外光谱仪记录干燥的蛋白质、麦芽糊精及喷雾干燥后酪蛋白-麦芽糊精复合物的红外光谱图,波长扫描范围为500~4000cm-1,分辨率4cm-1,扫描次数32,收集样品光谱。
1.3.3 谱图处理
对添加麦芽糊精前后酪蛋白的红外光谱变化进行减差处理([酪蛋白+麦芽糊精]-麦芽糊精)去除麦芽糊精对谱图的影响。利用OMNIC 7.3对酪蛋白的酰胺Ⅲ带(1330~1220cm-1)进行两点基线校正,采用9点Savitzky-Golay平滑处理后,对光谱数据进行二阶求导和傅里叶去卷积(FSD),从而估计各子峰的峰位和半峰宽,酪蛋白的FSD曲线参数选择谱带宽度8.48,增强因子3.0;酪蛋白-麦芽糊精的FSD曲线参数选择谱带宽度7.66,增强因子3.0,使二阶导数曲线和FSD曲线中的各子峰的个数和峰位基本相同。通过Origin Pro 8.0软件对酰胺Ⅲ带进行Gaussian曲线拟合,其残差R2>0.93。
1.3.4 乳化活性和乳化稳定性测定[11-12]
分别称取酪蛋白和酪蛋白-麦芽糊精共价复合物5g,溶于300mL去离子水中,缓慢加入大豆油10mL,使用高速分散机在2000r/min条件下分散2min,制成乳状液,立即从乳状液底部吸收100μL乳浊液,迅速与0.1%十二烷基磺酸钠溶液50mL混合,混匀后在500nm波长处测定该稀释液的吸光度A0,吸光度正比于乳浊液的液滴界面面积。因此,A0越大,蛋白质的乳化活性越高。
以t时间间隔(t依次为0、10、20、30、40、50min)从乳状液底部用微量注射器抽取样品100μL,立即与0.1%十二烷基磺酸钠溶液50mL混合,然后使用分光光度计于500nm波长处读取其吸光度At,乳化稳定性(ES)由以下公式计算得出。

式中:A0为初始吸光度;At为tmin后的吸光度。
2 结果与分析
2.1 傅里叶红外光谱分析
通过对比酪蛋白(图1)、麦芽糊精(图2)以及经加热喷雾干燥酪蛋白-麦芽糊精复合物(图3)的红外光谱图,图1中3300.4cm-1处的吸收峰属于酪蛋白中N—H键的伸缩振动吸收,2962.8cm-1的吸收峰是饱和C—H键的伸缩振动吸收,1654.2cm-1的吸收峰是酰胺Ⅰ带中C=O的伸缩振动吸收,1448.7cm-1处为C—N伸缩振动吸收,1240.9cm-1则是酰胺Ⅲ带中N—H、C—N的无规则缠绕。图2中3416.2cm-1处宽而强的谱带是碳水化合物典型的缔合O—H伸缩振动吸收,2926.9cm-1为饱和C—H伸缩振动,1648.2cm-1为烯烃的C=C伸缩振动,1426.1cm-1和1370.2cm-1是C—O—H中的O—H的弯曲振动,1156.2~861.0cm-1处的吸收峰是属于多糖中的C—O伸缩振动与环的振动,其中1022.7cm-1属于C—O—C的不对称伸缩振动,具有强吸收,926.5cm-1处属于C—O—C的对称伸缩振动,吸收峰弱,861.0cm-1属于环振动。由图3可知,当酪蛋白与麦芽糊精混合并经喷雾干燥后,其产物的红外光谱既有蛋白的酰胺化合物的吸收带特征峰,又具有碳水化合物的特征吸收峰,其中N—H键的伸缩振动吸收峰强度增大并向高波数移动至3384.9cm-1处,这是由于新物质共价交联反应出现了新的N—H键,导致吸收峰强度增大,同时,N—H键变成=N—H,键长缩短,伸缩振动波数也会增大[13];添加麦芽糊精后,经水浴溶解和喷雾干燥后,酪蛋白酰胺Ⅰ带移至1650.9cm-1左右,与图2中显示酪蛋白酰胺Ⅰ带1654.6cm-1相比向低波数方向位移了约4cm-1,且峰的振动明显减弱,这是由于蛋白质中氨基酸与周围介质之间形成分子间氢键,氢键可增加分子间的作用力,有利于分子链的密集,当氢键作用较强时,C=O的电子云密度降低,吸收带移向低波数[14-15],证实交联结构的存在。

图1 酪蛋白红外光谱图Fig.1 FT-IR spectrum of casein

图2 麦芽糊精红外光谱图Fig.2 FT-IR spectrum of maltodextrin

图3 酪蛋白-麦芽糊精复合物红外光谱图Fig.3 FT-IR spectrum of casein in presence of maltodextrin
反应前后的酪蛋白和麦芽糊精各自的特征吸收峰没有明显位移现象,说明反应后蛋白质分子的空间结构并没有发生展开,只是蛋白质分子中共价结合了糖链来改善其功能特性。
2.2 酪蛋白酰胺Ⅲ带的光谱分析
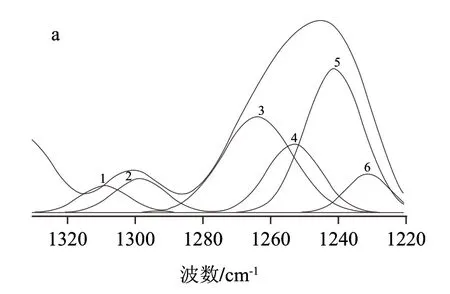

图4 酪蛋白酰胺Ⅲ带的红外光谱(上)和高斯曲线拟合图谱(下)Fig.4 FT-IR spectrum (upper) and Gaussian fitting curves (bottom) in the amide Ⅲ region of casein alone (a) and in presence of maltodextrin (b)
酰胺Ⅲ带峰的归属如下[16]:1330~1290cm-1为α-螺旋、1290~1270cm-1为β-转角、1270~1250cm-1为无规卷曲、1250~1220cm-1为β-折叠。根据拟合曲线(图4)对酪蛋白的酰胺Ⅲ带进行谱带指认,由表1计算出与麦芽糊精相互作用后,酪蛋白的α-螺旋含量分别为5.96%和15.29%,β-折叠的含量从58.64%减少到33.12%,减少了25.52%,β-转角含量从7.93%增加到10.83%,无规卷曲从27.47%增加至40.76%,增加了13.29%。大部分蛋白质随着温度的升高,α-螺旋含量会减少,无规卷曲会增加。α-螺旋和β-折叠结构中存在较多的氢键,导致规则二级结构具有一定的刚性,β-转角和无规卷曲中不存在氢键或其他相互作用,使分子表现出较大的柔性[17]。微胶囊壁在形成过程中要经过加热和高压均质处理,使得蛋白质二级结构向无序结构转变,但α-螺旋含量的增加可能说明了蛋白质和麦芽糊精发生交联反应生成了氢键,C=O…H—N氢键使蛋白质形成α-螺旋。

表1 酪蛋白酰胺Ⅲ谱带曲线拟合结果及谱带指认Table 1 Infrared band positions, band areas determined by Gaussian curve fitting and band assignments in the amide Ⅲ spectral region of sodium caseinate
2.3 麦芽糊精对酪蛋白乳化活性及乳化稳定性的影响
由图5可知,添加麦芽糊精后,酪蛋白的乳化活性有一定程度的增加。随着时间的延长,酪蛋白的乳化稳定性逐步下降,在50min时间内,酪蛋白-麦芽糊精复合物的乳化稳定性均高于酪蛋白(图6),这可能是由于两者结合后酪蛋白的α-螺旋含量增加的缘故,由于大部分α-螺旋结构具有两亲性,一侧被疏水侧链占据,另一侧被亲水残基占据,有利于蛋白质在油-水界面膜上的快速吸附和定向[18];另外,两者结合后,无序结构含量增加也导致蛋白质柔性增加,而蛋白质在界面的吸附与分子柔性有关,酪蛋白和麦芽糊精作用分子柔性增大,也有利于蛋白质在界面上发生广泛的构象转变[19]。

图5 麦芽糊精对酪蛋白乳化活性的影响Fig.5 Effect of maltodextrin on the emulsifying activity of casein

图6 麦芽糊精对酪蛋白乳化稳定性的影响Fig.6 Effect of maltodextrin on the stability of casein emulsion
3 结 论
酪蛋白作为微胶囊的壁材与麦芽糊精混合后,经高压均质和喷雾干燥后,其乳化活性和乳化稳定性都有了一定的提高。微胶囊壁形成过程中酪蛋白红外光谱测定结果表明酰胺Ⅰ带发生了紫移,酪蛋白中氨基酸与周围介质之间形成分子间氢键,证实有交联结构的存在。通过拟合曲线对酪蛋白的酰胺Ⅲ带进行谱带指认结果表明:酪蛋白与麦芽糊精作用后,其二级结构发生了改变,其中:α-螺旋含量增加了9.33%,β-折叠含量减少了25.52%,β-转角含量增加2.90%,无规卷曲含量增加了13.29%。无序结构从35.40%增加到51.59%,增加了16.19%,进一步证明蛋白质和麦芽糊精发生交联反应生成了氢键。结合酪蛋白的柔性增加,麦芽糊精的加入对维持蛋白质α-螺旋是有益的,α-螺旋的增加和无序结构含量的增加可能是造成酪蛋白-麦芽糊精复合物乳化性和乳化稳定性提高的因素。
[1]CHOI M, RUKTANONCHAI U, MIN S, et al.Physical characteristics of fish oil encapsulated byβ-cyclodextrin using an aggregation method or polycaprolactone using an emulsion-diffusion method[J].Food Chemistry, 2010, 119: 1694-1703.
[2]TOMITA S, SATO K, ANZAI J.Preparation of dendrimer-loaded microcapsules by a layer-by-layer deposition of polyelectrolytes[J].Materials Science and Engineering C, 2009, 29: 2024-2028.
[3]马云标, 周慧明, 朱科学.VE微胶囊的制备及性质研究[J].食品科学, 2010, 31(2): 1-5.
[4]杨佳, 候占群, 贺文浩.微胶囊壁材的分类及其性质比较[J].食品与发酵工业, 2009, 35(5): 122-127.
[5]熊拯, 郭兴凤, 谈天.蛋白质-阴离子多糖相互作用研究进展[J].粮食与油脂, 2006(10): 15-17.
[6]齐军茹, 杨晓泉, 彭志英.蛋白-多糖复合物的制备及乳化性能的研究[J].中国粮油学报, 2004, 19(2): 75-78.
[7]胡坤, 方少瑛, 王秀霞.大豆分离蛋白-麦芽糊精Maillard反应共聚物的乳化特性研究[J].食品工业科技, 2005, 26(6): 72-75.
[8]BARTH A.Infrared spectroscopy of proteins[J].Biochimica et Biophysica Acta, 2007, 1767: 1073-1101.
[9]谢孟峡, 刘媛.红外光谱酰胺Ⅲ带用于蛋白质二级结构的测定研究[J].高等学校化学学报, 2003, 24(2): 226-231.
[10]翁诗甫.傅里叶变换红外光谱分析[M].2版.北京: 化学工艺出版社,2009.
[11]张根生, 岳晓霞, 李继光, 等.大豆分离蛋白乳化性影响因素的研究[J].食品科学, 2006, 27(7): 48-51.
[12]PEARCE K N, KINSELLA J E.Emulsifying properties of proteins:evaluation of a turbiditmetric technique[J].Agric Food Chemistry,1978, 26: 716-723.
[13]张付利, 敬永生, 宋丽.曲克芦丁对血清白蛋白溶液二级结构影响的研究[J].药物分析杂质, 2011, 31(1): 75-78.
[14]顾小红, 孟旭, 汤坚.豆浆凝固过程中大豆蛋白质二级结构的研究[J].分析科学学报, 2006, 22(6): 675-678.
[15]曹栋, 史苏佳, 张永刚, 等.酰胺Ⅰ带酰胺Ⅲ带测定花生磷脂酶D的α-螺旋和β-折叠含量[J].化学通报, 2008(11): 877-880.
[16]蒋艳, 武培怡.大豆蛋白的中红外和近红外光谱研究[J].化学进展,2009, 21(4): 705-714.
[17]涂宗财, 王辉, 刘光宪, 等.动态超高压微射流对卵清蛋白微观结构的影响[J].光谱学与光谱分析, 2010, 30(2): 495-498.
[18]FENNEMA O R.Food chemistry[M].北京: 中国轻工业出版社,2003: 281.
[19]谢笔钧.食品化学[M].北京: 科学出版社, 2004: 274.
