火棘果红色素的提取及抗氧化活性
2013-02-13李鹏霄茆广华任月娜白石琦吴向阳仰榴青
李鹏霄,茆广华,赵 婷,邹 烨,任月娜,白石琦,吴向阳,仰榴青,*
(1.江苏大学药学院,江苏 镇江 212013;2.江苏大学食品与生物工程学院,江苏 镇江 212013;3.江苏大学化学化工学院,江苏 镇江 212013)
火棘(Pyracantha fortuneana)别名赤阳子、叶祥果、火把果、红果、救军粮等,是蔷薇科火棘属植物,在我国华东、华中及西南地区均有种植。火棘果中含有丰富的营养物质,具有很高的食用和药用价值,是加工食品,提取天然色素、化妆品添加剂的重要野生资源;火棘果果皮中含有花色苷[1-3]。研究发现,花色苷具有抗氧化、抗肿瘤、抗炎、抗病毒、保肝、调节心脑血管及神经系统等多种药理活性,且具有较好的着色效果,在食品和化妆品行业有着广泛的应用[4-8]。火棘果红色素是从火棘果中提取得到的一种水溶性色素,属花色苷类,具有良好的热稳定性和耐光性,用途广泛[9-10]。本实验从干燥火棘果中提取火棘果红色素,采用C18Sep-Pak柱对提取物进行初步纯化,并研究纯化产物的抗氧化活性,以期为火棘果红色素的开发利用提供基础。
1 材料与方法
1.1 材料与试剂
天然火棘果,江苏大学校园内采集,经鉴定为蔷薇科火棘属植物火棘Pyracantha fortuneana的果实,于通风处阴干后,用烘箱烘干,并保存于干燥器中备用。
1,1-二苯基-2-三硝基苯肼(DPPH)、福林-酚试剂(FC)美国Sigma公司;双氧水、水杨酸、氯化钾、醋酸钠、浓盐酸、蒽酮、浓硫酸、硫酸亚铁、三羟甲基氨基甲烷、邻苯三酚、无水乙醇、冰醋酸等均为分析纯 上海国药集团化学试剂有限公司。
1.2 仪器与设备
C18Sep-Pak柱 美国Waters公司;BS 124S分析天平北京赛多利斯仪器有限公司;DHG-9140A型电热恒温鼓风干燥箱 上海一恒科学仪器有限公司;VIS-7220可见分光光度计 北京瑞利分析仪器公司;TU-1800紫外-可见分光光度计 北京普析通用仪器有限责任公司;UV-2450型紫外-可见分光光度计 日本岛津公司;RE-52C旋转蒸发器 巩义市予华仪器有限责任公司;SHZ-D(Ⅲ)循环水式真空泵 巩义市英峪予华仪器有限责任公司。
1.3 方法
1.3.1 火棘果红色素的提取及纯化
1.3.1.1 火棘果红色素提取[11]
干燥火棘果用70%乙醇(pH3,HCl)于温度40℃、物料比1:9(m/V)条件下,浸提3次,每次提取40min,过滤提取液,合并滤液,于50℃条件下减压浓缩,得火棘果红色素浸膏PFE(得率30.3%),4℃冰箱保存备用。
1.3.1.2 C18Sep-Pak柱纯化火棘果红色素[12]
C18Sep-Pak柱用10mL甲醇活化后,用含0.01%盐酸的水溶液平衡。取1.0g PFE用含0.01%盐酸的水溶液溶解后,上样,用约2000mL的0.01%的酸水洗脱,流出液弃去。用甲醇将富集在C18Sep-Pak柱上的色素洗脱至无色。收集的甲醇洗脱液,于30℃浓缩至干后,即得纯化产物PPFE(得率0.55%),4℃冰箱保存备用。
1.3.2 火棘果中活性成分的含量测定
分别称取10g PFE及1g PPFE,用蒸馏水定容至100mL后用于花色苷、总酚及总糖含量的测定。
1.3.2.1 花色苷含量测定
采用pH示差法[13]测定提取物花色苷含量。准确吸取PFE及PPFE水溶液各1mL,分别用pH1.0和pH4.5的缓冲液定容至10mL,并分别平衡50min和80min,以蒸馏水作空白,测定其在530nm和700nm波长处的吸光度,按式(1)计算花色苷含量。

式中:A=(A530nm-A700nm)pH1.0-(A530nm-A700nm)pH4.5;ε为为矢车菊花素-3-葡萄糖苷的消光系数(26900L/(cm·mol));DF为稀释因子;Mw为矢车菊花素-3-葡萄糖苷的相对分子质量(449.4);V为最终体积/mL;m为产品质量/mg;L为光程(1cm)。
1.3.2.2 总酚含量测定
采用福林-肖卡尔法(FC法)[14]。精密称取105℃干燥至恒质量的没食子酸10mg,用蒸馏水溶解并定容到10mL。精密吸取没食子酸溶液0.1、0.25、0.5、0.75、1mL于25mL容量瓶中,加蒸馏水定容,配成10、25、50、75、100 g/mL不同质量浓度的没食子酸标准溶液。准确吸取1mL不同质量浓度的没食子酸溶液,加入1.0mL 0.1mol/L FC试剂,充分混匀后,放置5min,再加入1.5mL 7.5g/100mL Na2CO3溶液,混匀后,显色反应2h,于765nm波长处测定吸光度,另以蒸馏水代替样品液作为空白对照。以没食子酸质量浓度为横坐标,吸光度为纵坐标,制作标准曲线。得到没食子酸的标准曲线方程为:y= 0.0344x+0.0968(R2=0.9986)。
准确吸取PFE及PPFE溶液1.0mL,按照上述方法,于765nm波长处测定样品液的吸光度,根据标准曲线,以每100g样品中没食子酸的毫克数计算总酚的含量。
1.3.2.3 总糖含量测定
总糖含量测定采用蒽酮比色法[15]。标准曲线的绘制:配制质量浓度为0、10、20、30、40、60、80 g/mL的系列葡萄糖标准溶液,取1.0mL试液放入具塞试管中,加入蒽酮试剂4.0mL,迅速浸于冰水浴中冷却,各管加完后一起浸入沸水浴中10min,取出,冰浴中冷却,在620nm波长处测定A,以不加样品为空白,以标准糖含量(μg)为横坐标,以吸光度A为纵坐标,绘标准曲线,得到葡萄糖的标准曲线方程为:y=0.0118x-0.007(R2=0.9998)。
样品测定:配制质量浓度为0.2mg/mL的PFE及PPFE水溶解,按上述方法进行操作,测定其在620nm波长处的A,代入标准曲线以每100g样品中葡萄糖的含量按式(2)计算计算总糖含量。

式中:C为含糖量/ g;m为样品质量/g;V总为样品总体积/mL;V测为测定样品体积/mL;n为稀释倍数。
1.3.3 PPFE体外抗氧化活性测定
1.3.3.1 清除·OH的能力测定[16-17]
利用H2O2与Fe2+混合发生Fenton反应,生成具有很高反应活性的·OH,在体系内加入水杨酸捕捉·OH并产生有色产物,该物质在510nm波长处有最大吸收。抗氧化剂加入后,与水杨酸竞争,从而使有色产物生成量减少,减弱产物在波长510nm处的吸收峰。
依次将6mmol/L的FeSO4溶液、样品溶液、H2O2溶液各2mL加入试管中,摇匀,静置10min;加入6mmol/L水杨酸2mL,摇匀,静置30min,于510nm波长处测定吸光度,以抗坏血酸(VC)作为阳性对照。样品溶液为色素溶液时测得的吸光度为Ai,样品溶液为蒸馏水时测得的吸光度为A0,用蒸馏水代替水杨酸测得的吸光度为Aj。按照式(3)计算清除率。
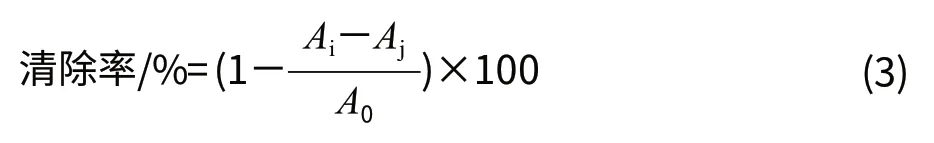
取0.05mol/L的Tris-HCl缓冲液(pH8.2)4.5mL,25℃水浴中预热20min,依次加入样品溶液和0.4mmol/L邻苯三酚溶液各1mL,混匀,于25℃水浴中反应5min,加入8mol/L的HCl溶液1mL,以Tris-HCl缓冲液作为参比,于325nm波长处测定其吸光度,以VC作为阳性对照。样品溶液为色素溶液时测得的吸光度(Ai),样品溶液为蒸馏水时测得的吸光度(A0),用蒸馏水代替邻苯三酚溶液测得的吸光度为Aj。按照式(4)计算清除率。

1.3.3.3 清除DPPH自由基的能力测定[20-21]
取样品溶液2mL于试管中,加入2×10-4mol/L的DPPH乙醇溶液2mL,混匀,暗处反应30min后于517nm波长处测定其吸光度,以VC作为阳性对照。样品溶液为色素溶液时测得的吸光度为Ai,样品溶液为蒸馏水时测得的吸光度为A0,用乙醇代替DPPH乙醇溶液测得的吸光度为Aj。按照式(5)计算清除率。
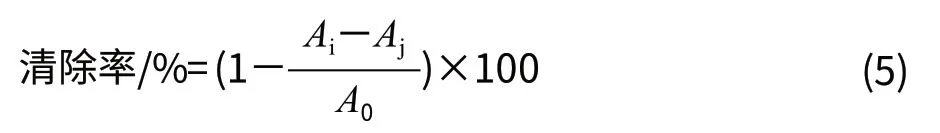
1.4 数据处理
平行实验为3次重复,数据处理采用软件SPSS 16.0版(SPSS Inc., Chicago, USA)ANOVA统计分析,数据用±s表示。
2 结果与分析
2.1 PFE及PPFE中花色苷、总酚及总糖含量
图1为pH3条件下火棘果红色素提取液的吸收光谱,在400~800nm波长范围内火棘果红色素提取液在530nm和656nm波长处有吸收峰,其中530nm波长处的吸收峰为火棘果红色素的吸收峰。
PFE、PPFE中花色苷、总酚及总糖含量如表1所示。火棘果红色素提取液通过C18Sep-Pak柱后,花色苷及总酚含量增高,总糖未检出,表明C18Sep-Pak柱除糖效果好,且具有富集花色苷和总酚的作用。
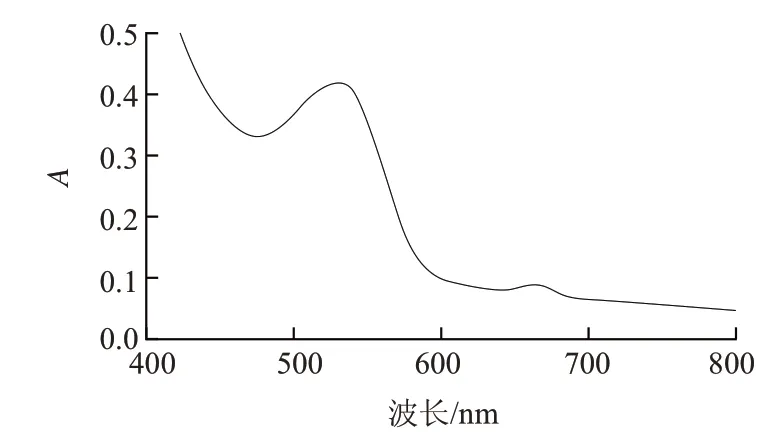
图1 火棘果红色素提取液的吸收光谱图(400~800nm)Fig.1 Absorption spectrum of pyracantha red pigment (400 to 800 nm)

表1 PFE、PPFE中花色苷、总酚及总糖含量Table 1 Contents of anthocyanins, total phenols and total sugar in the crude extract and the purified product
2.2 PPFE体外抗氧化活性
2.2.1 清除·OH能力
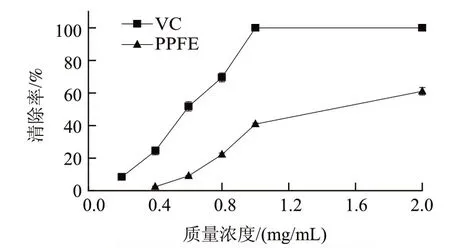
图2 PPFE的·OH清除活性Fig.2 Radical scavenging capacity of the purified red pigments on hydroxyl free radical
由图2可知,随着PPFE和VC质量浓度的增大清除效果逐渐增强,在质量浓度为2.0mg/mL时,PPFE和VC的清除率分别为61.04%、100%;在该体系中的半抑制质量浓度IC50分别为1.43mg/mL和0.43mg/mL。

图3 PPFE的 ·清除活性Fig.3 Radical scavenging capacity of the purified red pigments on superoxide anion free radical
由图3可知,清除率随着PPFE和VC质量浓度的增加而增大,但PPFE清除率变化幅度小于VC,PPFE和VC在该体系中的半抑制质量浓度IC50分别为3.13mg/mL和0.22mg/mL。
2.2.3 清除DPPH自由基能力
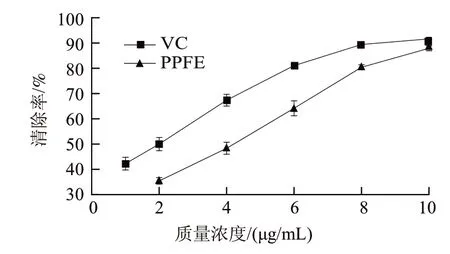
图4 PPFE的DPPH自由基清除活性Fig.4 Radical scavenging capacity of the purified red pigments on DPPH free radical
由图4可知,清除率随着PPFE和VC质量浓度的增加而增大,在相同质量浓度时,PPFE的清除率略低于VC。PPFE和VC在该体系中的半抑制质量浓度IC50分别为3.43 g/mL和1.67 g/mL。
3 结 论
在本实验条件下,火棘果红色素粗提物中花色苷含量为1.16mg/100g、总酚含量为2.18mg/100g、总糖含量为1095.34mg/100g;通过C18Sep-Pak柱纯化后,花色苷含量增高至20.61mg/100g,总酚含量增高至48.62mg/100g,总糖未检出,说明C18Sep-Pak柱除糖效果好,且具有富集花色苷和总酚的作用。抗氧化活性测定结果表明,火棘果红色素纯化物对DPPH自由基、·OH与·均有较强的清除作用,尤以对DPPH自由基的清除作用最强。
[1]蒋利华, 熊远福, 李霞, 等.野生火棘果有效成分研究进展[J].中国野生植物资源, 2007, 26(2): 8-10.
[2]叶萌, 杨灌英.我国火棘资源研究现状及展望[J].四川林业科技,1999, 20(1): 59-63.
[3]牟君富, 王树平.红子果实营养成分含量变化及其利用研究[J].西南农业学报, 1992, 5(3): 42-47.
[4]AZEVEDO J, FERNANDE I, FARIA A, et al.Antioxidant properties of anthocyanidins, anthocyanidin-3-glucosides and respective portisins[J].Food Chemistry, 2010, 119: 518-523.
[5]SUN C D, ZHENG Y X, CHEN Q J, et al.Purification and antitumour activity of cyanidin-3-O-glucoside from Chinese bayberry fruit[J].Food Chemistry, 2012, 131: 1287-1294.
[6]崔文新, 耿越, 王凤芹, 等.几种天然食用色素抗氧化作用研究[J].食品科学, 2008, 29(4): 401-404.
[7]YANG X L, YANG L, ZHENG H Y.Hypolipidemic and antioxidant effects of mulberry (MorusalbaL.) fruit in hyperlipidaemia rats[J].Food and Chemical Toxicology, 2010, 48: 2374-2379.
[8]季更生, 曹阳, 朱嫦, 等.桑葚红色素的研究现状与进展[J].安徽农业科学, 2007, 35(28): 8777-8778.
[9]蒋利华, 熊远福, 李霞, 等.野生火棘果中红色素的提取研究[J].中国食品添剂, 2007(1): 58-61.
[10]梅兴国, 万国晖, 周忠强.火棘果化学成分研究[J].中药材, 2002,25(5): 329-330.
[11]程超, 莫开菊, 汪兴平.天然水溶性火棘色素在不同环境条件下的稳定性研究[J].食品科学, 2005, 26(3): 72-74.
[12]MACZ-POP G A, RIVAS-GONZALO J C, PEREZ-ALONSO J J, et al.Natural occurrence of free anthocyanin aglycones in beans(Phaseolus vulgarisL.)[J].Food Chemistry, 2006, 94(3): 448-456.
[13]HOSSEINIAN fS, LI W D, BETA T.Measurement of anthocyanins and other phytochemicals in purple wheat[J].Food Chemistry, 2008,109(4): 916-924.
[14]ALONSO A M, GUILLEN D A, BARROSO C G, et al.Determination of antioxidant activity of wine byproducts and its correlation with polyphenolic content[J].Food Chemistry, 2002, 50(21): 5832-5836.
[15]汤灿辉, 彭新君, 文礼章, 等.蒽酮-硫酸比色法测定三叶虫茶中总糖的含量[J].湖南中医药大学学报, 2008, 28(5): 38-40.
[16]马勇, 邵立新.人参花蕾提取液清除羟基自由基作用研究[J].食品科学, 2008, 29(10): 101-104.
[17]杨方美, 王林, 胡秋辉.鼠尾藻多糖的制备及其抗氧化活性[J].食品科学, 2005, 26(2): 224-227.
[18]王川.葡萄籽单宁的抗氧化性研究[J].食品科技, 2009, 34(2): 184-187.
[19]QUETTIER-DELEU C, GRESSIER B, VASSEUR J, et al.Phenolic compounds and antioxidant activities of buckwheat(Fagopyrum esculentumMoench) hulls and flour[J].Journal of Ethnopharmacology,2000, 72(1/2): 35-42.
[20]盛玮, 吴灵玮, 谢笔钧.黑糯玉米芯色素的抗氧化活性研究[J].中国粮油学报, 2008, 23(6): 85-88.
[21]刘平怀, 汪春牛, 陈德力, 等.DPPH法测定青皮加速溶剂萃取提取物的抗氧化活性[J].中国实验方剂学杂志, 2011, 17(21): 69-73.
