牙鲆有丝分裂雌核发育二倍体的遗传特性分析
2013-02-08许丹丹刘永新王桂兴刘奕王玉芬刘海金
许丹丹,刘永新,王桂兴,刘奕,王玉芬,刘海金、
(1.上海海洋大学水产与生命学院,上海201306;2.中国水产科学研究院,北京100039;3.中国水产科学研究院北戴河中心实验站,河北秦皇岛066100;4.东北农业大学动物科学技术学院,黑龙江哈尔滨 150030)
牙鲆有丝分裂雌核发育二倍体的遗传特性分析
许丹丹1、3,刘永新2,王桂兴3,刘奕4,王玉芬3,刘海金2、3
(1.上海海洋大学水产与生命学院,上海201306;2.中国水产科学研究院,北京100039;3.中国水产科学研究院北戴河中心实验站,河北秦皇岛066100;4.东北农业大学动物科学技术学院,黑龙江哈尔滨 150030)
对牙鲆Paralichthys olivaceus有丝分裂雌核发育后代进行了遗传差异分析,并将其与同一母本的减数分裂雌核发育二倍体和普通二倍体进行了比较。结果表明:有丝分裂雌核发育二倍体可分为两部分,即纯合子 (Mitotic-A)和杂合子 (Mitotic-B);Mitotic-A、Mitotic-B、减数分裂雌核发育二倍体 (MGD)和牙鲆普通二倍体 (ND)的平均纯合度分别为1.000 0、0.328 4、0.252 1、0.183 3,4个群体的亲代与子代之间的平均遗传相似系数分别为0.707 1、0.874 8、0.894 0、0.660 2,子代个体间的平均遗传相似系数分别为0.546 0、0.792 1、0.836 6、0.675 9,这表明Mitotic-A 与Mitotic-B具有完全不同的遗传特征;Mitotic-B在poli110TUF、poli1906TUF位点纯合个体所占的比例较高 (34.10%、73.86%),而MGD在这两个位点全部表现为杂合 (0、0),Mitotic-B在 poli1490TUF、poli1498TUF位点纯合个体所占的比例较小(10.23%、9.66%),而MGD在这两个位点全部表现为纯合 (100%、100%),这说明诱导方式不同,重组交换的结果则不同。研究表明,Mitotic-B与MGD虽然都是杂合子,由于诱导方式不同,导致其遗传特征也不同。
牙鲆;有丝分裂雌核发育;减数分裂雌核发育;微卫星;杂合子
牙鲆Paralichthys olivaceus是中国海水养殖中占有重要地位的经济鱼类。中国于20世纪90年代开始人工养殖牙鲆,对牙鲆的相关研究取得了一定的成果[1-2]。关于牙鲆雌核发育的研究,国内外均有相关报道[3-8]。日本学者 Yamamoto[3]曾利用有丝分裂雌核发育技术成功克隆出牙鲆。
诱导有丝分裂雌核发育是通过抑制第一次卵裂而形成,其染色体组中一条染色体是以另一条为模板复制而成,遗传组成在理论上为纯合,但是在诱导有丝分裂雌核发育的后代检测中发现,除纯合子(Mitotic-A)存在外,还有部分杂合子 (Mitotic-B)的存在[4-5]。朱晓琛等[6]利用微卫星鉴定了有丝分裂雌核发育牙鲆幼体的纯合性;季旭等[7]用亲子鉴定的方法对数尾纯合子进行了家系鉴别;刘海金等[5,8]用微卫星标记比较了有丝分裂雌核发育牙鲆与减数分裂雌核发育二倍体的遗传差异。但是,迄今未见关于有丝分裂雌核发育中杂合子群体遗传特征的报道。本研究中,作者利用微卫星标记比较有丝分裂雌核发育中Mitotic-B与减数分裂雌核发育二倍体 (meiotic gynogenetic diploid,MGD)的遗传差异,并与Mitotic-A和普通二倍体 (normal diploid,ND)进行比较,旨在为分析有丝分裂雌核发育的遗传特性以及Mitotic-B在育种上的利用提供基础材料和遗传学依据。
1 材料与方法
1.1 材料
利用同一尾牙鲆亲鱼的卵子,分别对其诱导减数分裂和有丝分裂雌核发育,雌核发育诱导参照刘海金等[8]的方法。同时,以同一亲本的卵子与一尾普通牙鲆的精子人工授精,制备普通二倍体作为对照组。分别剪取牙鲆亲本及减数分裂雌核发育30尾个体、普通二倍体30尾个体、有丝分裂雌核发育280尾个体的胸鳍鳍条,用于遗传特征分析。
1.2 方法
1.2.1 基因组DNA的提取 DNA提取参照Salah等[9]的方法略有改动。将剪碎的胸鳍置于400 μL裂解液 [100 mmol/L NaCl,50 mmol/L Tris-HCl,20 mmol/L EDTA(pH 8.0),1%SDS,200 mg/L的蛋白酶K]中,于50℃下消化3 h至澄清,用等体积的饱和酚-氯仿混合液抽提一次,用等体积的异丙醇沉淀,再用体积分数为75%的乙醇清洗沉淀,用TE溶解后,于冰箱 (-20℃)中保存备用。
1.2.2 微卫星引物 从 Castaño-Sánchez 等[10]绘制的牙鲆二代遗传连锁图谱中选取48个位于连锁群端部区域的微卫星标记,每个连锁群各选取两个标记,获得微卫星引物序列。由上海生工生物工程技术服务有限公司合成,合成规格为3OD。引物名称、引物序列、退火温度、连锁群等见表1。
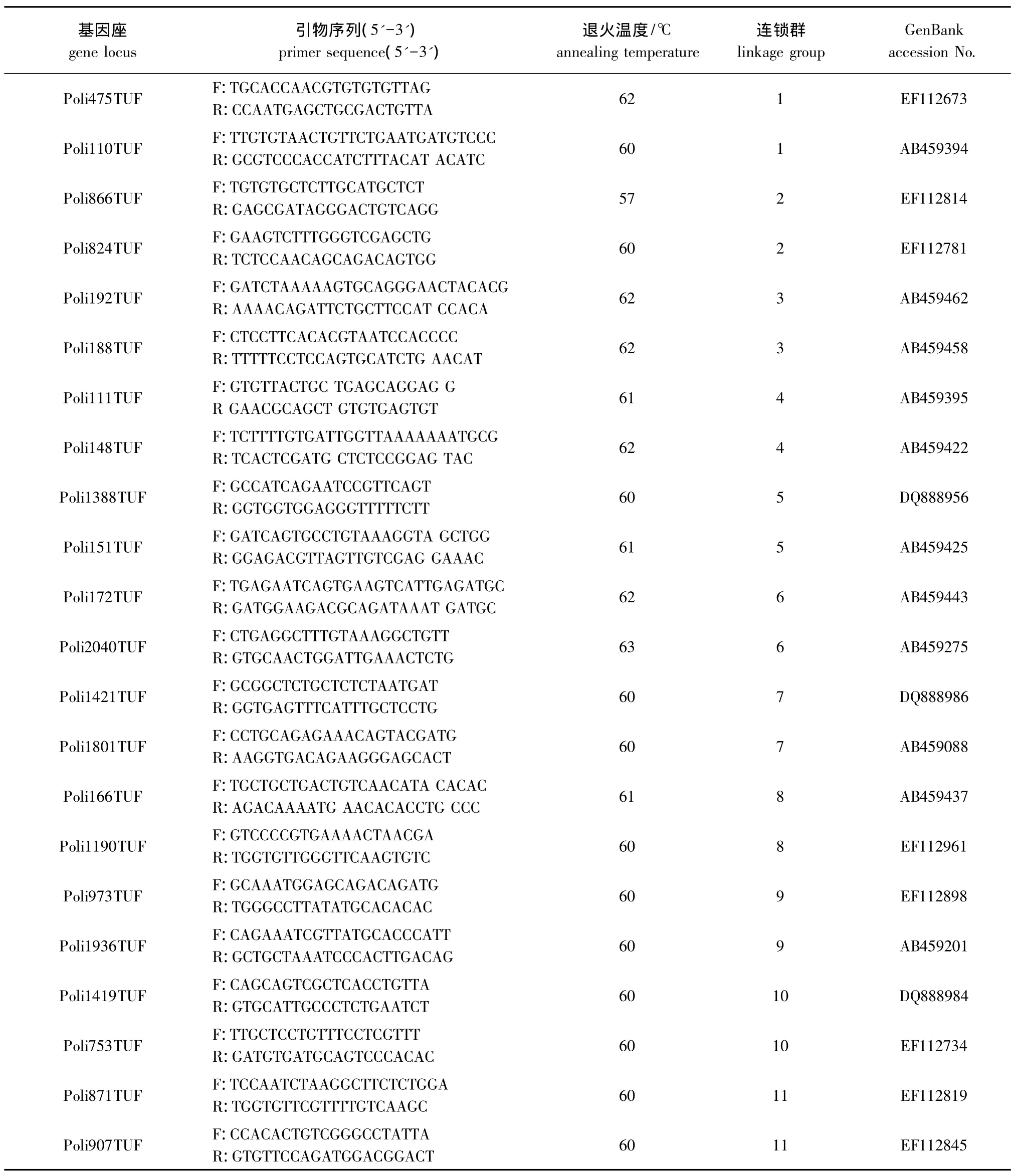
表1 引物序列、特异退火温度和连锁群Tab.1 The sequence of microsatellite primers,specific annealing temperature and linkage group in the experiment
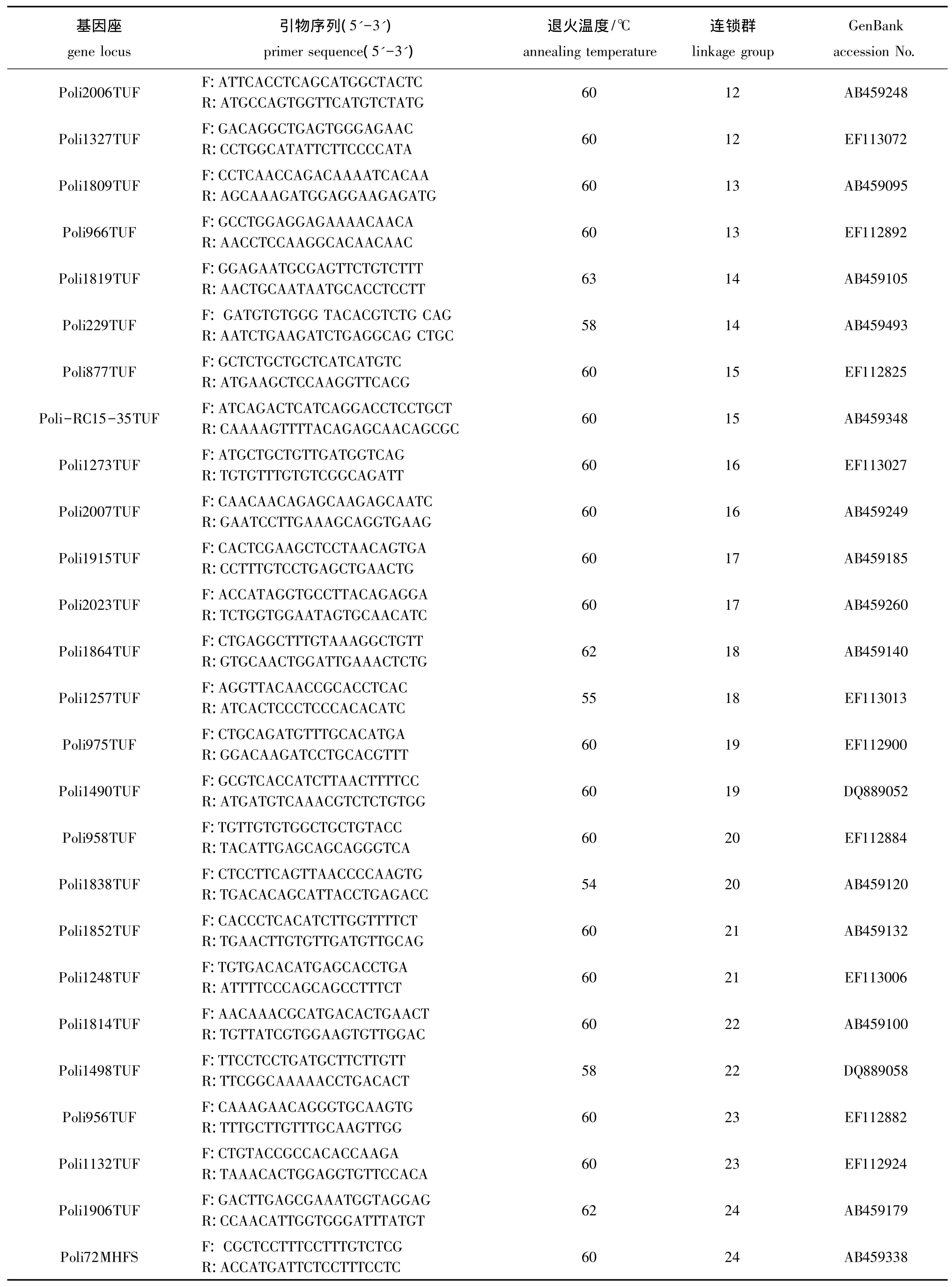
续表1 引物序列、特异退火温度和连锁群Cont.Tab.1 The sequence of microsatellite primers,specific annealing temperature and linkage group in the experiment
1.2.3 PCR和电泳 PCR反应体系共15 μL,包括 10 ×Buffer 2.5 μL,25 mmol/L Mg2+1 μL,2 mmol/L dNTPs 1 μL,10 mmol/L上、下游引物各0.6 μL,模板 1 μL(30 ~ 50 ng),Taq DNA 聚合酶1 U,用ddH2O补至15 μL。
PCR反应程序为:94℃下预变性3 min;94℃下变性30 s,54~63℃下退火30 s,72℃下延伸30 s,共进行25个循环;最后在72℃下延伸10 min。PCR扩增产物用8%非变性聚丙烯酰胺凝胶进行电泳检测,用1%的硝酸银染色10 min,显色液 (1% 甲醛,2%氢氧化钠,0.04%无水碳酸钠,均为体积分数)显色10 min。凝胶在HP scanjet G4010扫描仪上成像,用Gel-Pro Analyzer 4.5软件对电泳谱带进行分析。
1.3 数据处理
分析电泳图,将电泳条带为1条的检测个体在该位点视为纯合,电泳条带为2条的个体在该位点视为杂合[11],然后分别统计各个位点的杂合子比例。用PopGene 3.2软件统计各微卫星基因座的等位基因数 (Na)、有效等位基因数 (Ne)、群体纯合度 (Ho)、群体杂合度 (He)、多态性信息含量(PIC),以及亲本与子代和子代与子代之间的遗传相似系数 (GSI)。
2 结果与分析
2.1 微卫星分析
利用48对引物分别对Mitotic-A、Mitotic-B、MGD和ND群体进行分析,结果表明,在有丝分裂雌核发育280尾牙鲆群体中,104尾牙鲆在所检测的48个位点全部纯合,176尾牙鲆在48个位点部分纯合。由表2可见:从Mitotic-A中随机选取30尾个体进行分析,Mitotic-A在所检测的48个位点都表现为纯合;Mitotic-B在每个位点均有纯合的个体存在,但不存在全部位点均纯合的个体,故称之为“杂合子”,其中纯合个体所占比例最多的位点为 poli1421TUF(171/176),最少的为 poli1819TUF(13/176);MGD在30个位点表现为全部杂合,在其他位点存在不同数量纯合的个体,与有丝分裂雌核发育二倍体明显不同;ND仅有个别位点纯合的个体,不存在全部位点均纯合的个体。Mitotic-B在poli110TUF、poli1906TUF位点纯合个体所占的比例较高 (34.10%、73.86%),而MGD在这两个位点全部表现为杂合 (0、0);Mitotic-B在poli1490TUF、poli1498TUF位点纯合个体所占的比例较低 (10.23%、9.66%),而MGD在这两个位点全部表现为纯合 (100%、100%)。这一现象说明,尽管二者出自同一亲本,但是在同一位点表现出的纯合性却明显不同,说明有丝分裂雌核发育与减数分裂雌核发育二倍体具有不同的遗传特性。
2.2 4个群体的遗传多样性
从表3可见:ND群体的平均 Na、平均 Ne、平均 He、平 均 PIC 分别 为 2.979 2、2.719 9、0.816 7、0.524 0,均比雌核发育群体的高,平均Ho为0.183 3,比雌核发育群体的低;Mitotic-B的平均Ho为0.328 4,比MGD群体的高;Mitotic-B与Mitotic-A的Na、Ne、PIC含量基本相近,但二者的纯合度则相差较大。因此,Mitotic-A是一个纯合子,而Mitotic-B是一种比MGD纯合度高的杂合子。
2.3 4个群体的遗传相似系数
4个群体的亲本与子代、子代与子代之间的遗传相似系数统计结果显示 (表4):Mitotic-A的亲本与子代的遗传相似系数为0.707 1,反映出雌核发育的特征,即固定母本性状的作用;子代之间的遗传相似系数仅为0.546 0,反映出每一个Mitotic-A都具有一套独立的基因组,互不相同的特点,故相似度低。Mitotic-B的亲本与子代、子代与子代之间遗传相似系数分别为0.874 8、0.792 1,均比Mitotic-A高,与其杂合度高相一致。ND群体的亲本与子代之间的遗传相似系数均比雌核发育的低,由此表明,ND群体与雌核发育的遗传特征显著不同。
3 讨论
为了避免不同亲本对诱导雌核发育所产生遗传差异的影响,本研究中将同一尾亲鱼的同一批卵子分成3部分,同时制备了两种雌核发育和一种正常受精的子代,以便于进行相同遗传背景下的比较。在280尾有丝分裂雌核发育二倍体中,有104尾(占37%)为Mitotic-A,有176尾为 Mitotic-B,说明两种群体的纯合度不同,遗传特征不同。同一尾母本,同一批卵子,诱导方法相同却出现两种不同的纯合度,这可能是由其他方面的原因造成的,其成因有待于进一步研究。
关于有丝分裂雌核发育牙鲆的纯合性,刘海金等[8]报道了有丝分裂雌核发育与减数分裂雌核发
育二倍体的区别,在有丝分裂雌核发育的后代检测中发现有部分杂合个体的存在[4-5],提出有丝分裂雌核发育二倍体中杂合子的比例存在变化问题[5,12],但是,对于其杂合子的遗传特征却没有讨论。本研究中,把没有杂合位点的个体称为纯合子,而把具有杂合位点的个体称为杂合子。将有丝分裂雌核发育中出现的杂合子与减数分裂雌核发育二倍体进行比较,Mitotic-B与MGD虽然都是杂合子,但是由于诱导方式不同,获得杂合位点不同,纯合度不同,遗传相似系数亦不相同,最后反映出二者的遗传特征不同。本研究结果表明,虽用同一母本,但有丝分裂雌核发育杂合子与减数分裂雌核发育二倍体的遗传特性不同,呈现以下特点:1)Mitotic-B与MGD的纯合度不同,Mitotic-B的纯合度为0.328 4,MGD为0.252 1。2)在同一位点上纯合程度也不同,有的甚至全部表现为杂合,如Mitotic-B在poli110TUF、poli1906TUF位点纯合个体所占的比例较高 (34.10%、73.86%),而MGD在这两个位点均表现为杂合;Mitotic-B在poli1490TUF、poli1498TUF位点纯合个体所占的比例较低 (10.23%、9.66%),而MGD在这两个位点均表现为纯合。3)Mitotic-B的亲代与子代之间的遗传相似系数比MGD低。究其原因,可能是由于减数分裂雌核发育是通过抑制第二极体排出而形成,其染色体组由雌性原核和第二极体构成;而有丝分裂雌核发育则是通过抑制第一次卵裂而形成,可能是受某种影响而形成杂合,其染色体组的构成与减数分裂不同。

表4 4个群体亲本与子代以及子代与子代之间的遗传相似系数Tab.4 Genetic similarity between parents and offsprings and among offsprings in the four groups
有关杂合子出现的原因,可能是因为卵子发育具有不同步现象,在进行有丝分裂雌核发育的过程中,当施加静水压力使染色体加倍时,某些延迟发育的卵子仍处在减数分裂期,从而静水压抑制了第二极体排出而不是抑制第一次卵裂,形成了减数分裂雌核发育[5]。Komen等[4]也认为,杂合子的出现可能与受精的时间和卵子发育在物理上的不同步有关。另一方面,静水压处理的副作用与卵子的质量和发育状态也是影响雌核发育诱导效果的重要因素。对于有丝分裂雌核发育二倍体中出现杂合子的现象,除了诱导条件、时机等外源因素外,亲本的遗传差异也可能对杂合子的形成产生影响[13],一方面影响杂合位点组成,另一方面影响杂合位点的比例,即杂合度。目前,关于有丝分裂雌核发育的成功事例不多,对其有数据支持的论证分析还很少。可以推想,随着诱导有丝分裂雌核发育的成功率逐渐提高,对其纯合和杂合的认识将会更加全面和准确。
诱导有丝分裂雌核发育是获得牙鲆纯系的一种有效方法,可为获得克隆牙鲆的亲本奠定基础。然而,在利用有丝分裂雌核发育个体作为克隆亲本之前,需要分别检测其个体的纯合性,如不加区分地诱导,也不可能全部成为克隆。有关有丝分裂雌核发育杂合子产生的具体原因是一个亟待解决的问题,需要进一步深入研究。
[1] 陈晓婷,刘海金,刘奕,等.牙鲆第10腹椎骨与微卫星标记的相关性分析[J].大连海洋大学学报,2013,28(4):367-372.
[2] 王琨,孙云章,李富东,等.饲料中添加两种寡糖和一种芽孢杆菌对牙鲆肠道菌群的影响[J].大连海洋大学学报,2011,26(4):299-305.
[3] Yamamoto E.Studies on sex manipulation and production of cloned population in hirame,Paralichthys olivaceus(Temminck et Schlegel)[J].Aquaculture,1999,173:235-246.
[4] Komen H,Thorgaard G H.Androgenesis,gynogenesis and the production of clones in fishes:a review[J].Aquaculture,2007,269(1/4):150-173.
[5] 刘海金,陆桂,刘永新,等.有丝分裂雌核发育牙鲆的微卫星鉴定[J].中国水产科学,2010,17(5):889-894.
[6] 朱晓琛,刘海金,孙效文,等.微卫星评价牙鲆雌核发育二倍体纯合性[J].动物学研究,2006,27(1):63-67.
[7] 季旭,孙效文,杨立更,等.微卫星标记对牙鲆有丝分裂雌核发育家系的亲子鉴定[J].动物学研究,2008,29(1):25-30.
[8] 刘海金,刘永新,张晓彦,等.牙鲆减数分裂与有丝分裂雌核发育的遗传差异[J].水产学报,2010,34(6):898-904.
[9] Salah A,Martinez I.Universal and rapid salt extraction of high quality genomic DNA for PCR-based techniques[J].Nucl Acids Res,1997,25(22):4692-4693.
[10] Castaño-Sánchez C,Fuji K,Ozaki A,et al.A second generation genetic linkage map of Japanese flounder(Paralichthys olivaceus)[J].BMC Genomics,2010,11:554-565.
[11] Crooijmans R,Poel J,Groenen M A M,et al.Microsatellite markers in common carp(Cyprinus carpio L.)[J].Anim Genet,1997,28(2):129-134.
[12] Bertotto D,Cepollaro F,Libertini A,et al.Production of clonal founders in the European sea bass,Dicentrarchus labrax L.,by mitotic gynogenesis[J].Aquaculture,2005,246:115-124.
[13] 孙效文,张研,季旭,等.鲤和牙鲆的两种雌核发育子代的基因型分析[J].水产学报,2008,32(4):545-555.
The genetic characteristics of mitotic gynogenesis diploid in Japanese flounderParalichthysolivaceus
XU Dan-dan1,3,LIU Yong-xin2,WANG Gui-xing3,LIU-Yi4,WANG Yu-fen3,LIU Hai-jin2,3
(1.College of Fisheries and Life Science,Shanghai Ocean University,Shanghai 201306,China;2.Chinese Academy of Fishery Sciences,Beijing 100039,China;3.Beidaihe Central Experiment Station,Chinese Academy of Fishery Sciences,Qinhuangdao 066100,China;4.Animal Science and Technology College,Northeast Agricultural University,Harbin 150030,China)
The genetic characteristics were compared between meiosis gynogenetic diploid(MGD)and normal diploid(ND)of Japanese flounderParalichthys olivaceususing microsatellite marker.The results showed that the offsprings of mitotic gynogenesis were divided into homozygote(Mitotic-A)diploids and heterozygote(Mitotic-B)diploids.There was average homozygosity of 1.000 0 in Mitotic-A,0.328 4 in Mitotic-B,0.252 1 in MGD and 0.183 3 in ND.The genetic similarity between the parents and progenies were found to be 0.707 1 in Mitotic-A,0.874 8 in Mitotic-B,0.894 0 in MGD and 0.660 2 in ND.The genetic similarity among progenies was shown to be 0.546 0 in Mitotic-A,0.792 1 in Mitotic-B,0.836 6 in MGD,and 0.675 9 in ND,indicating that there are significant differences in genetic characteristics between the Mitotic-A and Mitotic-B.The proportion of homozygous individuals was 34.10%in Mitotic-B and 73.86%at the poli110TUF and poli1906TUF loci,but 0 in MGD and 0 performance for heterozygosis completely.The homozygous individuals were found to represent 10.23%in Mitotic-B and 9.66%in the poli1490TUF and poli1498TUF loci,but to account for 100%in MGD and 100%performance for homozygosis completely.The findings show that there are different induction and information exchange approaches in Mitotic-B and MGD.
Paralichthys olivaceus;mitotic gynogenesis;meiosis gynogenesis;microsatellite marker;heterozygote
S917
A
2095-1388(2013)06-0542-07
2013-04-18
国家鲆鲽类产业技术体系专项 (CARS-50-G2);国家公益性农业行业专项 (200903046)
许丹丹 (1986-),女,硕士研究生。E-mail:xudandan25@163.com
刘海金 (1951-),男,研究员,博士生导师。E-mail:liuhaijin2005@126.com
