老年慢性阻塞性肺疾病患者淋巴细胞对肺炎链球菌荚膜多糖的反应能力
2013-02-01孙仁华浙江省人民医院ICU浙江杭州3004
陈 许 孙仁华 韩 芳 黄 瑾(浙江省人民医院ICU,浙江 杭州 3004)
老年慢性阻塞性肺疾病患者淋巴细胞对肺炎链球菌荚膜多糖的反应能力
陈 许 孙仁华 韩 芳 黄 瑾1(浙江省人民医院ICU,浙江 杭州 310014)
目的分析慢性阻塞性肺疾病(COPD)老年人体外培养的淋巴细胞在肺炎链球菌荚膜多糖干预环境下活化情况。方法研究对象分为老年COPD,健康老年,健康年轻3组,分离外周单个核细胞以PPV23干预培养,流式细胞技术检测CD3+细胞、CD19+细胞表面CD69表达。结果健康年轻组淋巴细胞对荚膜多糖抗原干预有显著反应,健康老年组T、B淋巴细胞及老年COPD组B淋巴细胞对多糖抗原干预无反应,老年COPD组T淋巴细胞对多糖抗原反应与健康年轻人组相反。结论CD69为标志的各组人群T、B淋巴细胞对肺炎链球菌抗原刺激的反应能力不同,COPD老年人及健康老年人进行PPV23免疫后难以产生同健康年轻人相当的免疫效果。
慢性阻塞性肺疾病;肺炎链球菌荚膜多糖疫苗;淋巴细胞;CD69
慢性阻塞性肺疾病(COPD)是多发于老年人的慢性疾病,异常免疫反应在其起病和进展中的作用越来越引起重视,在细胞因子多态性、miRNA表达、DNA甲基化等方面都可以发现衰老的免疫系统促进了COPD的发病〔1〕。CD69是一种Ⅱ型跨膜糖蛋白,在多种血细胞包括T、B淋巴细胞、NK细胞表面都有表达,在诸多研究中被作为细胞表面活化标志尤其是T、B淋巴细胞活化表面标志〔2〕。肺炎链球菌是COPD患者呼吸道感染常见的病原菌,荚膜多糖是其毒力因子。23价肺炎链球菌多糖疫苗(PPV23)由23个血清型的肺炎链球菌荚膜多糖组成,在老年人及慢性疾病包括COPD患者中,PPV23的效力和推荐一直存在争议〔3~6〕。本实验通过观察体外培养条件下老年 COPD患者肺炎链球菌致病因素干预下的免疫细胞活化情况,来探讨老年COPD免疫状态是否适合接受肺炎链球菌多糖疫苗免疫。
1 材料与方法
1.1 实验对象 我院住院部老年COPD急性发作期患者18例,男14例,女4例,74~81岁,平均(76.62±2.72)岁,符合中华医学会呼吸病协会制定的COPD诊断标准〔7〕。健康老年组14例,男9例,女5例,60~80岁,平均(68.71±8.79)岁;健康年轻组22例,男13例,女9例,21~49岁,平均(29.36±7.84)岁,健康老年及年轻组为医院体检健康者。排除标准:患有其他肺部疾病,严重的心功能不全,慢性肝、肾疾病,恶性肿瘤,自身免疫性疾病,先天性或获得性免疫缺陷,接受系统性免疫调节或免疫抑制治疗(包括口服糖皮质激素)。曾经注射过肺炎链球菌疫苗。近1个月内有感染性疾病病史。
1.2 主要试剂及仪器 23价肺炎链球菌多糖疫苗(PPV23)购自美国默沙东公司;淋巴细胞分离液(1.073 g/ml)购自天津灏洋生物制品科技有限责任公司;鼠抗人CD3-PerCP、鼠抗人CD19-PE、鼠抗人 CD69-FITC、小鼠 IgG1-FITC/小鼠抗人 IgG1-PE购自美国Becton Dickinson公司;完全培养基(CM)包括RPMI-1640(Gibco公司),小牛血清(杭州四季青公司),HEPES(MD公司),链毒素(100万 U/支,华北制药股份有限公司,青霉素(80万U/支哈药集团制药总厂),L-谷氨酰胺(MBCHEM公司)。24孔培养板为美国Corning公司出产;HERA Cell CO2培养箱为德国Heraeus公司出产;FACSCalibur型流式细胞仪为美国Becton Dickinson公司出产。
1.3 方法
1.3.1 外周单个核细胞的体外干预培养 肝素抗凝管取外周静脉血10 ml,D-Hank液稀释1倍。将稀释后静脉血加入淋巴细胞分离液液面上,1 800 r/min离心15 min。吸出灰白色云雾层细胞,D-Hank液1 000 r/min离心10 min洗涤2次,以完全培养基调整细胞悬液浓度为1×106/ml。依照预实验调整的浓度,取PPV23 100倍稀释,制成每1μl液体含疫苗0.01μl的稀释溶液。设抗原干预组及空白对照组,设复孔进行培养。含5%CO237℃培养箱培养12 h后,取细胞悬液检测。于抗原干预孔添加稀释疫苗溶液10μl,空白对照孔添加生理盐水10μl继续培养,分别于24及48 h后,检测相应细胞表面标志。
1.3.2 流式细胞技术检测CD3+细胞、CD19+细胞表面CD69表达 ①阴性对照管中加入小鼠抗人IgG1-FITC、小鼠抗人IgG1-PE单抗各20μl,测定管中加入鼠抗人CD3-PerCP、鼠抗人CD19-PE、鼠抗人CD69-FITC单抗各20μl。②加入待测细胞悬液100μl/管,混匀,室温避光孵育15min。③加入PBS2 ml,混匀,流式细胞仪CellQuest程序,检测10 000个细胞。④阴性对照管做FSC-SSC散点图,设门R1排除碎屑,再作IgG1-FITC/IgG1-PE散点图,设阴性对照十字门使其包括左下象限95%细胞。⑤测定管数据做FSC-SSC散点图,设门R2圈出淋巴细胞,再作CD3-PerCP/CD69-FITC散点图、鼠抗人 CD19-PE/CD69-FITC散点图,根据阴性对照统计CD3+CD69+细胞及CD19+CD69+细胞百分率。
1.4 统计学方法 采用SPSS16.0统计软件,数据为阳性细胞百分率,以±s表示。两组数据为正态分布及方差齐或者经转换后成为正态分布或者方差齐者,采用配对T检验,数据经过转换成为正态分布,转换后采用单因素方差分析(One-Way ANOVA),两两比较采用LSD方法。
2 结果
2.1 PBMC体外培养CD3+及CD69+细胞表面CD69表达率3组PBMC体外培养一段时间后,在疫苗干预前对淋巴细胞表面标志进行鉴定。与健康年轻组比较,健康老年组和老年COPD组CD3+及CD69+细胞表面CD69表达率明显降低(P<0.05,P <0.01),见表1。
2.2 PBMC疫苗干预培养24 h后CD3+及CD19+细胞表面CD69表达率 PBMC在疫苗干预培养24 h后,健康年轻组CD3+细胞表面CD69的表达疫苗干预组高于对照组(P<0.05)。健康老年组疫苗干预培养与对照相比CD3+细胞表面CD69表达无显著差异。老年COPD组CD3+细胞表面CD69的表达显著低于对照组(P<0.05)。CD19+细胞表面CD69的表达,健康年轻组疫苗干预组显著高于对照组(P<0.05)。PBMC多糖疫苗干预培养24 h后,健康老年组及老年COPD组疫苗干预培养与对照相比,CD19+细胞表面CD69表达无显著差异(P>0.05)。见表2。
2.3 PBMC疫苗干预培养48 h后CD3+及CD19+细胞表面CD69表达率 PBMC多糖疫苗干预培养48 h后,CD3+细胞表面CD69表达健康年轻组干预后显著高于对照组(P<0.05)。健康老年组疫苗干预与对照相比无统计学差异。老年COPD组疫苗干预显著低于对照组(P<0.01)。健康年轻组、健康老年组及老年COPD组疫苗干预与对照组相比,CD19+细胞表面CD69表达均无显著差异。见表3。
表1 疫苗刺激前细胞表面标志表达率(±s,%)
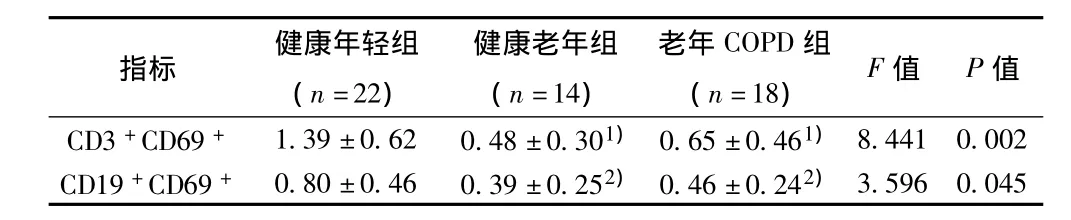
表1 疫苗刺激前细胞表面标志表达率(±s,%)
与健康年轻组比较:1)P<0.05,2)P<0.01
指标 健康年轻组(n=22)健康老年组(n=14)老年COPD组(n=18)F值 P值8.441 0.002 CD19+CD69+ 0.80±0.46 0.39±0.252) 0.46±0.242)CD3+CD69+ 1.39±0.62 0.48±0.301) 0.65±0.461)3.596 0.045
表2 疫苗干预培养24 h CD3+CD69+、CD19+CD69+细胞比率(±s,%)

表2 疫苗干预培养24 h CD3+CD69+、CD19+CD69+细胞比率(±s,%)
与对照组比较:1)P<0.05
组别 n CD3+CD69+对照组 干预组健康年轻组 22 0.59±0.31 0.64±0.361) 0.41±0.44 0.45±0.351)干预组CD19+CD69+对照组健康老年组 14 0.40±0.18 0.47±0.21 0.24±0.25 0.23±0.13老年COPD组18 0.64±0.41 0.55±0.361)0.23±0.27 0.30±0.34
表3 疫苗干预培养48 h CD3+CD69+、CD19+CD69+细胞比率(±s,%)

表3 疫苗干预培养48 h CD3+CD69+、CD19+CD69+细胞比率(±s,%)
与对照组比较:1)P<0.05;2)P<0.01
组别 n CD3+CD69+对照组 干预组健康年轻组 22 0.44±0.21 0.65±0.481)干预组CD19+CD69+对照组0.21±0.16 0.27±0.24健康老年组 14 0.48±0.27 0.42±0.39 0.48±0.27 0.42±0.39老年COPD组18 0.42±0.36 0.39±0.312)0.42±0.36 0.39±0.31
3 讨论
免疫衰老影响固有免疫细胞和适应性免疫细胞功能,老年人免疫功能出现一系列年龄相关的变化,NK细胞杀伤力降低,巨噬细胞和树突细胞数量和功能下降,同时初始T、B淋巴细胞数量减少,记忆性T、B淋巴细胞及效应性T、B淋巴细胞数目增多,增加感染性疾病的易感性和严重程度,同时也影响了老年人对疫苗的免疫反应〔8〕。同健康成年人相比,老年人对疫苗的免疫反应明显降低〔9〕。Goodwin等〔9〕对1986 ~2002 年间31项关于疫苗抗体反应的研究进行分析,发现老年人对流感疫苗的抗体反应显著低于年轻人,约70%~90%年轻人使用疫苗临床有效,而仅有17%~53%的老年人可以达到相同的临床效果。Rubins等〔10〕对老年人使用肺炎疫苗后抗体生成及活性的研究中,抽取大于65岁并合并稳定慢性疾病老年人及小于35岁健康年轻人,使用PPV23免疫后1个月及3个月后,对抗体活性及调理作用进行测定,大约20%老年人对某些血清型低反应,而几乎所有年轻人对疫苗都反应良好。
本文发现老年COPD患者T、B淋巴细胞体外培养活化程度低于年轻人,体现了老年人免疫细胞活性减低的状态。免疫状态处于正常的年轻人,PBMC在肺炎链球菌荚膜多糖刺激下体外培养24、48 h,多糖抗原干预组CD69+在CD3+细胞表面表达均超过对照组,符合CD69在T淋巴细胞活化早期表达的特征。CD69在CD19+细胞表面表达在24 h高于对照组,48 h同对照组无显著差异,证明免疫细胞功能处于正常状态的年轻人,B淋巴细胞对多糖抗原共培养早期有反应,而24 h之后则检测不出。多糖抗原对CD69在健康老年人CD3+细胞及CD19+细胞表面的表达均未发现有影响,干预组和对照组相比CD3+CD69+细胞及CD19+CD69+细胞比率亦无显著差别。随着年龄增长,免疫细胞对疫苗抗原的反应消失,免疫细胞对该疫苗抗原的作用处于惰性状态,这与一部分老年人对疫苗处于无应答状态相符合。本文表明COPD老年人T淋巴细胞的活化程度在早期24 h受到了多糖抗原的影响,但是与多糖抗原对健康年轻人也就是免疫力正常人的影响方向是相反的,并且未患COPD的老年人T淋巴细胞在24 h无此种变化。因此,不排除PPV23可能会引起COPD老年人T淋巴细胞非正常的免疫反应。COPD老年人CD69在CD19+细胞表面表达同健康老年人一样,并未发现疫苗抗原对B细胞活化有影响。可见在相同的体外培养条件下,COPD老年人、健康老年人同健康年轻人相比,以CD69表达为标志疫苗抗原引起的T、B淋巴细胞活化反应是不同的,老年人T、B淋巴细胞对多糖抗原的刺激的反应处于非活跃状态,由于COPD的影响,T淋巴细胞甚至可能会出现同免疫力正常的年轻人相悖的反应。
疫苗保留了病原体刺激机体产生免疫反应的能力,因此疫苗免疫效果与机体对疫苗抗原反应是相关的。综上所述,COPD老年人及健康老年人接种PPV23疫苗后,难以产生与健康年轻人相同的免疫反应,对该两类人群进行PPV23免疫后可以产生等同于健康年轻人相当的免疫效果表示怀疑,仅从体外培养T、B淋巴细胞对疫苗反应的单方面来看,本研究结果不支持COPD老年人和健康老年人常规使用PPV23免疫。
1 ProvincialiM,Cardelli M,Marchegiani F.Inflammation,chronic obstructive pulmonary disease and aging〔J〕.Curr Opin Pulm Med,2011;17(1):S3-S10.48-57.
2 Vila-Corcoles A,Ochoa-Gondar O,Guzman JA,et al.Effectiveness of the 23-valent polysaccharide pneumococcal vaccine against invasive pneumococcal disease in people60 years or older〔J〕.BMC Infect Dis,2010;10:73.
3 Schenkein JG,Park S,Nahm MH.Pneumococcal vaccination in older adults induces antibodieswith low opsonic capacity and reduced antibody potency〔J〕.Vaccine,2008;26(43):5521-6.
4 Dear K,Holden J,Andrews R,et al.Vaccines for preventing pneumococcal infection in adults〔J〕.Cochrane Database Syst Rev,2003;(4):D422.
5 Singleton RJ,Butler JC,Bulkow LR,et al.Invasive pneumococcal disease epidemiology and effectiveness of 23-valent pneumococcal polysaccharide vaccine in Alaska native adults〔J〕.Vaccine,2007;25(12):2288-95.
6 中华医学会呼吸病学分会慢性阻塞性肺疾病学组.慢性阻塞性肺疾病诊治指南(2007年修订版)〔J〕.中华结核和呼吸杂志,2007;30(1):8-17.
7 CaoW,Kim JH,Chirkova T,et al.Improving immunogenicity and effectiveness of influenza vaccine in older adults〔J〕.Expert Rev Vaccines,2011;10(11):1529-37.
8 Seidman JC,Richard SA,Viboud C,et al.Quantitative review of antibody response to inactivated seasonal influenza vaccines〔J〕.Influenza Other Respi Viruses,2012;6(1):52-62.
9 Goodwin K,Viboud C,Simonsen L.Antibody response to influenza vaccination in the elderly:a quantitative review〔J〕.Vaccine,2006;24(8):1159-69.
10 Rubins JB,Puri AK,Loch J,et al.Magnitude,duration,quality,and function of pneumococcal vaccine responses in elderly adults〔J〕.J Infect Dis,1998;178(2):431-40.
R392.7
A
1005-9202(2013)12-2767-03;
10.3969/j.issn.1005-9202.2013.12.015
1 中山大学附属第五医院
黄 瑾(1960-),男,主任医师,博士生导师,主要从事慢性阻塞性肺疾病及哮喘免疫功能的研究。
陈 许(1984-),女,博士,医师,主要从事慢性阻塞性肺疾病及呼吸衰竭免疫功能的研究。
〔2012-10-22收稿 2013-03-19修回〕
(编辑 张 慧)
