QuEChERS-UPLC-MS/MS检测畜禽组织中金刚烷胺残留
2013-01-30李彦关丽丽牟妍孙磊丽梁君妮沙美兰邹文晓孙爱丽曹鹏
李彦,关丽丽,牟妍,孙磊丽,梁君妮,沙美兰,邹文晓,孙爱丽,曹鹏,*
(1.烟台出入境检验检疫局,山东烟台264000;2.青岛科技大学,山东青岛264200)
金刚烷胺是最早用于抑制流感病毒的抗病毒药[1-2],因其在体内降解代谢的量极微,主要以原形随体液排出,若长期食用残留量高或被此类药物污染的食品,会在人体内积累易致蓄积中毒,对中枢神经系统造成不良影响[3-4]。金刚烷胺是国家明令禁止向食品中添加的禁用物,日本也于2013年2月15日发布通知,在进口食品监控计划中加入对中国产鸡肉中金刚烷胺的检查。但由于其药理作用,国内有部分商贩将金刚烷胺用于鸡、猪流感[5]的预防和早期治疗,及猪传染性胃肠炎的防治。我国对于畜禽组织食品中金刚烷胺残留含量未曾制定或立项过国家标准、行业标准,国际上也无特定限量要求及相应检测方法。为了保障人民饮食安全,有必要建立一种快速、准确、灵敏的方法对食品中金刚烷胺残留含量进行检测,同时其对于指导进出口食品中金刚烷胺含量控制,消除潜在的出口贸易障碍,具有紧迫的现实意义。
QuEChERS(Quick,Easy,Cheap,Rugged,Safe)[6],是由美国农业部Anastassiades 教授等于2003年开发的,近年来国际上最新发展起来的一种用于农产品检测的快速样品前处理技术[7-10]。由于该方法稳定可靠、分析速度快,本文采用1%乙酸乙腈萃取、QuEChERS 法净化、超高效液相色谱串联质谱法(UPLC-MS/MS)检测,建立畜禽组织食品中金刚烷胺残留的分析方法,对鸡肉、鸡肝、猪肉、猪肝等畜禽组织食品进行分析。
1 材料与方法
1.1 仪器与试剂
Agilent 1290UPLC-6490A 超高效液相色谱三重四级杆串联质谱联用仪:美国Agilent 公司;漩涡混合器VOATEX-2:Scientific Industries;SB5200 型超声波清洗机:美国Branson 公司;CF16RXⅡ型高速冷冻离心机:日本Hitachi 公司;氮吹浓缩仪:美国Organomation Associates 公司;分析天平:感量为0.1 mg:德国Sartorius公司。
金刚烷胺(Adamantanamine.1-(SG)):纯度≥99%,ChromaDex Inc.;乙腈、甲醇、甲酸:色谱纯,德国Merk;无水硫酸钠、冰乙酸为分析纯;PSA(填料)、C18(填料):粒径40 μm,美国Agilent 公司。
1.2 方法
1.2.1 提取
称取2.00g 匀质后的样品,置于50 mL 带螺旋盖的聚丙烯离心管中,加入10 mL 1%乙酸乙腈,充分涡旋混匀,超声提取25 min,摇匀后5 000 r/min 离心5 min,上清液待净化。
1.2.2 净化
将上述上清液转移到净化管中(10 g 无水硫酸钠,400 mgC18,200 mgPSA),涡旋混匀,5 000 r/min 离心5 min。准确移取5.0 mL 上清液至具塞刻度试管,于45 ℃水浴下氮吹浓缩至近干,加入1.0 mL 定容液(30%乙腈水溶液含1%甲酸),超声30 s,涡旋混匀,过0.22 μm滤膜,待上机测定。
1.3 仪器参数与测定条件
1.3.1 液相条件
色谱柱:Proshell120EC-C18,3.0×100mm,2.7μm;流动相:A:0.1%甲酸-5 mmol/L 乙酸铵溶液;B:乙腈;柱温:30 ℃;进样量:2 μL;流速:0.4 mL/min;梯度洗脱条件:0~2.0 min,90%~85%A;2.0 min~4.0 min,85%A;4.0 min~7.0 min,85%~70%A;7.0min~8.0min,70%~10%A。
1.3.2 质谱条件
离子源:电喷雾离子源(ESI+);毛细管电压为4.0 kV;源温200 ℃;脱溶剂温度为350 ℃;脱溶剂气流速为11 L/min;检测方式:多反应监测(MRM);监测离子对及各优化参数见表1。

表1 金刚烷胺的多反应检测质谱参数Table 1 MS parameters in MRM mode for amantadine
2 结果与讨论
2.1 前处理条件的优化
2.1.1 提取条件的优化
乙腈在有效提取目标物的同时具有沉淀蛋白的作用,且其带出的弱极性成分少,反应在质谱上响应高、基质影响小,因而选用乙腈作为提取溶剂。金刚烷胺分子结构中带氨基,易溶于酸性试剂,在有机溶剂中添加一定比例的酸提取可显著提高回收率[11-13],故考虑向其中加入部分酸性溶液,本文考察了1%乙酸乙腈、3%乙酸乙腈、1%甲酸乙腈、3%甲酸乙腈4 种提取溶剂,进行回收率对照实,结果见表2。
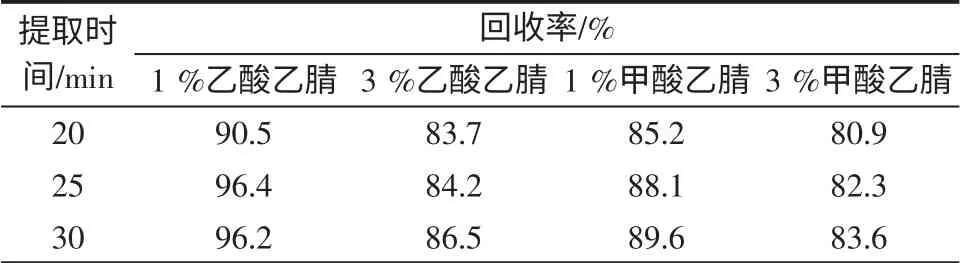
表2 不同提取溶剂对畜禽组织中金刚烷胺的回收率的影响Table 2 Effects on the recoveries of amantadine in livestock and poultry tissues with different extraction solvent
实验结果表明,用1%乙酸乙腈溶液作提取剂,提取时间为25 min,回收率较高,因此选择1%乙酸乙腈为提取液。
2.1.2 净化条件的优化
PSA、C18 是QuEChERS 方法常用的吸附剂。采用PSA 可有效去除乙腈提取液中脂肪酸、糖类、酚类以及极性色素等成分,C18 具有良好的除脂能力,根据提取液中残留脂肪和水分的含量特点,通过实验考查,见图1,最终采用200 mg PSA、10 g 无水硫酸钠及400 mg C18 为净化剂组合进行分散固相萃取,样品溶液澄清,基质干扰较小,回收率较佳。
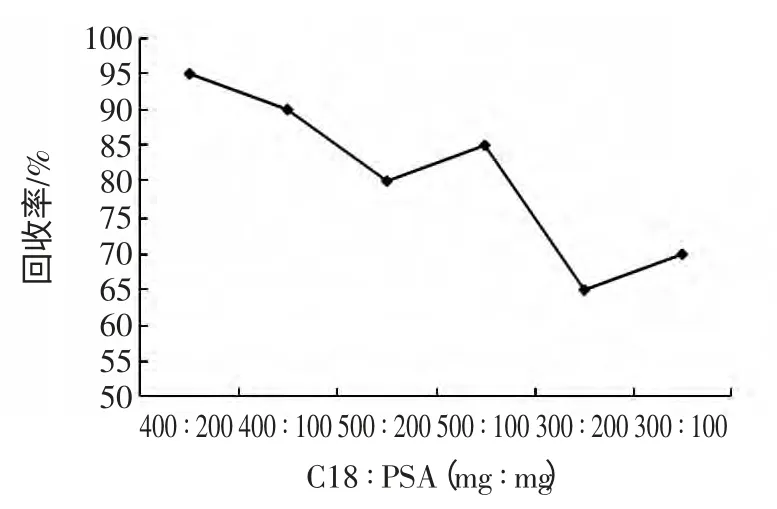
图1 不同净化条件对金刚烷胺回收率的影响Fig.1 Effects on the recoveries of amantadine with different purification conditions
2.2 色谱条件的优化
为维持流动相的低pH 保证金刚烷胺在流动相中的稳定溶解状态,本文拟采用0.1%甲酸或乙酸来控制流动相的pH,试验发现二者均可得到对称、尖锐的峰形,但甲酸更利于金刚烷胺的离子化,可得到较高的检测灵敏度,故实验中选择用0.1%甲酸控制流动相的pH,可以提高灵敏度,并且加入微量的NH4+可使峰型更尖锐、响应更稳定。最终本实验选择5 mmol/L乙酸铵-0.1%甲酸水作为流动相。
2.3 质谱条件的优化
在ESI 模式下对1.0 mg/L 的金刚烷胺标准溶液进行全扫描得到分子离子峰,再通过优化碰撞能量等参数得到子离子。金刚烷胺定量和定性子离子及相应的质谱参数见表2,在确定待测化合物监测的母离子和子离子的基础上,对各种待测化合物的喷雾电压、毛细管温度、鞘气流速、电子管透镜电压、碰撞能量等条件进行优化,结果如实验部分所述。
2.4 基质效应的消除
由于空白样品基质溶液于金刚烷胺标准品的保留时间处有基质峰,本方法采用配制基质匹配标准溶液的方法,很好的消除了基质影响,完全能满足残留检测的要求,见图2。
2.5 方法的线性范围和检出限
采用基质加标标准工作曲线进行外标法定量,根据1.2 实验方法处理空白样品,用不同浓度标准品溶液进行定容、检测,以峰面积和标准品浓度作图,实验表明,金刚烷胺在0.2 μg/L~100.0 μg/L 范围内呈良好线性关系,回归方程为Y=14069.30×X,R2大于0.997。考虑到基质的复杂性及信噪比要求,经实验数据确定本方法的检出限(LOD)为0.6 μg/kg,定量限(LOQ)为2.0 μg/kg。

图2 鸡肝空白基质和基质中加入金刚烷胺的MRM 谱图(2.0 μg/kg)Fig.2 MRM Chromatograms of blank chicken liver and spiked in blank sample with amantadine(2.0 μg/kg)
2.6 回收率和精密度
选取具有代表性的样品基质:鸡肉、鸡肝、猪肉、猪肝,分别添加2.0、4.0、20.0 μg/kg 3 个水平浓度进行添加回收试验,每个水平测定6 次,采用外标法定量,计算回收率和精密度结果见表3。结果表明本方法的回收率范围为70.5%~100.1%,RSD 值小于10%,本方法有良好的精密度和准确度,满足分析要求。
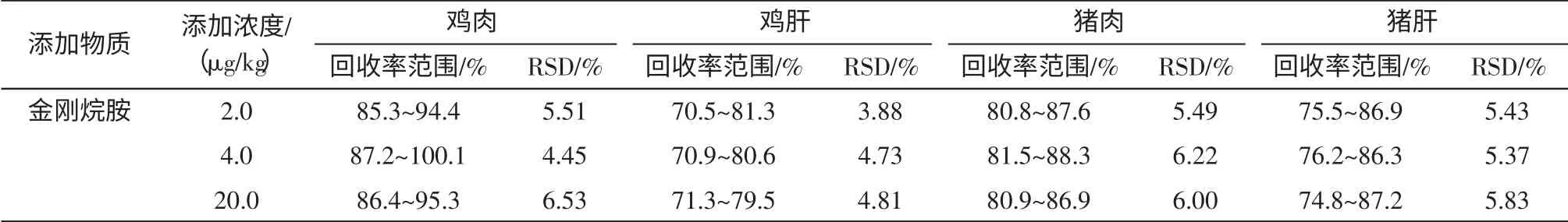
表3 金刚烷胺的回收率和精密度(n=6)Table 3 Recoveries and relative standard deviations(RSDs)of amantadine(n=6)
2.7 实际样品测定
为验证该方法的可靠性,从超市购买了鸡肉、鸡肝、鸡蛋、猪肉、猪肝、猪肉干,6 种畜禽组织进行测定,同时作质控样品。样品均未检出金刚烷胺药物残留,质控样品的回收率等指标均达到分析要求,表明结果准确可靠。
3 结论
本文建立了分散固相萃取-高效液相色谱-串联质谱法检测金刚烷胺的方法。采用酸化乙腈溶液提取后进行分散固相萃取净化,提高了提取效率,减少了杂质干扰,快速简洁。在优化了提取和净化方法的同时,采用配制基质匹配标准溶液的方法,很好地消除了基质影响,提高了检测灵敏度,适用于禽畜组织中金刚烷胺定性、定量分析。
[1] 葛孝忠,应黄慧,陈晓,等.金刚烷类药物的研究进展[J].中国医药工业杂志,2003,34(11):583-586
[2] 刘丹,范子宸,张瑛,等.金刚烷胺及其结构类似物的研究进展[J].中国药师,2009,12(11):1640-1644
[3] 陆学胜,朱天夫,许敏,等.金刚烷胺对帕金森病患者角膜内皮细胞损害作用的研究[J].世界临床药物,2010,31(7):417-421
[4] 叶金朝,叶菲.美多巴及金刚烷胺诱发精神分裂症及下肢水肿病案分析[J].药物流行病学杂志,2002,11(4):219-220
[5] 徐坤,侯雷,杨松涛,等.金刚烷胺修饰物对禽流感H5N1 病毒的抑制作用[J].吉林大学学报(医学版),2007,33(5):863-866
[6] M Anastassiades,S J Lehotay,D Stajnbaher,et al.Fast and easy multiresidue method employing acetonitrile extraction/partitioning and“dispersive solid-phase extraction”for the determination of pesticide residues in produce[J].J AOAC Int,2003,86(2):412-431
[7] 孙亚真,巩卫东,张淑霞,等.QuEChERS 色质联用技术在食品农药多残留检测中的应用与前景[J].农产品加工·学刊,2012(2):89-92
[8] 袁雪婵.QuEChERS 方法及其在食品农药多残留分析中的应用[J].中国食品添加剂,2009(2):144-148
[9] 高馥蝶,赵妍,邵兵,等.超高效液相色谱四极杆飞行时间质谱法快速筛查牛奶中的农药和兽药残留[J].色谱,2012,30(6):560-567
[10] 王炼,黎源倩,王海波,等.基质固相分散超高效液相色谱串联质谱法同时测定畜禽肉和牛奶中20 种兽药残留[J].分析化学,2011,39(2):203-207
[11] 王连珠,周昱,陈泳,等.QuEChERS 样品前处理-液相色谱-串联质谱法测定蔬菜中66 种有机磷农药残留量方法评估[J].色谱,2012,30(2):146-153
[12] 吴剑威,徐荣,赵润怀,等.QuEChERS-气相色谱法快速检测五十种中药材中九种有机氯农药残留的方法研究[J].分析科学学报,2011,27(2):167-170
[13] 王亚男,牛书涛,贺小蔚,等.QuEChERS 法提取水稻土壤中的五氯酚[J].分析试验室,2010,29(4):73-76
