酶水解法制备玉米抗性淀粉的工艺设计研究
2013-01-30于长伟
于长伟
(菏泽出入境检验检疫局,山东菏泽274000)
1982年Englyst 在研究中发现有一部分淀粉不能被胰腺淀粉酶和普鲁兰酶等淀粉酶水解,故称之为抗酶解淀粉,简称抗性淀粉。抗性淀粉本身仍然是淀粉,从功能性来看一般被视为膳食纤维,但其化学结构又不同于纤维,化学性质又类似于溶解性纤维,对人体健康非常有益。1992年世界粮农组织根据专家的建议将抗性淀粉定义为:健康者小肠中不能吸收的淀粉及它们的降解产物。抗性淀粉是近十几年碳水化合物与健康关系研究中一项重要的成果。但国内对抗性淀粉的研发还处于起步阶段,科研项目立题、发表的文章申请专利不多,相当数量的食品研究人员未接触甚至不了解这一领域。朱旻鹏等人对水分含量、压热温度和压热时间进行了研究,将玉米淀粉在水分含量为75%,温度120 ℃下处理30 min,抗性淀粉产率可达10.47%[1]。目前制备抗性淀粉的方法有压热法、酸变性法、和酶解法。压热法存在工艺条件苛刻、抗性淀粉得率低的缺点;而酸变性法容易使抗性淀粉被有毒有害物质污染。因此,本文对酶解法制备抗性淀粉进行研究,希望能够寻求一种工艺条件温和,产率高并且安全健康的方法。
1 材料仪器与方法
1.1 样品
玉米淀粉:临沂市东都经贸公司生产。
1.2 试剂
1)蒽酮试剂:取2 g 蒽酮溶于1 000 mL 体积分数为80%的硫酸中,当日配制使用;
2)标准葡萄糖溶液(0.1 mg/mL):称取100 mg 葡萄糖,溶于蒸馏水并稀释至1 000 mL(可滴加几滴甲苯作防腐剂);
3)6 mol/L HCl 溶液:50 mL 盐酸,加水至100 mL;
4)10%NaOH 溶液:称取10 g NaOH 固体,溶于蒸馏水并稀释至100 mL;
5)2 mol/L 的KOH 溶液:称取11.2 gKOH,定容到100 mL;
6)中温α—淀粉酶:湖南省津市新型发酵有限责任公司生产;
7)糖化酶:无锡市雪梅制剂科技有限责任公司酶制剂厂生产;
8)醋酸钠、冰醋酸:北京化工生产。
1.3 仪器与设备
1)漏斗、烧杯(100 mL)、移液管(2 mL)、锥型瓶(100 mL):四川蜀牛玻璃仪器有限责任公司生产;
2)试管架、吸耳球、量筒、胶头滴管、试管+塞(15 mL)、容量瓶(100 mL)、研钵、滤纸、棕色试剂瓶、烧杯(150 mL):上海京都仪器有限公司生产;
3)L800 离心机:上海跃进医疗器机械厂生产;
4)GZX—9140 MBE 数显鼓风干燥箱:上海博讯实业有限公司医疗设备厂生产;
5)HH—S 数显恒温水浴锅:常州市国立实验设备研究所生产;
6)HZY—3000—C 电子天平:福州华志科学仪器有限公司生产;
7)PHS—3C pH 计:上海康仪仪器设备有限公司生产;
8)T6 可见光分光光度计:北京普析仪器设备有限责任公司生产;
9)DDL—ZX1Kw 电炉:金坛市荣化仪器制造有限公司生产;
10)抽滤机:上海预康科教仪器设备有限公司生产。
1.4 方法
目前对抗性淀粉的结构模型有两种假设:一种是由直链淀粉折叠形成层状晶体结构;另一种是由直链淀粉链上特殊区域相互靠拢而形成束状晶体结构。这些结晶区可以阻止淀粉酶靠近结晶区域葡萄糖苷键,使淀粉酶活性基团中结合部位与淀粉分子无法结合,从而导致抗性淀粉产生抗酶解性[2]。因此,可以通过先将淀粉糊化破坏淀粉颗粒的分子序列,使直链淀粉从颗粒中溶出;然后将糊化后的淀粉老化使自由卷曲的直链淀粉分子相互靠近,通过分子间氢键形成双螺旋,许多双螺旋相互叠加形成许多微小的晶核,晶核不断生长、成熟,成为更大的直链淀粉结晶的方法制备抗性淀粉。此外,在老化过程中更多的直链淀粉有利于高抗性结晶结构的形成。使用α-淀粉酶酶解淀粉使其产生链长度均匀且长度适中的淀粉分子,然后用糖化酶酶解来产生长度均一的脱支分子片断,形成利于分子相互缔合成高含量的抗酶解淀粉分子可提高抗性淀粉得率。此次试验首先用α-淀粉酶在表1 所示的条件下将玉米淀粉酶解30 min,通过正交试验获得α-淀粉酶的最佳酶用量、酶解温度、料液比。然后通过普鲁兰酶在表2 所示的条件下,通过,正交试验获得糖化酶的最佳酶用量、酶解时间、pH。糊化条件定为100 ℃,20 min;老化条件定为4 ℃,12 h。
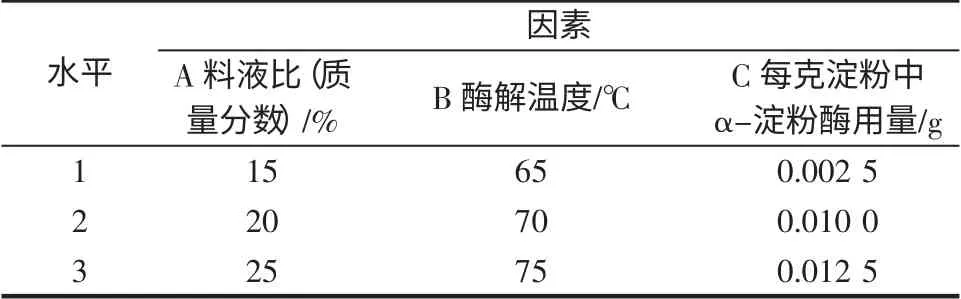
表1 α-淀粉酶酶解条件正交试验因素水平表Table 1 Level and factors form of α-amylase hydrolysis orthogona lconditions

表2 糖化酶酶解条件正交试验因素水平表Table 2 Level and factors form of glucoamylase hydrolysis orthogonal conditions
1.5 抗性淀粉检测方法
抗性淀粉可溶于2 mol/L 的氢氧化钾溶液并失去抗性。可先用α-淀粉酶和糖化酶酶解,去除普通淀粉,离心后获得抗性淀粉。然后利用氢氧化钠溶液将其溶解、加入α-淀粉酶和糖化酶酶解。通过测定还原性糖含量来计算抗性淀粉得率。糖类与硫酸会形成糠醛类化合物,糠醛类化合物会与蒽酮反应显色,颜色的深浅与糖类的浓度呈正比,通过比色可以得出糖类的含量。
2 结果与分析
2.1 α-淀粉酶酶解条件结果分析
α-淀粉酶酶解条件结果分析结果见表3、表4。
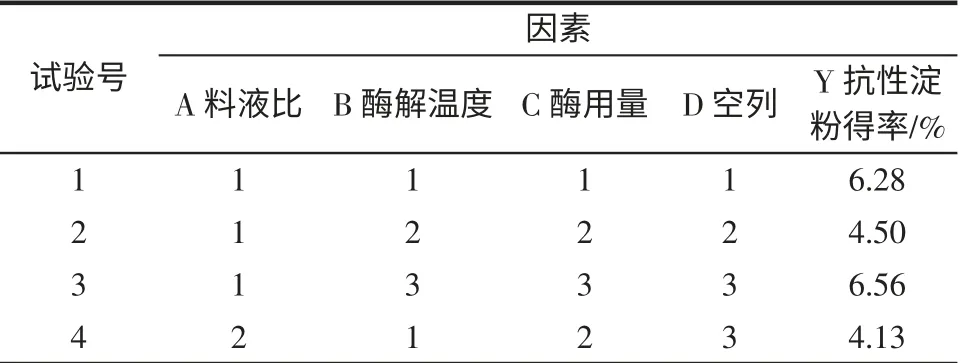
表3 α-淀粉酶酶解的正交试验结果极差分析Table 3 Range analysis of α-amylase hydrolysis orthogonal
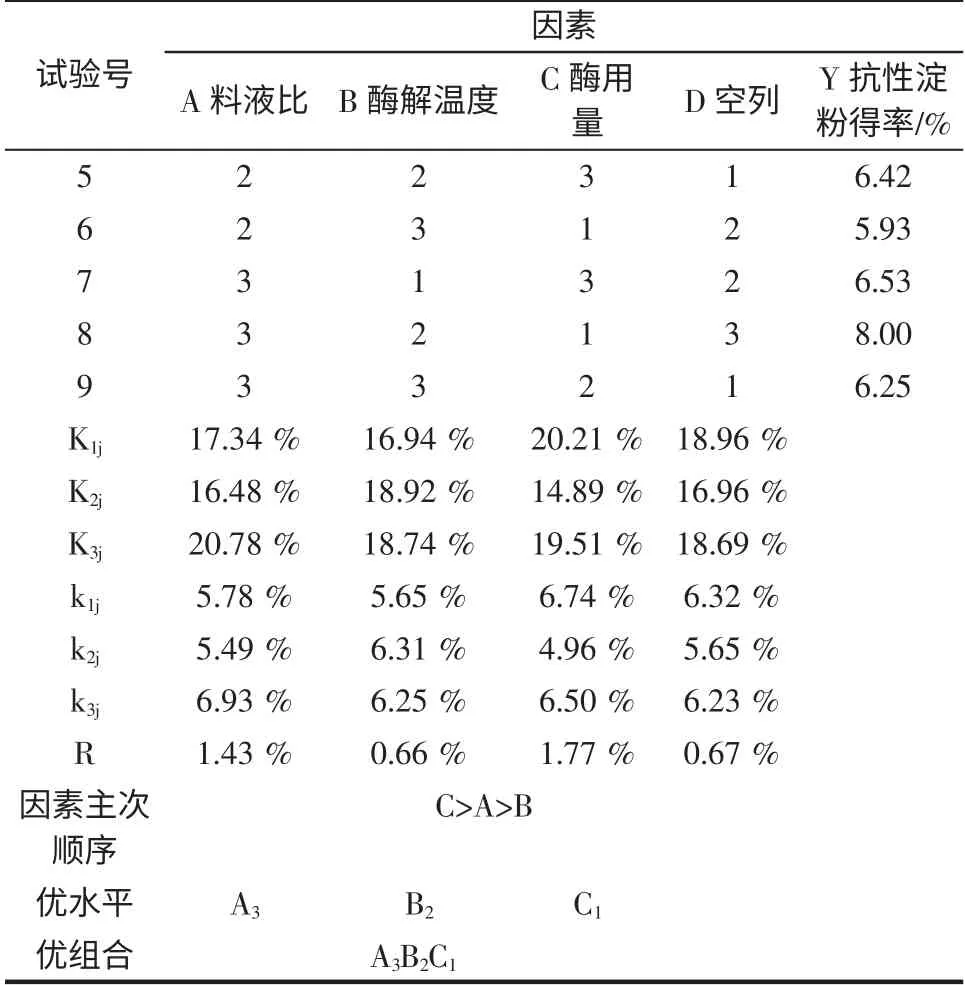
续表3 α-淀粉酶酶解的正交试验结果极差分析Continue table 3 Range analysis of α-amylase hydrolysis orthogonal
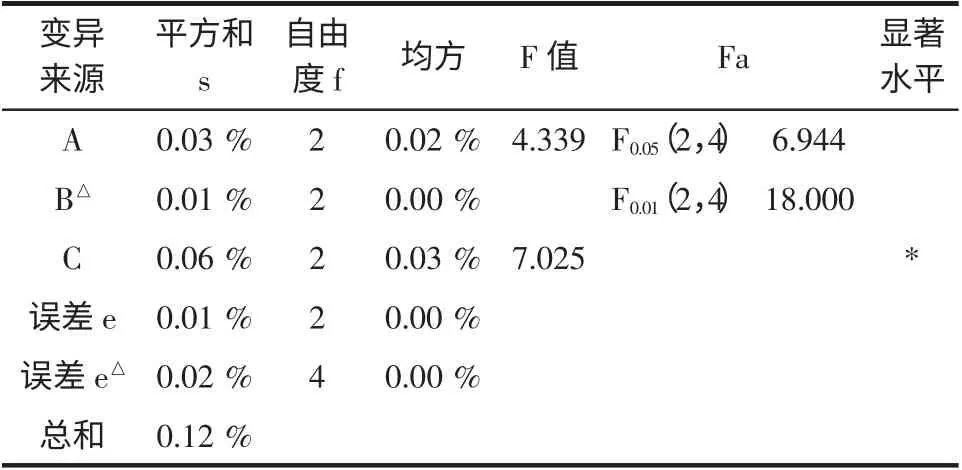
表4 α-淀粉酶酶解的正交试验方差分析结果Table 4 The result of variance analysis of α-amylase hydrolysis orthogonal
2.2 糖化酶酶解条件结果分析
通过方差分析,试验中各因素均对实验有影响,以上述分析方法分析可得出结果如表6 所示。
3 结论
通过对α-淀粉酶的极差分析可以看出各因素对实验结果影响的显著程度为酶用量>料液比>酶解温度。其中,每克淀粉中最佳α-淀粉酶用量为0.002 5 g,最佳料液比(质量分数)25%,α-淀粉酶最佳酶解温度为70 ℃。通过方差分析可以看出α-淀粉酶酶解用量对实验结果影响比较显著;料液比对结果影响不显著;酶解温度对实验结果几乎无影响,其变化所带来的实验结果变化是有实验误差引起。
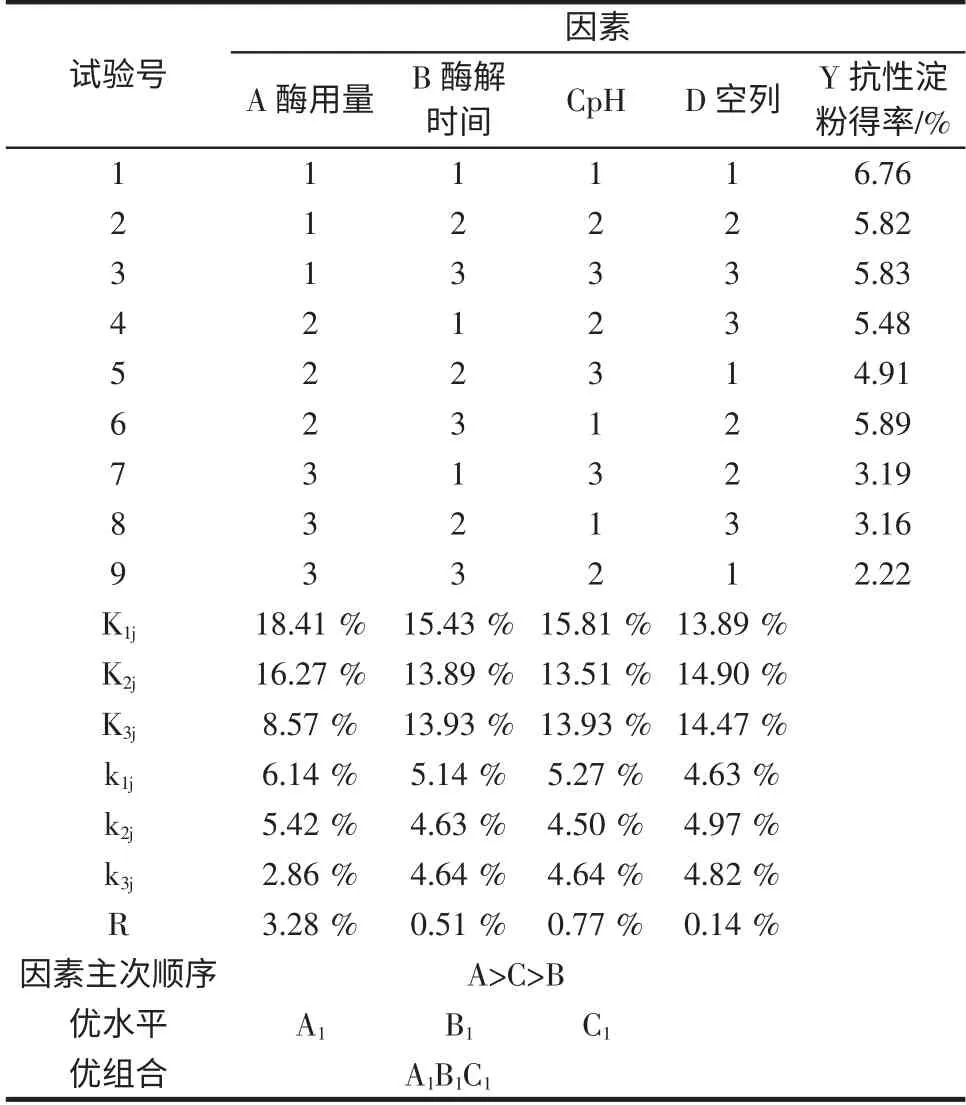
表5 糖化酶酶解条件正交试验极差结果分析Table 5 Range analysis of glucoamylase hydrolysis orthogonal
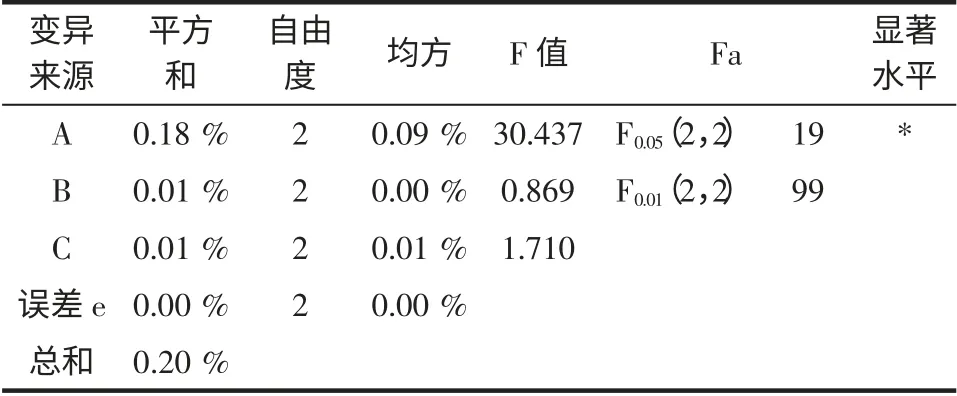
表6 糖化酶酶解条件正交试验方差分析结果Table 6 The result of variance analysis of α-amylase hydrolysis orthogonal
通过分析可以看出,糖化酶酶用量对实验结果影响最大,每克淀粉中最佳糖化酶用量是0.02 g;酶解时间对抗性淀粉的得率影响次之,最佳酶解时间是2.5 h;pH 对抗性淀粉的得率影响最小,最佳pH 为4.5。通过极差分析我们可以看出,酶用量对于实验结果的影响比较显著,pH 和酶解时间对结果的影响不大且pH的影响要大于酶解时间。
[1] 朱旻鹏,李新华,刘爱华.玉米抗性淀粉的制备及其性质的研究[J].粮油加工与食品机械,2005,21(5):80-82
[2] 程燕锋,王娟,鲍金勇,等.抗性淀粉制备现状与发展对策的探讨[J].食品研究与开发,2007(6):154-155
