立方体形Ag3PO4可见光光催化剂的制备及其性能研究
2013-01-29李军奇郭占云王德方
李军奇, 郭占云, 王德方, 王 玉
(陕西科技大学 材料科学与工程学院, 陕西 西安 710021)
0 引言
半导体光催化剂由于其在利用丰富的太阳光解决环境与能源的问题上具有相当大的潜力,因而受到了很大的关注[1-3].近几十年来,以TiO2为基础的光催化剂在降解污染物方面已有广泛的应用[4-6],然而,由于TiO2的带隙较宽(约3.2 eV),仅能吸收波长小于380 nm的紫外光,限制了TiO2光催化剂的实际应用[7].因此,探索高效的、具有可见光响应的光催化剂是目前光催化领域研究的重点.发展可见光响应的光催化剂主要有两类:一类是对传统的紫外光催化剂进行修饰改性;另一类是探索或设计新型的光催化剂[8,9],如多金属氧化物、固溶体或有机半导体等.
近年来,已研制出了多种可见光光催化剂,如TiO2-xNx[10],M3V2O8(M=Mg,Ni,Zn)[11],Ag0.7Na0.3NbO3[12]和Ag@AgCl[13]等.叶金华教授实验证明了Ag3PO4在可见光照射下氧化水和降解有机染料时表现出了优异的性能,其光催化效率比目前所知的常见可见光光催化剂如BiVO4、TiO2-xNx还要高数十倍[14].然而,上述文献中合成的Ag3PO4光催化剂多为不规则的晶体.因此,通过控制半导体的形貌来优先暴露出高活性的晶面将有利于光催化活性的提高.
基于上述原因,本文利用简单的离子交换法设计制备了立方体形貌的Ag3PO4光催化剂,并通过X射线衍射仪(XRD)、扫描电子显微镜(SEM)、傅里叶变换红外光谱仪(FTIR)和紫外可见光谱仪(UV-Vis)等分别对所制备出的Ag3PO4样品的晶相组成、微观形貌和吸光性能进行了表征,同时测试了该样品在模拟太阳光照射下对罗丹明B的光催化降解性能.
1 实验
1.1 实验药品
硝酸银(AgNO3,≥99.8%),广东光华科技股份有限公司;磷酸氢二钠(Na2HPO4·12H2O,≥99.0%),天津市红岩化学试剂厂;氨水(NH3,25~28%),西安福晨化学试剂有限公司;无水乙醇(CH3CH2OH,≥99.7%),天津市富宇精细化工有限公司;实验所用的水均为去离子水.
1.2 Ag3PO4粉体的制备
将0.6 g硝酸银溶于300 mL去离子水中,在黑暗条件下磁力搅拌20 min后,逐滴加入一定量的稀氨水,搅拌10 min后得到无色透明的溶液,用胶头滴管逐滴加入47.1 mL的0.15 mol/L的Na2HPO4溶液,继续磁力搅拌4 h.静止后,用去离子水和无水乙醇交叉洗涤几遍,将得到的产物在50 ℃真空干燥12 h,即可得到橄榄绿色的立方体形Ag3PO4粉体.用同样的方法,在不加入氨水的情况下,得到黄色的球形Ag3PO4粉体.
1.3 样品的分析与表征
使用日本Rigaku的D/Max-2200型X射线衍射仪对样品的晶相组成等进行测试(Cu Ka辐射,λ=0.154 18 nm);采用S-4800日立扫描电子显微镜对样品的形貌进行观察;采用VECTOR-70(Bruker)红外光谱仪从400~4 000 cm-1对样品进行FT-IR测试;采用日本岛津UV-2550型紫外可见光谱仪对样品进行漫反射光谱测试.
1.4 光催化活性的测试
以罗丹明B为标准污染物,研究所制备的Ag3PO4样品在模拟太阳光下的光催化活性.称取0.03 g所制备的Ag3PO4光催化剂置于石英管中,然后移取30 mL的10 mg/L的罗丹明B溶液,暗反应30 min后,使光催化剂均匀悬浮于溶液中以达到吸附平衡.用500 W氙灯照射进行光催化降解,实验过程中继续磁力搅拌,每十分钟取一次样,离心分离除去Ag3PO4粉体,取上清液采用日本岛津UV-2550型紫外可见光谱仪在λ=553 nm波长处测吸光度的变化,以测定Ag3PO4样品降解罗丹明B污染物的程度.
2 结果与讨论
2.1 XRD的测试
图1是所制备出的立方体形Ag3PO4样品(a)和球形Ag3PO4样品(b)的X射线衍射图谱.从图1中可以看出,立方体形和球形Ag3PO4样品的所有衍射峰都与体心立方结构的Ag3PO4晶体的衍射峰相对应(JCPDS.No.06-0505).然而,衍射峰的强度比有明显的变化.在制备出的立方体形Ag3PO4样品中,它的(110)晶面和(200)晶面的衍射峰的强度比为0.57,而制备出的球形Ag3PO4样品的(110)晶面和(200)晶面的衍射峰强度比为0.73.立方体形Ag3PO4样品(110)晶面与(200)晶面衍射峰的强度比(0.57)明显小于球形Ag3PO4样品对应的衍射峰强度比(0.73),这表明立方体形Ag3PO4晶体主要是由{100}晶面组成的[15].图1中的插图是理性的立方体形Ag3PO4晶体模型,外面暴露的6个面与{100}晶面相对应.此外,在图1中没有发现其它杂峰的出现,这表明制备出的Ag3PO4样品结晶度较高,晶体缺陷比较少.

图1 所制备出的立方体形Ag3PO4样品(a)和球形Ag3PO4样品(b)的XRD图
2.2 SEM的表征结果
图2是所制备出的立方体形Ag3PO4样品(a,b)和球形Ag3PO4样品(c,d)的扫描电镜图谱.从图2(a)SEM图中可以清楚地看出,样品呈现出立方体形貌,边缘和角尖锐,表面光滑,且平均粒径为500 nm.放大的SEM图(图2(b))表明立方体形貌的Ag3PO4样品完全是由6个{100}晶面包裹而成的,这与立方体形Ag3PO4样品的X射线衍射图谱所阐述的立方体形Ag3PO4晶体主要是由{100}晶面组成的内容相一致.立方体Ag3PO4基本结构单元在三维空间沿着它们的晶面生长成大的立方体结构的Ag3PO4晶体.从图2(c)中可以看出平均粒径为200 nm的Ag3PO4微球,分散性较好.放大的SEM图(图2(d))表明Ag3PO4微球的形貌比较均一.球形的Ag3PO4晶体则是由小颗粒随机生长而成的.

图2 所制备出的立方体形Ag3PO4样品(a,b)和球形Ag3PO4样品(c,d)的SEM图谱
在合成Ag3PO4样品的过程中,用[Ag(NH3)2]+代替Ag+,反应所得到的Ag3PO4样品将会由球形变为立方体形.在Ag3PO4立方晶体的形成过程中,铵根离子对于Ag3PO4晶体立方体形{100}晶面的选择性生长起了决定性的作用.在单纯的AgNO3溶液中,Ag+存在相对集中,当加入Na2HPO4溶液时,Ag+会与PO43-迅速反应,致使Ag3PO4晶体快速成核,并且各个晶面的生长速率相同,结果形成球形的Ag3PO4颗粒.然而,当向AgNO3溶液中加入氨水时,氨水会与Ag+形成银氨络合物[Ag(NH3)2]+.当银离子以银氨络合物的形式存在于溶液中时,在合成Ag3PO4颗粒的过程中,需要通过来自Na2HPO4溶液中的H+与[Ag(NH3)2]+中的NH3发生中和反应而释放出Ag+,然后与PO43-反应合成Ag3PO4晶体.这样Na2HPO4就能够合理地控制Ag+的释放速率和Ag3PO4晶体的生长速率,从而促进Ag3PO4{100}晶面的生长,从而形成单一结构的立方体形Ag3PO4颗粒[16].
2.3 FTIR的表征
图3是所制备出的立方体形Ag3PO4样品(a)和球形Ag3PO4样品(b)的傅里叶红外光谱图.由图3所示,两种样品在1 385 cm-1、1 654 cm-1和3 377 cm-1处出现的吸收峰是由于吸附的水分子和羟基的伸缩振动引起的,这证实了磷酸银表面很容易吸附大量的水分子,而这些吸附水和羟基基团在光催化反应中将起到重要作用.它们将与催化剂表面激发产生的空穴发生反应,形成羟基自由基,从而在催化反应中将溶液中的有机基团氧化[17].两种样品在560 cm-1和1 020 cm-1处出现的吸收峰是由于PO3-4的弯曲振动引起的[18].由于两种不同样品红外光谱的振动位置没有明显的变化,因此氨水的加入没有对磷酸银的晶体结构产生影响.
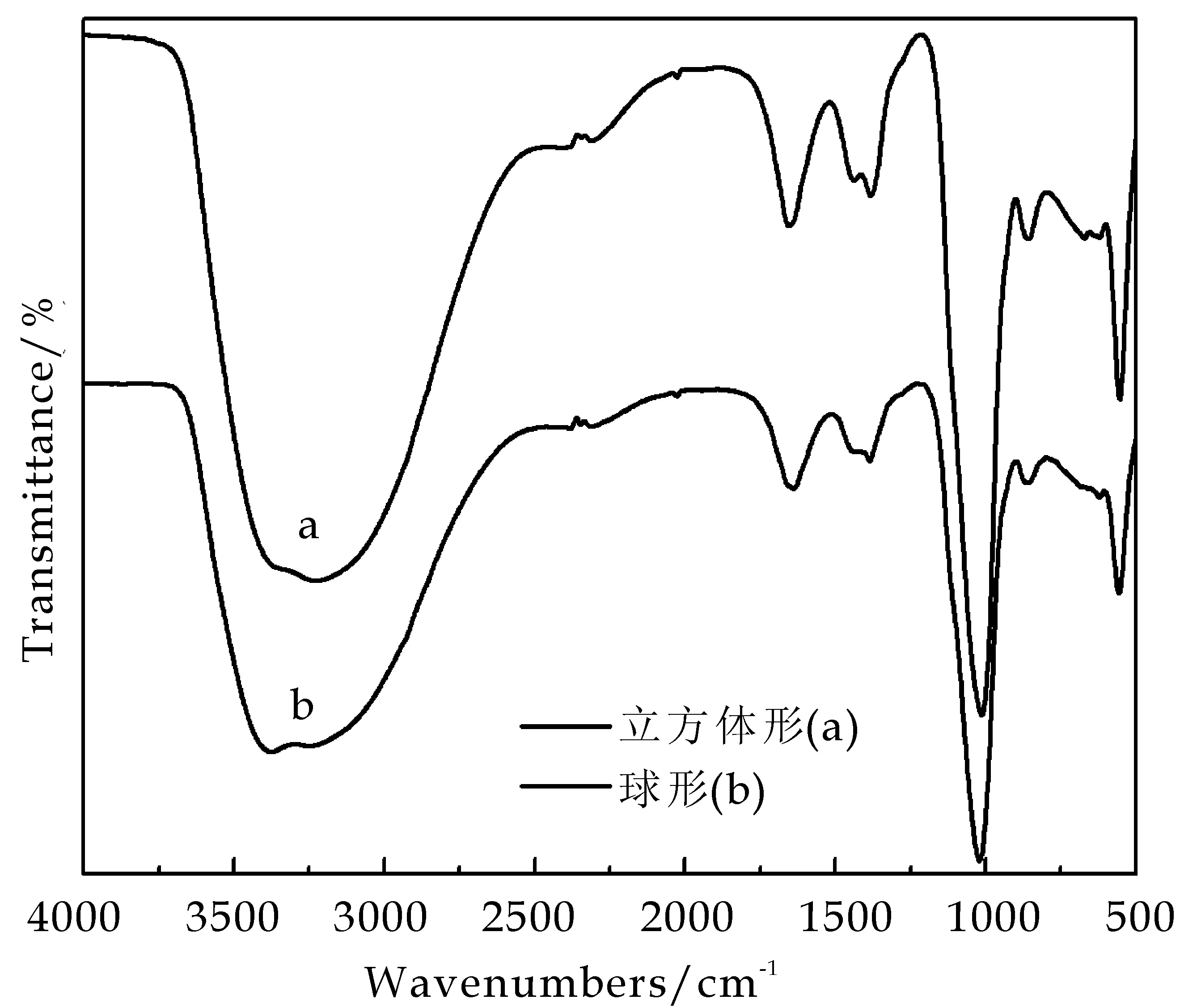
图3 所制备出的立方体形Ag3PO4样品(a)和球形Ag3PO4样品(b)的傅里叶红外光谱
2.4 UV-Vis的表征
图4是所制备出的立方体形Ag3PO4样品(a)和球形Ag3PO4样品(b)的紫外-可见漫反射光谱图.从图4中可以看出,所制备出的Ag3PO4样品都可以吸收波长小于530 nm的可见光,并且吸收强度较大.与球形的Ag3PO4样品相比较,立方体形貌的Ag3PO4样品在可见光区有更强的吸收.

图4 所制备出的立方体形Ag3PO4样品(a)和球形Ag3PO4样品(b)的紫外-可见漫反射光谱
图4显示,在波长450 nm处时,有一个吸收峰.这个吸收峰是由在可见光照射下,电子从O 2p轨道跃迁到Ag 5s轨道引起的[19].因此磷酸银是可见光下半导体光催化剂.在300~500 nm波长处,立方体形貌的磷酸银样品对光有更强的吸收,这主要是由于立方体形貌的磷酸银是由6个{100}晶面包裹而成的,而{100}晶面具有更高的表面能,促进对可见光的吸收[15].
2.5 光催化活性的表征
图5(a)为所制备出的样品在500 W氙灯照射下降解罗丹明B溶液的降解率曲线图.从该图中可以看出,在光照60 min后,球形Ag3PO4与立方体形Ag3PO4样品对RhB溶液的降解率分别为41.81%和95.36%.由此可知,立方体形貌的磷酸银样品比球形的磷酸银样品表现出更高的光催化活性.图5(b)为不同光照时间下立方体形Ag3PO4样品降解RhB溶液的吸收光谱.图5(b)表明了在不同的光照时间下RhB溶液吸收光谱的变化,从该图中可以看出,随着光照时间的延长,RhB溶液的浓度迅速降低,60 min光照后,立方体形磷酸银样品将RhB溶液几乎完全降解.
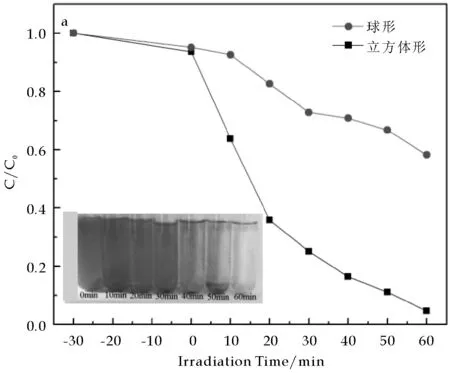
(a) 制备出的不同Ag3PO4样品光催化降解RhB的曲线图

(b) 不同光照时间下立方体形Ag3PO4样品降解RhB溶液的吸收光谱图5 样品的光催化活性
2.6 PL的表征
在光催化反应中,光生电子与空穴的复合影响其光催化性能.而光致发光光谱是检测半导体光学性质的有效方法,能够反映出光生载流子的复合情况.低的荧光发射强度能够表明较低的电子与空穴复合效率,从而对应更高的光催化活性[20].
图6为在260 nm的紫外光激发下所测出的立方体形Ag3PO4样品(a)和球形Ag3PO4样品(b)的光致发光光谱.从图6中可以看出立方体形Ag3PO4样品(a)比球形Ag3PO4样品(b)表现出更低的发射强度.也就是说对于立方体形的磷酸银样品,光生电子与空穴复合的效率较低,从而导致其较高的光催化活性.
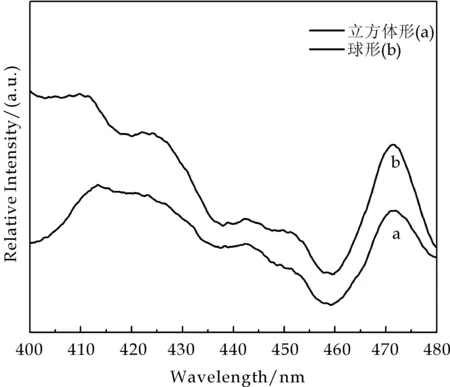
图6 所制备出的立方体形Ag3PO4样品(a)和球形Ag3PO4样品(b)的光致发光光谱
众所周知,具有大量高活性晶面的晶体对有机污染物的降解有更强的光催化性能.采用第一性原理的密度泛函理论和局域密度近似泛函理论计算出磷酸银晶体中{100}晶面的表面能为1.12 J/m2[15].立方体形的磷酸银晶体是由6个{100}晶面包裹而成的,而球形的磷酸银晶体则是由各个晶面随机包裹而成的,其表面能远低于由6个{100}晶面包裹而成的立方体形晶体.同时,通过对Ag3PO4晶体结构的研究,表明{100}晶面只含有P原子和Ag+离子,且其个数比为1∶2,而不含有O2-离子[16],所以在Ag3PO4的{100}晶面上,高浓度的Ag+离子易被光生电子还原成Ag纳米簇,Ag纳米簇附着在Ag3PO4立方体颗粒的表面,在可见光照射下能促进光生电子与空穴的分离.此外,我们还知道,半导体的电子结构对其导带与价带的位置有重要的作用,从而影响其光催化性能.因此,Yingpu Bi等[16]通过CASTEP计算了Ag3PO4晶体中{100}晶面的能带结构和态密度,结果表明{100}晶面的能带结构中存在费米能级,这种类似金属的电子性质能促进其对可见光的吸收效率.通过以上几点的论述表明,与球形的磷酸银晶体相比,立方体形的Ag3PO4晶体暴露出的{100}晶面具有较高的表面能、较高的电子与空穴分离效率,以及对可见光有较高的吸收能力,因此具有高的活性,从而有更高的光催化性能.
另一方面,{100}晶面上较易产生氧空位,而氧空位易于捕获光生电子,促进光生电子与空位的分离,且与吸附的氧气存在强烈的相互作用,使光生电子与氧气快速生成·O2-活性氧自由基,生成的·O2-能够降解有机分子.而且,立方体形貌的磷酸银晶体存在更多的边、角和缺陷,增强了其对有机分子的吸附作用,并为光催化提供了更多的活性中心.从而,在可见光照射下,光生电子和空穴能够迅速地氧化还原有机分子,降解污染物[21].由此可见,在磷酸银晶体的合成过程中,通过氨水的引入,使磷酸银晶体暴露出更高活性的{100}晶面,将对晶体的光催化活性有很强的促进作用.
3 结论
本文通过银氨辅助法成功制备出了在可见光下具有高的光催化活性的立方体形Ag3PO4光催化剂.通过对所制备样品光催化活性的研究,发现立方体形的磷酸银样品在可见光下的光催化性能远高于球形磷酸银样品的催化性能,这主要是由于其新型的立方体结构以及暴露在外面的{100}晶面.因此,通过控制半导体的形貌来优先暴露出光催化活性较高的晶面,将有助于提高可见光照射下的光催化剂的光催化活性.
[1] H.Fujishima,K.Honda.Electrochemical photolysis of water at a semiconductor electrode[J].Nature,1972,238(5 358):37-38.
[2] R.Wang,K.Hashimoto,A.Fujishima,et al.Light-induced amphiphilic surfaces[J].Nature,1997,388(6 641):431-432.
[3] J.Tang,Z.Zou,J.Ye.Efficient photocatalytic decomposition of organic contaminants over CaBi2O4under visible-light irradiation[J].Angew.Chem.Int.Ed.,2004,43(34):4 463-4 466.
[4] I.K.Konstantinou,T.A.Albanis.TiO2-assisted photocatalytic degradation of azo dyes in aqueous solution: kinetic and mechanistic investigations[J].Appl.Catal.,B,2004,49(1):1-14.
[5] J.M.Wu.Photodegradation of rhodamine B in water assisted by Titania nanorod thin films subjected to various thermal treatments[J].Environ.Sci.Technol.,2007,41(5):1 723-1 728.
[6] M.Anpo,T.Shima,S.Kodama.Photocatalytic hydrogenation of propyne with water on small-particle Titania: size quantization effects and reaction intermediates[J].Physical Chemistry,1987,91(16):4 305-4 310.
[7] M.Lwasaki,M.Hara.Cobalt ion-doped TiO2photocatalyst response to visible light[J].Journal of Colloid and Interface Science,2000,224(1):202-204.
[8] D.Wang,T.Kako,J.Ye.Efficient photocatalytic decomposition of acetaldehyde over a solid-solution perovskite (Ag0.75Sr0.25)(Nb0.75Ti0.25)O3under visible-light irradiation[J].J.Am.Chem.Soc,2008,130(9):2 724-2 725.
[9] X.Wang,X.Fu,M.Antonietti,et al.Metal-containing carbon nitride compounds:a new functional organic-metal hybrid material[J].Adv.Mater.,2009,21(16):1 609-1 612.
[10] R.Asahi,T.Morikawa,K.Aoki,et al.Visible-light photocatalysis in nitrogen-doped titanium oxides[J].Science,2001,293(5 528): 269-271.
[11] D.Wang,Z.Zou,J.Ye.Photophysical and photocatalytic properties of a new series of visible-light-driven photocatalysts M3V2O8(M=Mg, Ni, Zn)[J].Chem.Mater.,2005,17(20):5 177-5 182.
[12] G.Li,D.Wang,J.Ye,et al.Enhancement of visible-light photocatalytic activity of Ag0.7Na0.3NbO3modified by a platinum complex[J].J.Phys.Chem.C,2008,112(51):20 329-20 333.
[13] S.Lepore,D.Mondal,Y.Li,et al.Stereoretentive halogenations and azidations with titanium(IV) enabled by chelating leaving groups[J].Angew.Chem.Int.Ed.2008,47(39):1-5.
[14] Z.G.Yi,J.H.Ye,N.Kikugawa,et.al.An orthophosphate semiconductor with photooxidation properties under visible-light irradiation[J].Nature Materials,2010,9(7):559-564.
[15] Y.P.Bi,S.X.Ouyang,N.Umezawa,et.al.Facet effect of single-crystalline Ag3PO4sub-microcrystals on photocatalytic properties[J].Journal of the American Chemical Society,2011,133(17):6 490-6 492.
[16] Y.P.Bi,H.Y.Hu,S.X.Ouyang,et al.Photocatalytic and photoelectric properties of cubic Ag3PO4submicrocrystals with sharp corners and edges[J].Chem.Commun.,2012,48(31):3 748-3 750.
[17] J.R.Xiao,T.Y.Peng,R.Li,et al.Preparation,phase transformation and photocatalytic activities of cerium-doped mesoporous titania nanoparticles[J].Solid State Chemistry,2006,179(4):1 161-1 170.
[18] Q.H.Liang,W.J.Ma,Y.Shi,et al.Hierarchical Ag3PO4porous microcubes with enhanced photocatalytic properties synthesized with the assistance of trisodium citrate[J].CrystEngComm,2012,14(8):2 966-2 973.
[19] X.G.Ma,B.Lu,D.Li,et.al.Origin of photocatalytic activation of silver orthophosphate from first-principles[J].the Journal of Physical Chemistry C,2011,115(11):4 680-4 687.
[20] H.Tang,K.Prasad,R.Sanjines,et al.Electrical and optical properties of TiO2anatase thin films[J].Journal of Applied Physics,1994,75(4):2 042-2 047.
[21] M.Ge,N.Zhu,Y.P.Zhao,et al.Sunlight-assisted degradation of dye pollutants in Ag3PO4suspension[J].Industrial and Engineering Chemistry Research,2012,51(14):5 167-5 173.
