肿瘤最小ADC值在胶质瘤分级中的应用研究
2013-01-11汤伟军耿道颖
朱 莉 任 广 汤伟军 李 克 耿道颖
胶质瘤是脑内最常见的原发肿瘤,按照2007年WHO中枢神经系统肿瘤分类标准,可以分为低级别(WHOⅠ、Ⅱ级)及高级别(WHO Ⅲ、Ⅳ级)。准确的病理分级对于制定治疗方案以及评估预后至关重要。常规钆剂增强MR检查是临床确定胶质瘤性质的成熟方法,但对微观的生理状态显示能力不够。磁共振弥散加权成像(diffusion weighted imaging,DWI)是目前唯一可以在活体组织内观察水分子运动的方法,DWI数据通过后处理软件得到的表面弥散系数(apparent diffusion coefficient,ADC)可以对组织特性进行量化,间接揭示生物组织的微观结构。本文目的是应用肿瘤最小ADC值评估DWI在胶质瘤分级中的诊断价值。
方 法
1.研究对象
2009~2011年经手术病理证实的各级别脑胶质细胞瘤共计81例:男性51例,女性30例;年龄14~70岁,平均44.4岁。根据2007年WHO分类标准:低级别胶质瘤31例,其中WHO Ⅰ级3例、WHO Ⅱ级28例;高级别胶质瘤50例,其中WHO Ⅲ级21例、WHO Ⅳ级29例。全部病例术前未经过抗肿瘤治疗,并均在MR检查后3~5d内手术。
2.MRI设备和成像方法
全部病例使用1.5T超导型磁共振扫描仪(Signa EXCITE HD; GE Healthcare, Milwaukee, WI),采用8通道相控阵头颅线圈。常规MRI序列包括矢状位T1WI-FLAIR、横断面自旋回波(SE)T1WI-FLAIR、快速自旋回波(FSE)T2WI、液体衰减反转恢复序列(FLAIR)以及静脉注射钆喷酸葡胺(Gd-DTPA)矢状面、横断面T1WI增强扫描。扫描范围从颅顶至枕骨大孔,层厚6mm,间隔2mm。DWI扫描采用单次激发SE EPI序列,在X、Y、Z三个方向上分别施加弥散梯度,b=0、1000s/mm2,TR/TE为4800/68.6ms,FOV 240 mm×240mm,矩阵128×128,4次采集,扫描时间为77s。扫描层面定位与横断面T1WI、T2WI、FLAIR序列保持一致。
3.图像后处理
原始数据上传到ADW4.3工作站,利用Functool软件进行后处理得到ADC图,由两位工作经验丰富的神经放射科医师共同讨论决定,对ADC值进行测量。浏览通过肿瘤病变的ADC图全部层面,根据常规MR图像避开肿瘤的囊变、坏死、出血及钙化区域,在肿瘤每一层图像上放置2~3个相似大小的感兴趣区(region of interest,ROI),面积约30~40mm2,选择最小ADC值作为此肿瘤的minADC值。
4.统计分析
应用SPSS16.0统计软件对数据结果进行统计分析,统计结果均以均数±标准差表示。LGG与HGG组对比应用成组t检验;LGG组与WHO Ⅲ、WHO Ⅳ组对比应用单因素方差分析(One-Way ANOVA),并用LSD法进行两两对比。minADC值与肿瘤级别用Spearman相关分析,P<0.05具有统计学意义。

图1 男性,24岁,左侧额叶星形细胞瘤WHO Ⅱ级。A.T2WI示左侧额叶肿瘤。B.T1WI增强图。C.ADC图,minADC值为1.27×10-3mm2/s。
结 果
不同级别胶质瘤平均minADC值见表1,其测定见图1~3。LGG平均minADC值高于HGG平均minADC值(P<0.001)。LGG平均minADC值高于Ⅲ级胶质瘤平均minADC值(P<0.001),也高于Ⅳ级胶质瘤平均minADC值(P<0.001),但Ⅲ级与Ⅳ级胶质瘤平均minADC值无统计学差异(P=0.069)。
胶质瘤minADC值与级别呈显著负相关(r=-0.699,P<0.001)。
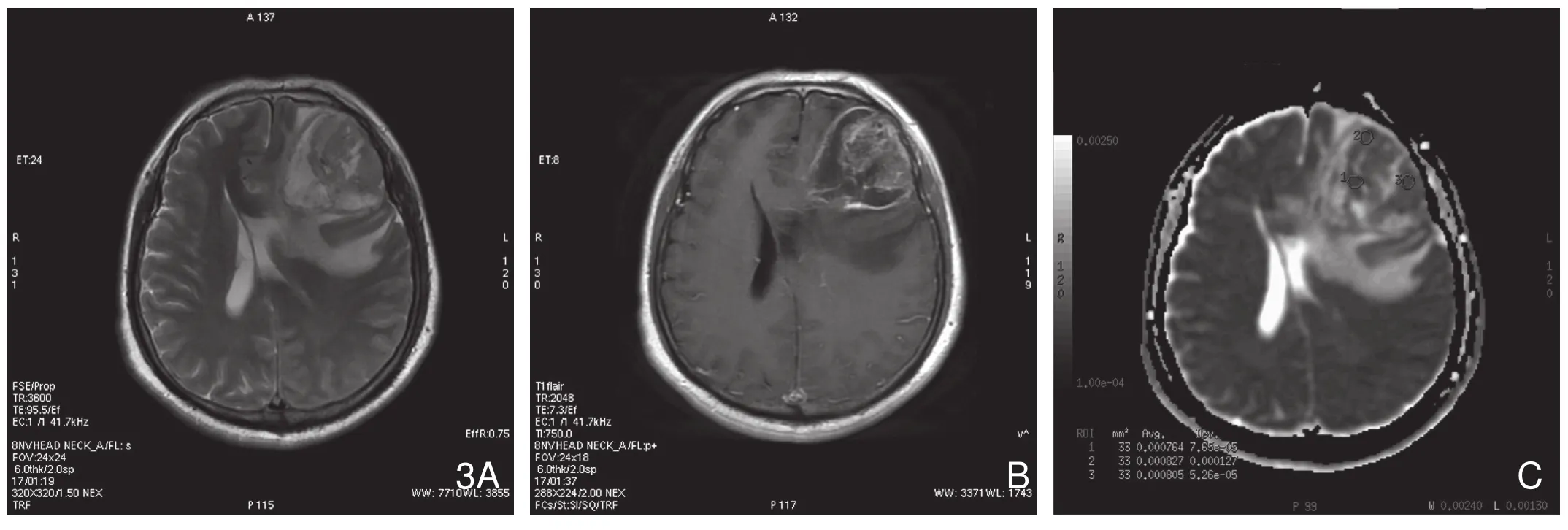
图3 男性,47岁,左侧额叶胶质母细胞瘤WHO Ⅳ级。A.T2WI示左侧额叶肿瘤。B.T1WI增强图。C.ADC图,minADC值为0.764×10-3mm2/s。
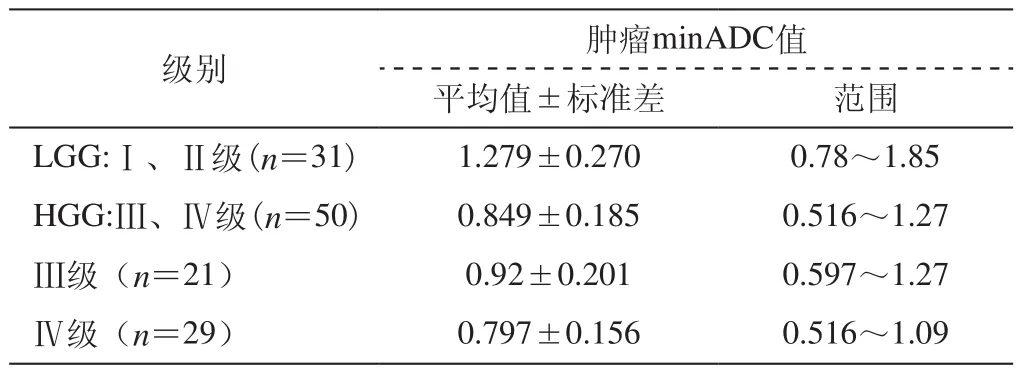
表1 各级别肿瘤minADC值(单位:×10-3mm2/s)
讨 论
组织病理学对高级别胶质瘤的诊断主要是基于显微镜下细胞密度、核异形性、有丝分裂、多形性、血管增生、坏死等特征。国内外有大量文献应用ADC值对不同病理类型的肿瘤进行了定量研究,结果[1-2]证实ADC值与肿瘤的细胞密度呈负相关。高级别胶质瘤与低级别胶质瘤相比,肿瘤细胞密度高,细胞核密集,核异性明显,所以研究者们推测前者ADC值应该低于后者。DWI被广泛应用于胶质瘤分级,但研究方法各不相同:有的ROI测量的是肿瘤强化部分,有的测量非强化部分;有的ROI包括了坏死组织,有的不包括;有的应用肿瘤实质数个ROI的ADC平均值,有的应用肿瘤ADC值与对侧正常脑白质ADC值的比值,也有的应用肿瘤最小ADC值。这样导致结果各不相同。Provenzale等[3]认为这些结果差异主要与测量值是否包括坏死灶相关。在高级别胶质瘤时,坏死最常见,如果这些区域包括在ROI之内,那么就会导致平均ADC值的升高,造成高、低级别胶质瘤之间数据的重叠。
因为胶质瘤具有典型的不均质性,同一个肿瘤标本可能具有不同的级别,一个错误的活检部位选择可能会低估肿瘤的级别,而且治疗方法也会低估。只有具有最高肿瘤分级的部分才能反映该肿瘤真正的病理分级及生物学行为,准确分级无论对于肿瘤预后或者治疗方式的选取都非常重要。高级别胶质瘤在影像学上的也表现为不均质性。一些研究[4-9]认为肿瘤实质部分的minADC值可能最能代表每个肿瘤细胞密度最高或者说细胞增殖最明显的部分,从而反映肿瘤的真正分级。所以本研究选择肿瘤实质部分的minADC值作为分析指标,与文献报道[4-9]相一致,肿瘤minADC值与肿瘤分级呈明显负相关。
Zonari等[10]应用minADC值与对侧正常脑组织ADC值的比值做参考值,认为该比值不能区分高级别和低级别胶质瘤。应用minADC值绝对值,许多研究者[7,11,12]都得出同样的结论,minADC值可以区分高级别和低级别胶质瘤,但对四个级别进一步比较,观点又不相同。Kitis等[11]认为minADC值无法区分间变胶质瘤和胶质母细胞瘤[(0.77±0.21)×10-3mm2/s vs(0.70±0.16)×10-3mm2/s,P>0.05];Murakami等[12]认为minADC值可以区分Ⅰ级与Ⅱ级胶质瘤,也可以区分Ⅲ级与Ⅳ级胶质瘤,但是无法区分Ⅱ级与Ⅲ级胶质瘤(1.25×10-3mm2/s vs 1.17×10-3mm2/s,P>0.05);Higano等[7]认为minADC值可以区分间变胶质瘤和胶质母细胞瘤((1.06±0.207)×10-3mm2/s vs(0.834±0.136)×10-3mm2/s,P<0.05)。本研究认为由于观察者之间选择ROI区域的不同,选择对侧正常脑白质做参考会增加不必要的变异,而且不同年龄脑白质ADC值不同更会加大研究参数的变异。本文毛细胞型星形细胞瘤(WHOⅠ级)仅有3例,所以未作为亚组与其他级别分别对比,而将其与Ⅱ级胶质瘤共同作为低级别胶质瘤与另外两组做两两对比,结果显示肿瘤平均minADC值在低级别与高级别胶质瘤之间、低级别胶质瘤与Ⅲ级胶质瘤之间、低级别胶质瘤与Ⅳ级胶质瘤之间有统计学差异,但是在Ⅲ级与Ⅳ级胶质瘤之间无统计学差异,与Kitis等[11]研究结果一致,考虑Ⅲ级与Ⅳ级胶质瘤ROI的选择可能包含肉眼不能分辨的小灶性坏死所致,从而导致ADC值的重叠。
本研究不足之处在于WHOⅠ级胶质瘤病例数少,没有与其他级别胶质瘤进一步统计分析,而且缺乏minADC值与病理标本点对点的对应分析。这有待于以后大样本研究及临床实验研究以改进。
总之,本研究发现肿瘤minADC值与胶质瘤分级呈负相关,结合常规MRI及DWI,通过测量肿瘤minADC值,可以为其病理分级提供更多的信息,有助于肿瘤治疗方案的制定和预后评估。
[1] Sugahara T, Korogi Y, Kochi M, et al. Usefulness of diffusionweighted MRI with echo-planar technique in the evaluation of cellularity in gliomas. J Magn Reson Imaging, 1999, 9: 53-60.
[2] Hayashida Y, Hirai T, Morishita S, et al. Diffusion-weighted imaging of metastatic brain tumors: comparison with histologic type and tumor cellularity. AJNR, 2006, 27: 1419-1425.
[3] Provenzale JM, Mukundan S, Barboriak DP. Diffusion-weighted and perfusion MR imaging for brain tumor characterization and assessment of treatment response. Radiology, 2006, 239: 632-649.
[4] Murakami R, Sugahara T, Nakamura H, et al. Malignant supratentorial astrocytoma treated with postoperative radiation therapy: prognostic value of pretreatment quantitative diffusionweighted MR imaging. Radiology, 2007, 243: 493-499.
[5] Kim HS, Kim SY. A prospective study on the added value of pulsed arterial spin-labeling and apparent diffusion coefficients in the grading of gliomas. AJNR, 2007, 28: 1693-1699.
[6] Murakami R, Hirai T, Kitajima M, et al. Magnetic resonance imaging of pilocytic astrocytomas: usefulness of the minimum apparent diffusion coefficient (ADC) value for differentiation from high-grade gliomas. Acta Radiol, 2008, 49: 462-467.
[7] Higano S, Yun X, Kumabe T, et al. Malignant astrocytic tumors:clinical importance of apparent diffusion coefficient in prediction of grade and prognosis. Radiology, 2006, 241: 839-846.
[8] 陈志晔, 马 林. 表观扩散系数在神经上皮肿瘤分级中的诊断价值.中华放射学杂志,2009, 43: 1135-1138.
[9] 刘 权,彭卫军,周正荣,等. 最小表观弥撒系数对颅内少突胶质瘤分级及分型的价值. 中国医学计算机成像杂志, 2008, 14: 287-292.
[10] Zonari P, Baraldi P, Crisi G, et al. Multimodal MRI in the characterization of glial neoplasms: the combined role of singlevoxel MR spectroscopy, diffusion imaging and echo-planar perfusion imaging. Neuroradiology, 2007, 49: 795-803.
[11] Kitis O, Altay H, Calli C, et al. Minimum apparent diffusion coefficients in the evaluation of brain tumors. Eur J Radiol, 2005,55: 393-400.
[12] Murakami R, Hirai T, Sugahara T, et al. Grading astrocytic tumors by using apparent diffusion coefficient parameters: superiority of a one- versus two-parameter pilot method. Radiology, 2009, 251:838-845.
