孤立性纤维性肿瘤的CT诊断和鉴别诊断
2013-01-11王汉杰夏淦林丁勇生司海峰
王汉杰 夏淦林 丁勇生 司海峰
孤立性纤维性肿瘤(solitary fibrous tumor,SFT)为少见的梭形细胞肿瘤,以往对本病认识不足,术前诊断准确率低。笔者回顾性分析15例经手术病理证实的SFT的临床及影像学资料,结合文献对其CT表现进行探讨,旨在提高对该病的术前确诊率。
方 法
1.临床资料
收集我院2002年2月至2013年3月经病理及免疫组织化学染色证实的SFT15例,男9例,女6例,年龄32~70岁,平均62岁。无症状体检发现4例,胸闷不适5例,咳嗽2例(其中1例同时有胸闷不适),下腹不适伴尿频2例,鼻塞1例,上颚结节1例,左上臂无痛性肿块1例。2例入院时有低血糖,空腹血糖分别为2.33mmol/L、3.87mmol/L。
2.CT检查方法
所有病例均采用Siemens SOMATOM Sensation 64螺旋CT扫描仪扫描,其中12例行增强扫描,扫描条件120 kV,90 mAs (胸部)、280(腹部),Rotation time 0.5s,Slice 5.0mm,Acq.64×0.6mm, pitch 1.0。增强经肘静脉团注碘海醇注射液(300mgI/ml)100ml,速率2.5~3.0ml/s。注药后30s及80s分别行第一期与第二期扫描,9例行延迟扫描,延迟时间120s。
结 果
1.CT表现
1.1 肿瘤的部位与形态特征:胸腔8例,右肺上叶1例,上腹腔1例,盆腔2例,左上臂1例,右鼻腔1例,左上颚1例。8例胸腔病灶均以宽基底与胸膜相贴,其中4例跨叶间裂(图1),位于胸壁与肺之间的5例病灶中心层面呈“卵圆”形,其上下层面逐渐变窄、部分呈“半月”形(图2);位于斜裂与侧胸壁之间的1例,肿瘤呈尖端指向斜裂、基底贴于胸壁的“圆锥形”(图3);位于下肺与横膈之间的2例,由于肿瘤巨大,充满下部胸腔呈“铸型”样改变(图4)。位于右肺及腹盆腔的4个病灶均呈类圆形。位于右鼻腔及左上颚的呈“卵圆”形,左上臂的呈长轴与肱骨长轴一致的“卵圆”形。
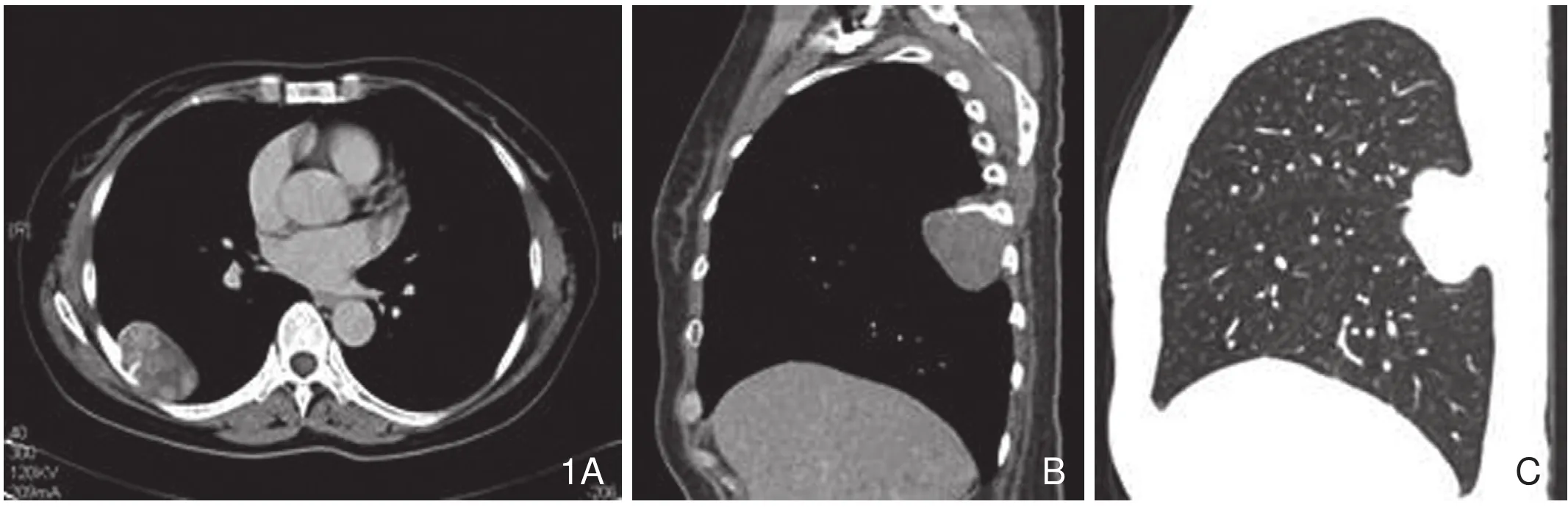
图1 右侧壁层胸膜SFT。A.卵圆形肿块,边缘光滑,地图状强化、其内见多发结节状强化,邻近肋骨受侵伴条状骨膜新生骨形成;B、C.肿块宽基底贴附于胸膜,轻度分叶,跨越斜裂,边缘见条状骨膜新生骨。
1.2 肿瘤大小:2.5cm×3.0cm×3.0cm~30.0cm×3 0.0cm×25.0cm,平均10.8cm×8.3m×8.1cm。
1.3 边界:15例病灶边缘均清晰、光整,其中12例部分层面有浅分叶。
1.4 密度:9例密度均匀, 6例病灶密度不均匀,其中3例见囊变坏死低密度区(图5),3例见斑片状稍低密度区,4例见钙化,呈结节状、斑片状或索条状(图2、4、5)。
1.5 强化特点:增强扫描的12个病例,其中9例为轻中度强化,3例显著强化的病灶均位于腹部。6例于动脉期在肿瘤边缘及内部见多发迂曲匐行的血管影(图4、5)。9例呈“地图样”强化,其内均可见“多发结节状”强化,静脉期持续强化、强化范围扩大(图1、4、5、6)。
1.6 肿瘤继发性改变:压迫性肺不张2例,不张的肺组织位于肿块边缘呈“帽状”。纵隔移位2例,膀胱推压移位2例,胸腔积液3例,邻近肋骨受侵蚀伴条状
骨膜新生骨形成1例。
2.手术及病理结果
2.1 手术及大体标本:15例中11包膜完整、2例部分包膜缺损、2例无明显包膜。术中源于脏层胸膜的6例,3例有蒂连于肺组织,3例由肺发出供血血管;源于右鼻腔1例以细蒂附着于嗅裂。切面灰白、灰黄,多结节状、编织状,质韧,2例伴囊变坏死,1例伴黏液样变性,1例伴广泛玻璃样变。
2.2 镜检:肿瘤细胞呈梭形,部分区域排列致密、部分区域排列疏松,其间有不同比例的胶原纤维及大量鹿角样薄壁血管。
2.3 免疫组化:CD34(+)14例,bcl-2(+)15例,CD99(+)11例。病理诊断恶性4例(细胞异型性显著,核分裂象增多,>4/10HPF)。

图2 右侧脏层胸膜SFT。 A.肿瘤呈卵圆形,宽基底紧贴侧胸壁,边缘光滑、浅分叶; B.肿瘤内斑片状钙化,增强延迟强化呈地图状、多发结节状。

图3 左侧斜裂带蒂的SFT。A.肿瘤塑形性生长呈圆锥形,轻度不均匀地图状强化,其内见斑片状稍低密度区,CT未能显示瘤蒂;B.肿瘤位于斜裂内。

图4 左侧脏层胸膜恶性SFT,位于左肺与横膈之间。A. 平扫肿瘤密度欠均匀,充满下部胸腔呈“铸型”样改变,内见结节状钙化;B.增强动脉期肿瘤内见多发迂曲匐行的血管影,邻近左肺下叶压迫不张呈“帽状”;C.静脉期肿瘤持续强化呈地图状,内见多发结节状强化。
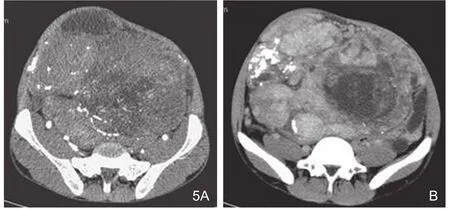
图5 盆腔恶性SFT。A.动脉期肿瘤不均匀强化,其内及边缘见多发迂曲匐行的血管影;B.延迟扫描肿瘤持续强化呈地图状,其内见多发结节状强化及大片囊变坏死低密度区,肿瘤内另见成簇分布的沙砾状钙化。

图6 上腹腔SFT,卵圆形、轻度分叶。A.门脉期肿瘤呈多发结节状强化;B.延迟扫描肿瘤持续强化、充填,强化趋于均匀。
讨 论
1.SFT的组织起源与命名
孤立性纤维性肿瘤是少见的梭形细胞软组织肿瘤,1931年由Klemperer和Rabin首次报道,因早期报道的病例均发生于胸、腹腔与浆膜有关,故认为其起源于间皮或间皮下间叶细胞,曾称为局限性间皮瘤、纤维性间皮瘤或局限纤维性间皮瘤[1]。WHO2002年软组织肿瘤分类中,将SFT归为纤维母细胞/肌纤维母细胞来源肿瘤,属于部分可转移的中间型,(WHO2002—8815/1)。近来研究表明,SFT是一种源于CD34阳性的树突状间叶细胞肿瘤,具有向纤维母细胞、肌纤维母细胞分化的特征[2]。
2.SFT的临床特点
SFT可以发生于全身各部位,80%起源于胸膜[3]。胸膜外者以皮下软组织、眼眶及腹腔所占病例最多[4]。SFT好发年龄为20~70岁之间,平均年龄50岁,极少发生于儿童及青年,无明显性别差异[5],本组病例平均年龄62岁,男性多于女性(9:6),与文献报道有所差异,可能与样本量较少有关。SFT生长缓慢,早期没有临床症状,常在体检时发现,发生于胸腹腔者往往肿块较大时产生压迫症状才被发现。本组中4例为体检发现,其余因发现肿块及出现胸闷不适、咳嗽、腹胀、尿频、鼻塞等压迫症状就诊。文献报导SFT可出现低血糖症状,手术后低血糖症状逐渐消失,血糖逐渐恢复至正常水平[6]。本组有2例伴有低血糖,空腹血糖分别为2.33mmol/L、3.87mmol/L,其中一例术后第四天血糖恢复正常。文献认为引起低血糖机制有:肿瘤压迫自主神经,迷走神经极度兴奋;肿瘤引起葡萄糖消耗增加;糖异生抑制;肿瘤分泌胰岛素样物质IGF-Ⅰ及IGF-Ⅱ。
3.SFT的CT特点
分析本组病例并结合文献,总结孤立性纤维性肿瘤有以下特点:
3.1 肿块大、边缘光、浅分叶:本组病例均边缘光整,12例有浅分叶,平均10.8cm×8.3m×8.1cm,与文献[7]报道一致。
3.2 塑形性生长,胸膜SFT宽基底贴附于胸膜、可跨叶间裂:SFT由于生长缓慢,其所处部位对其有明显塑形作用。位于胸膜腔者,由于在肺外生长,所以可跨越叶间裂。本组8例胸膜SFT均宽基底贴附于胸膜,均与所处胸腔间隙形态相适应呈 “卵圆”形、“圆锥形”、 “铸型”样改变。文献报道[8]SFT位于肋胸膜、膈胸膜或纵隔胸膜移行区且体积较大时常呈斜圆形锥体状,铸型镶嵌于肋膈隐窝内,出现率42%。位于鼻腔及上颚的2例病灶亦呈与所处部位形态相适应的“卵圆”形。3例位于腹腔、盆腔的肿瘤均呈类圆形,可能由于腹腔有较大的生长空间所致。
3.3 肿瘤的密度:位于胸腔的SFT尽管体积巨大,但密度相对均匀,坏死少见且范围多较小。良性肿瘤坏死少见,恶性肿瘤不规则坏死区相对多见[9-10]。腹部SFT都有不同程度的坏死囊变和钙化[11]。本组8例胸腔SFT均未见明显坏死囊变区。2例盆腔SFT见不规则囊变坏死区及钙化,1例左上臂SFT见不规则囊变坏死区,3例病理均为恶性,与文献报道相符。
3.4 肿瘤的钙化:文献报道部分病灶内可发生斑点、斑片状钙化,常发生在较大的肿瘤,可能与肿瘤坏死有关[12]。本组病例中有4例出现钙化,呈结节状、斑片状、索条状,直径均大于10.0cm,其中两例为良性,两例为恶性,与文献报道的钙化对良恶性鉴别无统计学意义一致。
3.5 多发肿瘤血管,“地图样”、“多发结节状”强化,延迟充填:本组12例行增强扫描的病例6例于动脉期在肿瘤边缘及内部见多发迂曲匐行的肿瘤血管影,反映了肿瘤内血管外皮瘤样“鹿角”状分支血管的病理特点;9例病灶呈不均匀“地图样”强化,其内均见“多发结节状”强化,与肿瘤病理上多为多结节状[4],肿瘤内细胞密集区与血管外皮瘤样区强化明显,而细胞稀疏区与胶原束玻璃样变区强化较弱及肿瘤的囊变坏死有关,多种区域混杂存在,形成这种特殊的强化方式。
3.6 肿瘤的蒂CT显示率较低:文献报道SFT蒂的出现率约为50%,但CT显示该结构阳性率不高,本组病例中4例术中见蒂,但CT均未能明确显示。
3.7 肿瘤继发性改变:本组3例肿块较大的胸腔SFT伴有少量胸腔积液,其中 2例伴邻近肺组织受压移位、不张,呈“帽状”实变。Dedrik等认为相邻肺组织的受压移位、不张和肿块边缘逐渐变窄是提示肿瘤起源于胸膜较为可靠的征象[13]。1例壁层胸膜起源的病灶侵及邻近肋骨伴条状骨膜新生骨形成。胸膜SFT伴胸腔积液文献报道较多,伴邻近骨质改变,文献报道较少,Wuisman等[14]报道SFT可伴有周边骨质破坏及溶骨改变,肿瘤中骨质可能是反应性增生,而非肿瘤成份。当SFT累及骨性结构时不易诊断。
4.鉴别诊断
SFT发病率较低,以往对其影像表现认识不足,术前误诊率高。本组8例胸膜SFT术前准确诊断6例,2例误诊为胸壁神经源性肿瘤;腹部3例均误诊为间质瘤;上颚1例误诊为混合瘤;鼻腔1例误诊为内翻乳头状瘤;上臂1例误诊为横纹肌肉瘤,肺内1例诊断为良性肿瘤。
胸膜SFT与胸壁神经源性肿瘤及肺内病变的鉴别:胸膜SFT宽基底与胸壁相贴,肿瘤主体位于肺外,囊变坏死少见,可出现局部肺组织受压不张,增强多为轻中度强化,可见多发的肿瘤血管及“地图状”、“多发结节状”强化等特征性表现;胸壁神经源性肿瘤好发于肋间神经及脊神经,多有囊变坏死,强化较显著,前者沿肋间神经走行,常伴邻近肋间隙受压增宽,后者常跨椎间孔呈“哑铃状”;肺内肿瘤主体位于肺内,与胸膜呈锐角相交。腹盆腔SFT与间质瘤的鉴别:两者形态学相似,均可出现囊变、坏死、斑点状钙化、周围血管增多[15],但后者增强肿瘤内较少见多发迂曲匐行的肿瘤血管影及“多发结节状”强化。肺内及头颈部SFT与相应部位的良性肿瘤的CT表现缺乏显著差异性,最终诊断需依靠病理。
综上所述,SFT虽然少见,但其影像表现有一定特征性,仔细分析其影像学表现,可对多数病例作出正确诊断。
[1] Klemperer P, Rabin CB. Primary neoplasms of the pleura: a report of five cases. Arch Pathol,1931, 11: 385.
[2] Fletcher CD. The evolving classification of soft tissue tumours: an update based on the new WHO classification. Histopathology, 2006,48: 3-12.
[3] Brisel liM, Mark EJ , Dickersin GR. Solitary fibrous tumors of the pleura : eight new cases and review of 360 cases in the literature.Cancer , 1981, 47 : 2678.
[4] 邓 元,刘 希,张学斌,等.胸膜外孤立性纤维瘤39例临床病理分析.临床与实验病理学杂志,2012,26:451-455.
[5] 陈卉娇,张红英,李 响,等.26例孤立性纤维性肿瘤临床病理及免疫组化特征. 四川大学学报(医学版),2004,35:675-679.
[6] 姚洪祥,张金山,白友贤,等.胸膜孤立性纤维瘤的CT表现.中国医学影像学杂志,2006,14:406-409.
[7] 邓克学,许实成.胸腔巨大孤立性纤维瘤CT诊断.中国医学计算机成像杂志,2010,16:175-177.
[8] 侯刚强,张小静,张 静,等.胸部孤立性纤维性肿瘤的CT表现及病理学分析.中国临床医学影像杂志,2010,21:881-883.
[9] 刘春玲,张水兴,张金娥,等.探讨CT对良恶性胸膜孤立性纤维性肿瘤鉴别的诊断价值.中华放射学杂志,2012,46:789-792.
[10] 周建军,周康荣,曾蒙苏,等.孤立性纤维瘤的影像学诊断和鉴别.医学影像学杂志,2008,18:851-854.
[11] 陆 明,郭德玉,王健.胸膜外孤立性纤维瘤的CT表现和病理对照.临床放射学杂志,2008,27:128-131.
[12] 张永华,巴照贵,赵绍宏.胸部孤立性纤维瘤的MSCT表现.中国医学影像学杂志,2010,18:443-447.
[13] Dedrik CG, Mcloud TC, Shepard JA, et al. Computed tomography of localized pleural mesothelioma . AJR, 1985, 144: 275.
[14] Wuisman P, Witlox A, van Diest P, et a1. Growing mass in the right suprascapular region. Clin Orthop Relat Res, 2004, 420: 321-327.
[15] 钱 民,李小荣,林伟光,等.胃肠道间质瘤的CT诊断价值.中国医学计算机成像杂志,2006,12:36-39.
