Ⅲ期结直肠癌术后经肝动脉灌注联合静脉辅助化疗的临床观察
2013-01-07李鸿雁马力文张照辉王墨培曹宝山
肖 宇 李鸿雁 马力文 张照辉 梁 莉 王墨培 曹宝山
在结直肠癌患者中,肝脏是首要转移部位,50%患者会发生肝转移,也是死亡的主要原因[1],控制结直肠癌术后肝转移或许可以延长生存期。术后辅助静脉化疗可降低Ⅲ期结直肠癌的转移率,提高总生存期[2],而且一些随机临床试验显示,手术切除了肝转移病灶的结直肠癌患者中,经肝动脉灌注(hepatic arterial infusion,HAI)5-氟尿嘧啶(5-fluorouracil,5-FU)或氟尿嘧啶脱氧核苷(fluorodeoxyuridine,FUDR)可降低肝转移的复发率,但对总生存期无明显影响[3]。本研究试图通过经肝动脉灌注联合静脉辅助化疗减少Ⅲ期结直肠癌术后肝转移的发生,并与静脉辅助化疗对照观察对肝转移、无病生存期(disease-free survival,DFS)及总生存期(overall survival,OS)的影响。
1 材料与方法
1.1 临床资料
收集北京大学第三医院2002年1月至2006年3月间,21例术后病理证实为Ⅲ期的结直肠癌患者进行了肝动脉泵灌注联合静脉辅助化疗,以此为治疗组。同期21例术后进行常规静脉辅助化疗的Ⅲ期结直癌患者作为对照组。根据AJCC第7版TNM分期标准,2组患者的基本情况无统计学差异(表1)。全部患者生活质量ECOG(eastern cooperative oncology group)评分0~1分,肝肾功能及血常规正常。

表1 Ⅲ期结直肠癌术后辅助化疗中治疗组与对照组的一般资料比较Table1 Comparison of the clinical data in patients undergoing adjuvant chemotherapy after surgery of stageⅢcolorectal cancer between the two groups
1.2 治疗方法
结直肠癌根治术后病理分期为Ⅲ期的患者接受治疗,于术后2~4周内行经肝动脉置管术,以Seldinger法行经皮经股动脉穿刺,以弹簧圈栓塞胃十二指肠动脉(以防止术后导管端移位于肝总动脉或胃十二指肠动脉导致药物胃十二指肠分流),将导管置于肝固有动脉内并与化疗药盒相连,再将化疗药盒埋置于右下腹皮下,术后5~7d伤口局部水肿消退后经皮于药盒留置弯针给予化疗,21例患者置管顺利。化疗方案为草酸铂(oxaliplatin,OXA)联合FUDR:OXA 130 mg/m2静脉输注 d1,FUDR 500 mg/d 肝动脉灌注d1~5,3周重复,计划共6个周期。
对照组21例患者术后3~5周开始静脉辅助化疗,应用OXA联合亚叶酸钙(calcium folinate,CF)/5-FU 静 脉 输 注 :OXA 130mg/m2d1,CF 200 mg/5-FU475mg/m2d1~5,3周重复共6个周期。
1.3 疗效评价
主要观察终点为肝转移率及DFS(DFS定义为无转移复发及第二原发肿瘤),次要终点为OS及用药安全性。
毒副反应评价:化疗毒副反应按WHO抗癌药物急性与亚急性毒性反应分度标准判定,分为0~Ⅳ度。
随访:3年内每3个月随访1次,3~5年间半年随访1次,以后每年至少随访1次。随访内容包括体检、实验室检查及影像检查。
1.4 统计学方法
应用SPSS 13.0软件进行统计分析,计数资料采用χ2检验。应用Kaplan-Meier方法进行生存分析,对比分析应用Log-Rank时序检验,P值为双侧检验结果,P<0.05为有统计学意义。
2 结果
2.1 化疗完成情况及毒副反应
治疗组中19例患者完成6个周期化疗,1例因肝功异常仅化疗5个周期,1例化疗2个周期后因术后肠粘连导致肠梗阻停止化疗。对照组中20例完成6个周期化疗,1例化疗4个周期后因肝转移停止辅助化疗。
化疗不良反应多为Ⅰ~Ⅱ度,可耐受,不需要降低药物剂量(表2)。
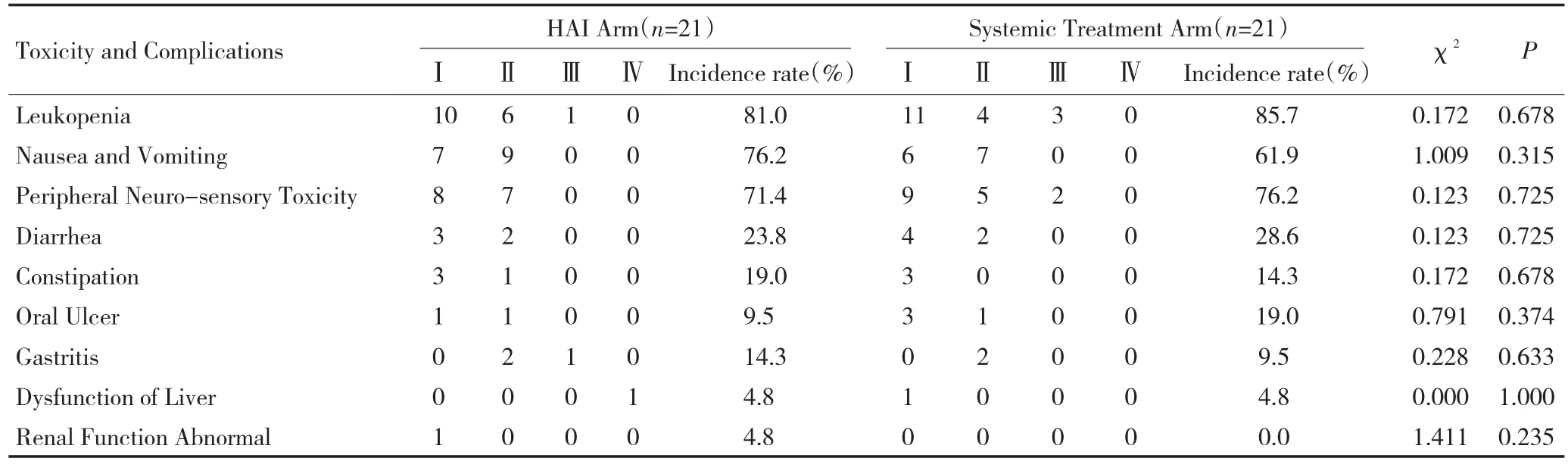
表2 化疗不良反应Table2 Toxicity and complications after chemotherapy
细胞减少、恶心呕吐、感觉神经障碍,少数患者出现Ⅰ~Ⅱ度便秘、腹泻、口腔溃疡及胃炎,在治疗或化疗停止后可自行恢复,两组之间的差异无统计学意义。治疗组中1例患者出现Ⅳ度肝功异常,停止化疗,治疗1个月好转。1例患者用药完成后出现胃溃疡,经治疗后好转。
2.2 复发转移情况
主要首发转移部位为肝和肺,其次为腹腔转移、局部复发及盆腔转移。复发转移的中位时间为18.7个月(4~70个月)。治疗组较对照组肝转移发生率较低(9.5%vs.28.6%,P=0.109),而肺转移率略高(28.6%vs.14.3%,P=0.256)。治疗组1例患者术后106个月发现原发肺癌,1例患者术后56个月发现原发膀胱癌。对照组1例患者术后47个月因心肌梗塞死亡。2组之间的首发转移部位比率并无统计学差异。

表3 治疗组与对照组不同首发转移部位Table3 Various primary sites of metastasis in the treatment and control groups
2.3 生存情况
截至2012年1月,中位随访65个月(9~119个月),治疗组出现14例DFS事件,13例死亡,对照组出现12例DFS事件,11例死亡。治疗组与对照组的中位DFS分别为43个月,37个月,5年无病生存率分别为38.1%,42.9%,差异无统计学意义(P=0.671,图1)。治疗组与对照组的中位OS分别为71个月,49个月,5年生存率分别为47.9%,45.0%,差异无统计学意义(P=0.784,图2)。

图1 治疗组与对照组的无病生存期Figuer1 Comparison in disease free survival between the treatment group and the control group

图2 治疗组与对照组的总生存期Figuer2 Comparison in overall survival time between the treatment group and the control group
3 讨论
Ⅱ~Ⅲ期的结直肠癌患者中,肝脏转移占到术后复发转移部位的83%,是最易转移的器官,也是影响DFS及OS的主要因素[4]。一些旨在预防结直肠癌术后肝转移的临床试验做了研究。一项随机临床试验将316位Ⅱ~Ⅲ期结肠癌患者分为手术联合持续肝动脉灌注5-FU 3周治疗组及单纯手术组,中位随访59个月,Ⅲ期结肠癌患者中出现生存差异,肝动脉灌注组肝转移率明显下降(RR=0.38,P=0.000 5),死亡风险降低(RR=0.37,P=0.000 9),化疗副反应较轻[5]。提示预防性肝动脉灌注化疗药物可降低肝转移率,但该临床试验的对照组未行辅助化疗,不能判断局部化疗与全身静脉化疗的优劣。Xu等[4]将222例Ⅱ~Ⅲ期结直肠癌患者随机分为术前7d给予肝动脉及原发肿瘤动脉灌注FUDR及OAX组和直接手术组,2组术后均给予标准FOLF OX4方案静脉辅助化疗。中位随访35个月,只在Ⅲ期结直肠患者中发现生存获益,前者明显降低了肝转移率(RR=0.73,P=0.02)及死亡率(RR=0.51,P=0.009)。提示对于Ⅲ期结直肠癌,在进行术后辅助化疗的前提下,术前给予肝动脉及肿瘤动脉局部灌注化疗可能降低及延迟肝转移的发生,提高总生存率。
CF/5-FU联合OXA已成为Ⅲ期结直肠癌术后的标准辅助化疗方案[6],FUDR是5-FU的衍生物,半衰期短,肝脏首过效应90%,适于肝动脉局部给药,可提高肝转移癌局部控制率[7-8]。本研究治疗组静脉应用OXA,肝动脉灌注FUDR,旨在兼顾局部控制及全身治疗。
本文中治疗组与对照组相比,肝转移率有所降低(9.5%∶28.6%,P=0.109),考虑因病例较少,其结果无统计学意义,但也提示Ⅲ期结直肠癌术后肝动脉灌注化疗可能会降低肝转移的发生率。另外也可以看到,治疗组肺转移的发生率较高(28.6%vs.14.3%,P=0.256),考虑由于FUDR肝动脉灌注,药量集中在局部,静脉只应用QXA,较静脉联合化疗对肝以外转移部位的控制较差,这与一些临床试验观察到的局部治疗组肝外转移较多的结果类似[9]。
本研究中两组间DFS及OS并无统计学差异,既往比较结直肠癌术后局部联合静脉系统辅助化疗与单用系统辅助化疗的报道很少,Nordlinger等[2]报道了Ⅱ~Ⅲ期结直肠癌术后给予经腹膜或肝门静脉局部化疗联合静脉辅助化疗与单用静脉辅助化疗的比较结果,中位随访6.8年,发现加用腹膜或门静脉局部化疗并无DFS及OS的优势。一些对于结直肠癌肝转移的研究显示,肝动脉化疗与静脉系统化疗相比,可增加肝转移病灶的缓解率,但未转化为生存优势[9]。这些临床试验多为早期(2006年以前)氟尿嘧啶类药物的单药观察,试验设计各不相同,对于进展期结直肠癌术后肝动脉辅助化疗疗效尚缺乏足够证据。
本研究中21例患者肝动脉置管顺利,未出现药盒脱落或导管堵塞现象,治疗完成后将导管取出,未出现动脉血栓。化疗副反应多为Ⅰ~Ⅱ度血白细胞减少及消化道反应,表现为便秘、腹泻、口腔溃疡等,经治疗可有效控制,未导致药物减量。OXA导致的速发型感觉神经障碍,在2组均多见(71.4%vs.76.2%),此为剂量限制性毒性,停药后好转,19.0%患者(8/42)出现迟发性感觉神经障碍,与我科此前报道相似[10]。治疗组中1例患者出现Ⅳ度肝功异常,导致停药,患者排除病毒感染等原因,考虑药物性肝损害,停化疗药物后治疗1个月肝功正常。1例患者化疗完成后出现胃溃疡,考虑经肝动脉化疗时药物进入胃十二指肠动脉所致,经治疗好转。文献报道,药物性肝炎、胆管硬化及胃十二指肠溃疡或炎症是导致停止肝动脉灌注给药的主要原因[9]。本研究中除1例因药物性肝炎导致停药外,其余药物副反应未导致治疗中断或延迟,且程度较轻,经治疗可控制。
综上所述,Ⅲ期结直肠癌术后给予经肝动脉联合静脉系统化疗可能会降低肝转移的发生率,但可能由于全身用药量较少,肺转移的发生率略高,与静脉化疗相比,未看到DFS及OS的优势,总体副反应较轻,可耐受。尚需要大样本及合理设计给药方案的临床试验观察肝动脉辅助化疗的疗效。
1 Taylor L.Adjuvant chemotherapy after resection of liver metastases from colorectal cancer[J].Eur J Cancer,2008,44(9):1198-1201.
2 Nordlinger B,Rougier P,Arnaud JP,et al.Adjuvant regional chemotherapy and systemic chemotherapy versus systemic chemotherapy alone in patients with stageⅡ-Ⅲcolorectal cancer:a multicentre randomised controlled phaseⅢtrial[J].Lancet Oncol.2005,6(7):459-468.
3 Bolton JS,O'Connell MJ,Mahoney MR,et al.Hepatic arterial infusion and systemic chemotherapy after multiple metastasectomy in patients with colorectal carcinoma metastatic to the liver:a North Central Cancer Treatment Group(NCCTG)phaseⅡstudy,92-46-52[J].Clin Colorectal Cancer,2012,11(1):31-37.
4 Xu J,Zhong Y,Weixin N,et al.Preoperative hepatic and regional arterial chemotherapy in the prevention of liver metastasis after colorectal cancer surgery[J].Ann Surg,2007,245(4):583-590.
5 Sadahiro S,Suzuki T,Ishikawa K,et al.Prophylactic hepatic arterial infusion chemotherapy for the prevention of liver metastasis in patients with colon carcinoma:a randomized control trial[J].Cancer,2004,100(3):590-597.
6 Jonker DJ,Spithoff K,Maroun J,et al.Adjuvant systemic chemotherapy for StageⅡandⅢcolon cancer after complete resection:an updated practice guideline[J].Clin Oncol,2011,23(5):314-322.
7 马力文,肖 宇,张照辉,等.氟脲苷肝动脉持续灌注联合草酸铂静脉化疗治疗肝转移癌[J].中国肿瘤临床与康复,2005,12(6):513-516.
8 Samaras P,Breitenstein S,Haile SR,et al.Selective intra-arterial chemotherapy with floxuridine as second-or third-line approach in patients with unresectable colorectal liver metastases[J].Ann Surg Oncol,2011,18(7):1924-1931.
9 Bouchahda M,Lévi F,Adam R,et al.Modern insights into hepatic arterial infusion for liver metastases from colorectal cancer[J].Eur J Cancer,2011,47(18):2681-2690.
10 王墨培,马力文,张淑兰,等.含草酸铂化疗方案治疗大肠癌神经毒性的临床研究[J].肿瘤防治杂志,2004,11(2):168-170.
