89例术后高度恶性脑胶质瘤预后影响因素分析
2013-01-07彭世义
彭世义 邬 蒙
高度恶性脑胶质瘤呈侵袭性生长,以手术治疗为主,术后易复发,目前临床上常规行术后放化疗以降低局部复发,改善生存。本文回顾分析本院诊治的89例高度恶性脑胶质瘤,以探求高度恶性脑胶质瘤的预后及预后影响因素,为合理治疗提供依据。
1 材料与方法
1.1 临床资料
收集本院2005年4月~2011年2月接受治疗的89例首次手术后并病理证实为高度恶性脑胶质瘤的临床资料,年龄4~71岁,中位年龄43岁,其中≥50岁32例,<50岁57例;男性59例,女性30例;手术全切(术后影像无残留)43例,部分切除(术后影像有残留)46例;病理为WHOⅢ级45例,Ⅳ级44例;术前影像46例病灶侵及脑室系统(脑室壁受侵认定为脑室系统受侵);多发病灶10例,其中3例有2枚病灶,4例有3枚病灶,3例超过3枚病灶;单发病灶79例,其中颞叶34例,额叶28例,顶叶7例,枕叶3例,胼胝体3例,基底节区3例,小脑1例;78例接受了12~70 Gy的术后辅助放疗,其中60~70 Gy有60例,50~60 Gy有8例,50 Gy以下10例;手术至放疗开始的间隔时间为10天至10个月,中位时间为4周;57例术后完成了1~6周期不等的化疗,其中同步放化疗11例(替莫唑胺75 mg/m2,自放疗开始的第一天至放疗结束),同步放化疗加辅助化疗11例(同期为替莫唑胺,方法同前,辅助化疗为替莫唑胺150~200 mg/m2,连续5天,四周重复,最多6个周期),35例为辅助化疗(替莫唑胺、司莫司汀、尼莫司汀、替尼泊苷+顺铂,共1~6周期不等)。
1.2 随访
末次随访2012年5月31日,总生存时间为手术开始之日至末次随访时间或死亡时间;无进展生存时间为手术开始之日至末次随访时间或首次复发时间。
1.3 统计学分析
应用SPSS 17.0软件进行统计学分析,采用Kaplan-Meier法计算本组患者总体生存率和无进展生存率,采用Log-rank检验进行单因素预后分析,采用Cox回归模型进行多因素分析,以P<0.05为差异有统计学意义。
2 结果
2.1 生存期和总生存率(OS)
全组生存时间4~50个月,中位生存时间为13个月,1、2、3年OS分别为70.2%、43.2%、24.7%;单因素分析显示手术是否全切(P=0.001)、病理分级(P=0.030)、年龄(P=0.009)与OS有关,而脑室系统是否受侵(P=0.087)、病灶单多发(P=0.061)、性别(P=0.715)、术后放疗(P=0.226)对OS均无影响;多因素分析手术切除程度、年龄是影响OS的独立预后因素(图1~3,表1~2)。

图1 不同年龄组的总生存曲线比较Figure1 Overall survival curves in patients of different age groups
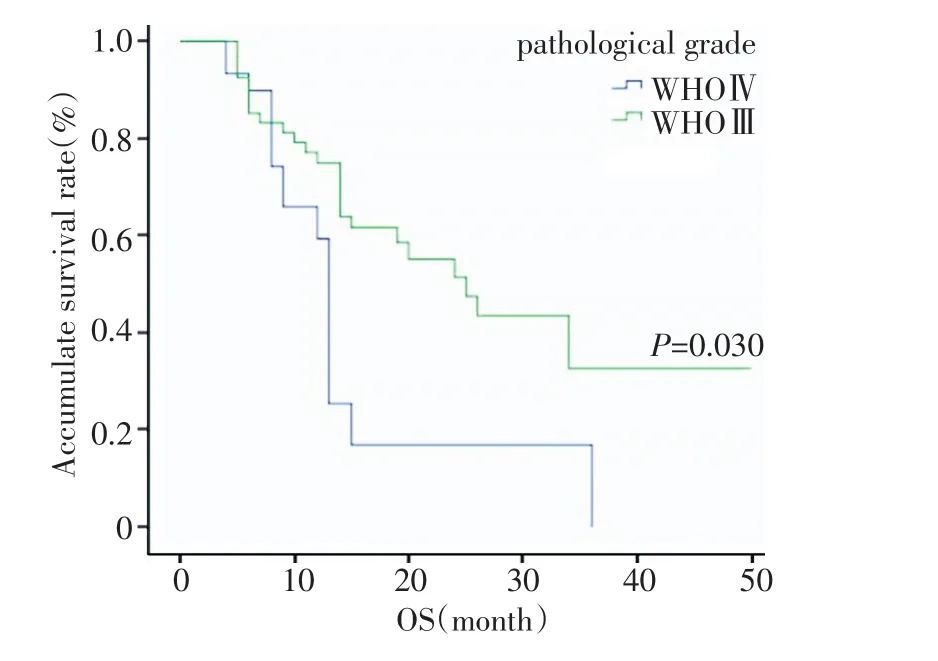
图2 不同病理分级的总生存曲线比较Figure2 Overall survival curves in patients with various pathological grades

图3 不同手术切除程度的总生存曲线比较Figure3 Overall survival curves in patients with resection of different extent
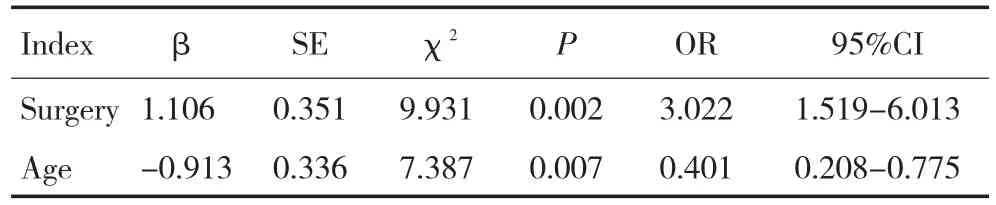
表1 影响OS的多因素分析Table1 Multivariate analysis of prognostic factors for OS rates in 89 high grade glioma patients

表2 影响PFS的多因素分析Table2 Multivariate analysis of prognostic factors for PFS rates in 89 high grade glioma patients
2.2 无进展生存率(PFS)
全组1、2、3年PFS分别为55.1%、36.9%、25.3%;单因素分析显示手术是否全切(P=0.001)、脑室系统是否受侵(P=0.041)、术后是否放疗(P=0.000)与PFS有关,而病理分级(P=0.141)、年龄(P=0.127)、病灶单多发(P=0.108)、性别(P=0.619)对PFS均无影响;多因素分析显示手术切除程度及术后是否放疗是影响PFS的独立预后因素(图4~6,表1~3)。

表3 影响OS及PFS的单因素分析Table3 Univariate analysis of prognostic factors affecting OS and PFS rates in 89 high grade glioma patients
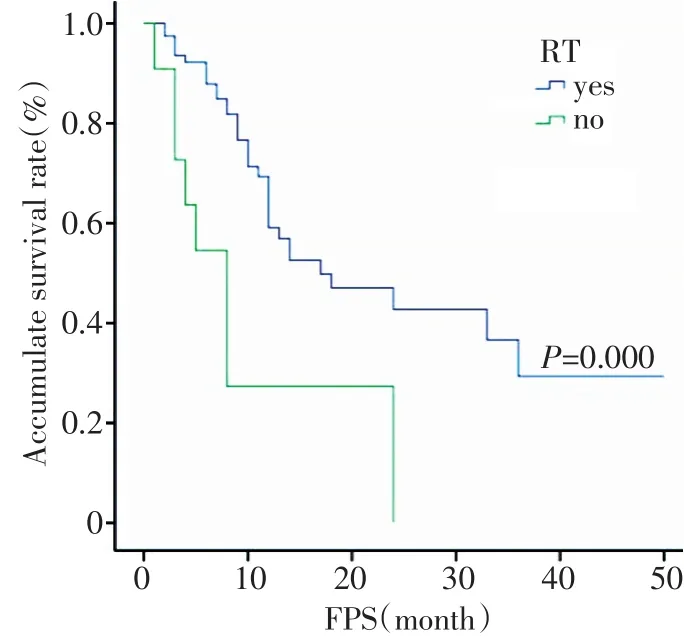
图4 术后是否放疗的无进展生存曲线比较Figure4 Progression-free survival curves in patients with or without radiotherapy after surgery

图5 不同手术切除程度的无进展生存曲线比较Figure5 Progression-free survival curves in patients with resection of different extent
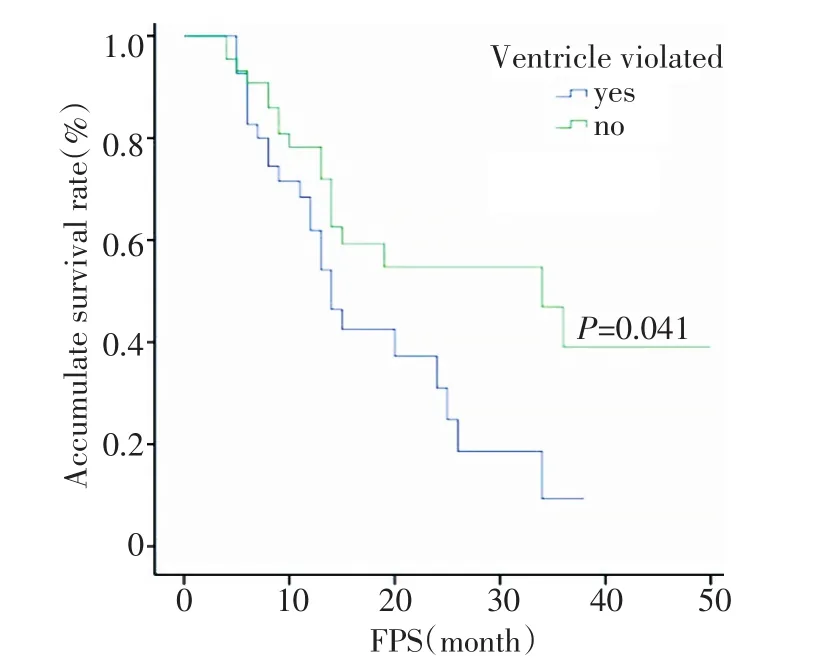
图6 脑室系统是否受侵的无进展生存曲线比较Figure6 Progression-free survival curves in patients with or without ventriclular violation
2.3 复发部位
全组41例出现复发及播散,其中单纯原位复发27例(65.9%),单纯远隔部位复发7例(17.1%),两者同时存在有7例(17.1%),2例出现脊髓播散;46例有脑室系统受侵者,单纯原位复发13例(28.3%),远隔部位复发11例(23.9%);43例无脑室系统受侵者,单纯原位复发14例(32.6%),远隔部位复发3例(7.0%,表4)。

表4 脑室系统是否受侵与复发部位关系 例Table4 Relationship between the location of tumor recurrence and damaged ventricle(n)
3 讨论
高度恶性胶质瘤也即2007年WHO中枢神经系统肿瘤病理分类中Ⅲ~Ⅳ级胶质瘤,文献报道多发病灶约占6.5~7.5%[1-2],生存率较单发病灶者差,本组资料11.2%患者诊断时就表现为多发病灶,略高于文献报道,OS劣于单发病灶,差异接近有统计学意义(P=0.061),但PFS的差异无统计学意义,可能与本组资料中多发病灶患者均接受了化疗有关。本病年轻患者预后相对较好[2-5],本组资料多因素分析提示年轻患者OS优于年长患者(P<0.05),可能与年轻患者对各种治疗有较好耐受性有关。
手术是高级别脑胶质瘤的主要治疗手段,可以明确病理,缓解颅高压,减少瘤负荷,为后续放化疗创造条件。研究显示肿瘤的切除程度与预后密切相关,肿瘤全切的生存率明显优于部分切除,差异有统计学意义[3,6-8]。国内邹燕梅等[9]报道手术全切者的1、3生存率分别为100.0%、78.6%,而部分切除的分别为37.8%、11.1%(P<0.05);本组多因素分析显示手术是否全切,无论是OS还是PFS,差异均有统计学意义(P<0.05)。有报道称恶性胶质瘤即使肉眼全切,仍可能有约1g左右肿瘤残留,将成为日后肿瘤复发根源。术后放疗能一定程度控制残存肿瘤,目前已成标准治疗[10]。本研究显示术后放疗延长了无进展生存时间,但未能改善OS,可能与本组病例多为外院手术,手术至放疗间隔时间较长(中位时间4周),抵消了放疗益处。有文献报道手术至放疗开始时间,每延长一周,死亡风险增加8.9%,延长6周,中位生存时间缩短11周[4]。文献研究显示放疗剂量50~60 Gy与60~70 Gy对生存率及局部控制率相似,但明显优于50 Gy以下剂量组,然而进一步提高剂量至90 Gy,也不能改善生存[11-12]。本组78例行术后放疗患者,10例患者因各种原因未完成50Gy放疗剂量,完成组在PFS方面优于未完成组。放疗剂量60~70 Gy组与50~60 Gy组相比,在OS及PFS方面均未显示优势。
文献报道[8,10,13-14]病理Ⅲ级生存率优于Ⅳ级,本组结果显示Ⅲ级和Ⅳ级的2年OS分别为54.7%和31.0%(P=0.030),但PFS差异无统计学意义。神经解剖学结果认为散在的肿瘤细胞一般位于临床大体肿瘤周围2~3 cm,且术后复发80%左右在原肿瘤周围2 cm以内,超过肿瘤2 cm在水肿区内复发大约为10%,超过水肿区复发只占5%[15]。本组89例患者在随后复查中,共观察到41例出现复发及播散,单纯原位复发27例(占65.9%),单纯远隔部位复发7例(占17.1%),两者同时存在有7例(占17.1%);46例有脑室系统受侵者,11例出现远隔部位复发。43例无脑室系统受侵者,仅3例出现远隔部位复发。原因可能为脑室系统受侵后,肿瘤细胞更易随脑脊液循环播散。
目前高度恶性脑胶质瘤的预后仍不能令人满意,本组资料提示手术切除程度、年龄是影响OS的独立预后因素,而手术切除程度及术后是否放疗是影响PFS的独立预后因素。肿瘤原位复发仍是本病复发的主要模式,脑室系统受侵增加了远处播散概率,因此本病还应以手术治疗为主,术中尽可能完整切除肿瘤,术后尽早辅以放化疗。
1 汪 洋,盛晓芳,高 晶,等.高分级神经胶质瘤112例术后放、化疗疗效及其预后分析[J].肿瘤,2009,29(7):688-672.
2 Duncan GG,Goodman GB,Ludgate CM,et al.The treatment of adult supratentorial high grade astrocytomas[J].J Neuro Oncol,1992,13(1):63-72.
3 atalán-Uribarrena G,Bilbao-Barandica G,Pomposo-Gaztelu I,et al.Prognostic factors and survival in a prospective cohort of pa-tients with high-grade glioma treated with carmustine wafers or temozolomide on an intention-to-treat basis[J].Acta Neurochir,2012,154(2):211-222.
4 Irwin C,Hunn M,Purdie G,et al.Delay in radiotherapy shortens survival in patients with high grade glioma[J].J Neuro Oncol,2007,85(3):339-343.
5 Mohamed A,Ahmed E.Hypofractionated conformal irradiation of patients with malignant glioma[J].J Egypt Natl Cancer Insti,2012,24:139-143.
6 Dea N,Fournier-Gosselin MP,Mathieu D,et al.Does extent of resection impact survival in patients bearing glioblastoma[J].Can J Neurol Sci,2012,39(5):632-637.
7 Uehara K,Sasayama T,Miyawaki D,et al.Patterns of failure after multimodal treatments for high-grade glioma:effectiveness of MIB-1 labeling index[J].Radiat Oncol,2012,26(7):104-115.
8 Yamaguchi S,Kobayashi H,Terasaka S,et al.The impact of extent of resection and histological subtype on the outcome of adult patients with high-grade gliomas[J].Jpn J Clin Oncol,2012,42(4):270-277.
9 邹燕梅,熊 华,于世英.恶性胶质瘤术后治疗疗效及预后因素分析[J].实用癌症杂志,2009,24(2):184-187.
10 Izmalov TR,Pan'shin GA,Datsenko PV.The role of age and tumor grade in the choice of fractionation regimen in patients with?high-grade gliomas[J].Vopr Onkol,2012,58(3):374-379.
11 Lee SW,Fraass BA,Marsh LH,et al.Patterns of failure following high-dose 3-D conformal radiotherapy for high-grade astrocytomas:a quantitative dosimetric study[J].Int J Radiat Oncol Biol Phys,1999,43(1):79-88.
12 Chan JL,Lee SW,Fraass BA,et al.Survival and failure patterns of high-grade gliomas after three-dimensional conformal radiotherapy[J].J Clin Oncol,2002,20(6):1635-1642.
13 Wei T,Denice D,Jia H,et al.Conditional survival of high-grade glioma in Los Angeles County during the year 1990-2000[J].J Neuro Oncol,2012,110(1):145-152.
14 顾文栋,裴红蕾.69例脑胶质瘤术后三维适形放射治疗临床分析[J].中国神经肿瘤杂志,2011,9(2):124-127.
15 Hess CF,Schaaf JC,Kortmann RD,et al.Malignant glioma:patterns of failure following individually tailored limited volume irradiation[J].Radiother Oncol,1994,30(2):146-149.
