巯基化合物的合成及应用于环氧甲基丙烯酸酯的紫外光固化研究
2013-01-07彭东明苏小爱刘艳飞帅海涛盛毓
彭东明 ,苏小爱,刘艳飞 ,帅海涛,盛毓
(1. 中南大学 化学化工学院,湖南 长沙,410083;2. 湖南中医药大学 药学院,湖南 长沙,410208;3. 中南大学 有色金属资源化学教育部重点实验室,湖南 长沙,410083)
巯基化合物的应用已有100多年历史,应用范围从生物化学到高分子科学领域[1]。2-甲基-1,3-丙二醇缩二(3-巯基丙酸)酯(PD3ME)、三羟甲基丙烷缩三(3-巯基丙酸)酯(HPT3ME)、季戊四醇缩四(3-巯基丙酸)酯(PT3ME)是典型引入巯基的有机化合物,可用作有机中间体、交联剂、环氧树脂紫外光固化剂等[2−3]。紫外光(UV)固化技术是20世纪60年代末开发出的一种全新绿色技术。它是指在紫外光照射后,液态的低聚物(包括单体)发生光化学反应,经过交联聚合而形成固化产物的过程[4]。与传统固化相比,紫外光固化具有低污染、低能耗、快固化、高生产效率的特性。引入巯基后,可使聚合机理由链锁聚合转变为逐步共聚[5−7],共聚体系聚合反应速率不受氧的阻碍,固化时不需要通入惰性气体保护,从而大大节约成本[8]。此外,传统体系的光引发剂用量比较大,由于光引发剂会吸收、衰减紫外光,因此,光极难照射进更深的层次,不能制备较厚试件。而引入巯基的光聚合反应所需光引发剂用量非常少,甚至可以不用,使得利用光固化制备比较厚的试件成为可能。近年来,限制挥发有机物(VOC)排放成为一种趋势,促进了 UV光固化在涂料、光刻胶以及浮雕印刷板制造等工业中的发展应用[9]。Gramer等[10−16]合成了不同官能度的巯基化合物。本文作者分别以2-甲基-1,3-丙二醇、三羟甲基丙烷、季戊四醇与3-巯基丙酸发生酯化反应,合成二、三、四官能度的巯基化合物,制备中用环己烷代替甲苯作带水剂,避免甲苯在实验过程中所带来的毒副作用。采用正交实验法优化了制备工艺,并将合成的巯基化合物用于环氧甲基丙烯酸酯的紫外光固化研究,提高其光聚合反应速率和双键转化率。
1 实验部分
1.1 原料与仪器
实验用原料包括:1, 3-丙二醇、三羟甲基丙烷、季戊四醇、3-巯基丙酸、安息香双甲醚、对甲苯磺酸,均为分析纯(上海晶纯实业有限公司生产);无水硫酸镁、氯化钠,均为分析纯(天津市大茂化学试剂厂生产);环己烷,分析纯(苏州恒源化工贸易有限公司生产);环氧树脂 E-51、甲基丙烯酸酯(天津市化学试剂研究所生产)。
实验仪器包括:傅里叶红外光谱仪Nicolet380(美国尼高力公司制造,KBr窗片涂膜);核磁共振氢谱Bruker Avance 500 MHz(瑞士 Bruker 公司制造),CDCl3作溶剂四甲基硅烷作内标;紫外光源设备(长沙市岳麓区鑫辉特种光源电器厂制造)。
1.2 PD3ME,HPT3ME和 PT3ME的合成及分离提纯
PD3ME,HPT3ME和PT3ME的合成路线如图1所示,采用对甲苯磺酸为催化剂,反应遵循一般酯化反应原理。
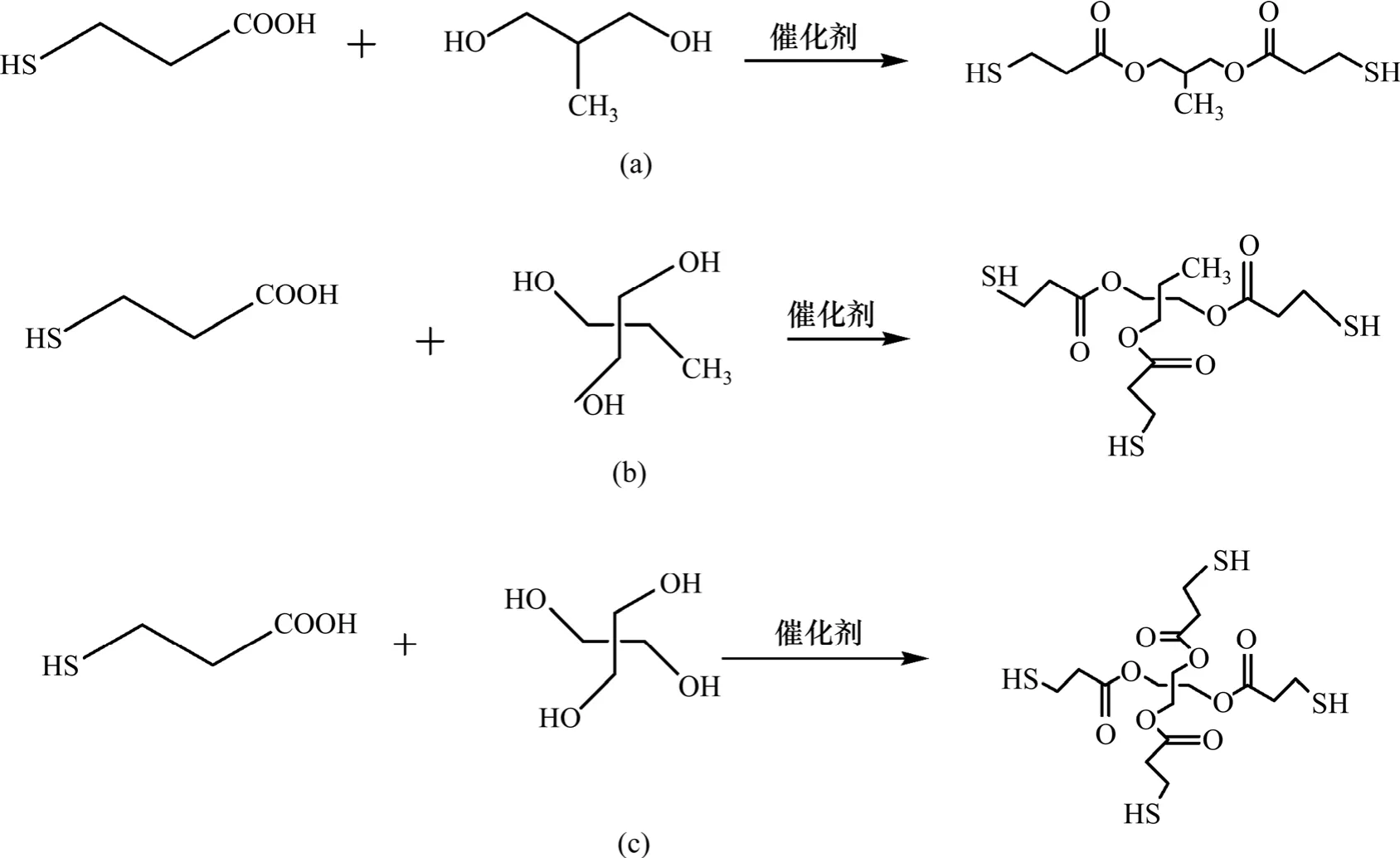
图1 PD3ME(a)、HPT3ME(b)和PT3ME(c)的合成路线Fig.1 Synthetic routes of PD3ME, HPT3ME and PT3ME
称取一定量的 2-甲基-1,3-丙二醇(或三羟甲基丙烷、季戊四醇)、对甲苯磺酸、环己烷,倒入装有油水分离器、冷凝管、温度计的250 mL三口烧瓶中,磁力搅拌、按正交试验所设温度油浴加热,待2-甲基-1,3-丙二醇(或三羟甲基丙烷、季戊四醇)溶解后,量取一定量3-巯基丙酸,用滴液漏斗滴入反应瓶中,反应至油水分离器中无水生成,TLC 跟踪至醇反应完全。
将产物冷却至室温,用去离子水洗掉反应中剩余的酸,至中性时,再用环己烷萃取,取有机层,加1.0 g无水硫酸镁吸水12 h,抽滤去掉无水硫酸镁,在65 ℃时用旋转蒸发仪蒸除环己烷,得产品。
对合成的 PD3ME,HPT3ME和PT3ME进行傅里叶红外光谱(FTIR)和核磁共振氢谱表征。
1.3 正交试验优化PD3ME,HPT3ME和PT3ME的制备工艺
本实验在预实验的基础上,选取制备中的5个关键因素即酸与醇的物质的量比n(酸):n(醇)、催化剂用量、反应时间、反应温度、带水剂用量,以这5个因素 4 个水平(见表 1~3),按照 L16(45)表(见表 4~6)进行实验设计。在制剂方案选择时,本实验采用产品收率作为评价指标,优选出最佳生产工艺条件。

表1 PD3ME正交试验的因素与水平Table 1 Factor levels for experimental design of PD3ME
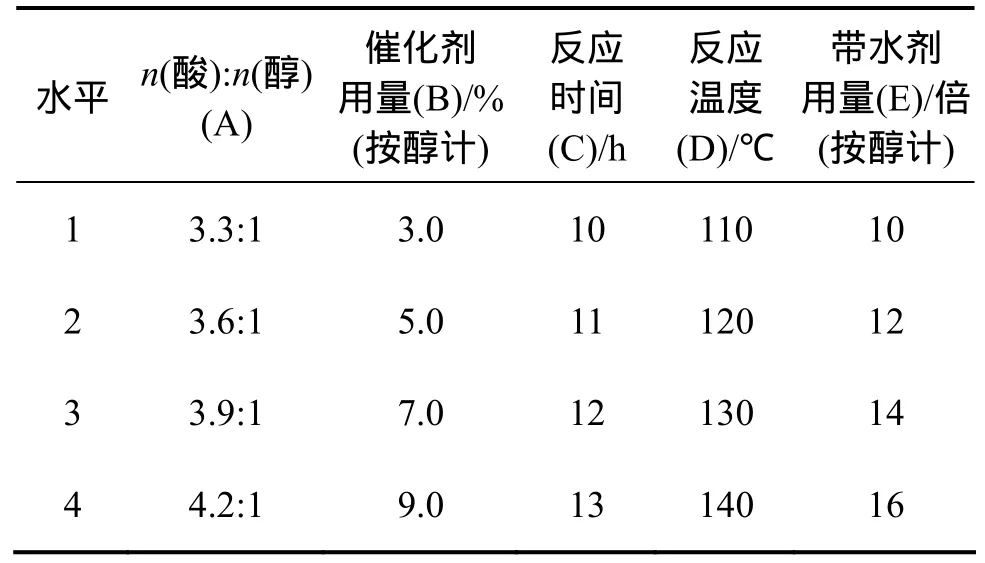
表2 HPT3ME正交试验的因素与水平Table 2 Factor levels for experimental design of HPT3ME

表3 PT3ME正交试验的因素与水平Table 3 Factor levels for experimental design of PT3ME
1.4 环氧甲基丙烯酸酯、环氧甲基丙烯酸酯−巯基化合物的制备及紫外光固化研究
EA和EAM的合成路线如图2所示,环氧树脂与甲基丙烯酸酯在催化剂等条件下进行酯交换反应,从而在环氧树脂端基处引入双键。双键再与巯基在紫外光照下结合,达到紫外光固化目的。
在装有搅拌器、温度计、恒压滴液漏斗、冷凝管的四口烧瓶中加入一定量的环氧树脂,加温至105 ℃,滴加入一定量甲基丙烯酸酯和催化剂,大约30 min加完,继续反应30 min,升温至110 ℃,反应6 h,测定体系酸度为5 mg/g。
将一定量上述合成 EA分别与一定量 PD3ME,HPT3ME和 PT3ME 在紫外光辐照下聚合,加入0.1%(质量分数)光引发剂安息香双甲醚;同时以不含巯基化合物的环氧甲基丙烯酸做对比,分别加入质量分数为 0.5%和 2.5%的光引发剂安息香双甲醚进行紫外光固化。红外跟踪双键转化率(以C=C中C—H在810 cm−1附近面外弯曲振动和 1630 cm−1附近伸缩振动的峰面积计算双键转化率)。
2 结果与讨论
2.1 PD3ME,HPT3ME和PT3ME的傅里叶红外光谱表征
图3所示为PD3ME,HPT3ME和PT3ME的IR谱图。从图3可知:PD3ME,HPT3ME和PT3ME三者之间特征峰相同,1 750 cm−1附近为酯的 C=O,2 560 cm−1附近处为巯基伸缩振动峰,1 167 cm−1处为酯的C—O—C的伸缩振动吸收峰,3 500 cm−1附近的羟基—OH的特征吸收峰很小甚至没有,说明产物中羟基很少[13];3种谱结构相符,说明巯基丙酸与2-甲基-1,3丙二醇、三羟甲基丙烷、季戊四醇确实发生酯化反应,生成含巯基的酯。

图2 EA和EAM的合成路线Fig.2 Synthetic routes of EA and EAM

图3 PD3ME,HPT3ME和PT3ME红外光图Fig.3 IR spectra of PD3ME, HPT3ME and PT3ME
2.2 PD3ME,HPT3ME和 PT3ME核磁共振氢谱表征
PD3ME,HPT3ME和PT3ME的1H NMR谱图如图4所示,化学位移为δ:PD3ME 1.01(d,3H)1.62(t,2H),2.19(m,4H),2.66(t,4H),2.78(q,4H),4.06(d,4H);HPT3ME 0.89(m,3H),1.48(m,2H),1.60(m,3H),2.63(q,6H),2.74(m,6H),4.05(d,6H);PT3ME 1.64(t,4H),2.68(m,8H),2.77(m,8H),4.19(s,4H)。其化学位移在 4.78×10−6附近无峰,证明羟基反应完全,所以,生成物为PD3ME,HPT3ME和PT3ME。
2.3 PD3ME,HPT3ME和PT3ME的正交试验
表4~6所示分别为为按L16(45)正交试验设计制备PD3ME,HPT3ME和PT3ME的实验结果及极差分析结果。根据正交实验结果可确定最佳的实验条件如下。
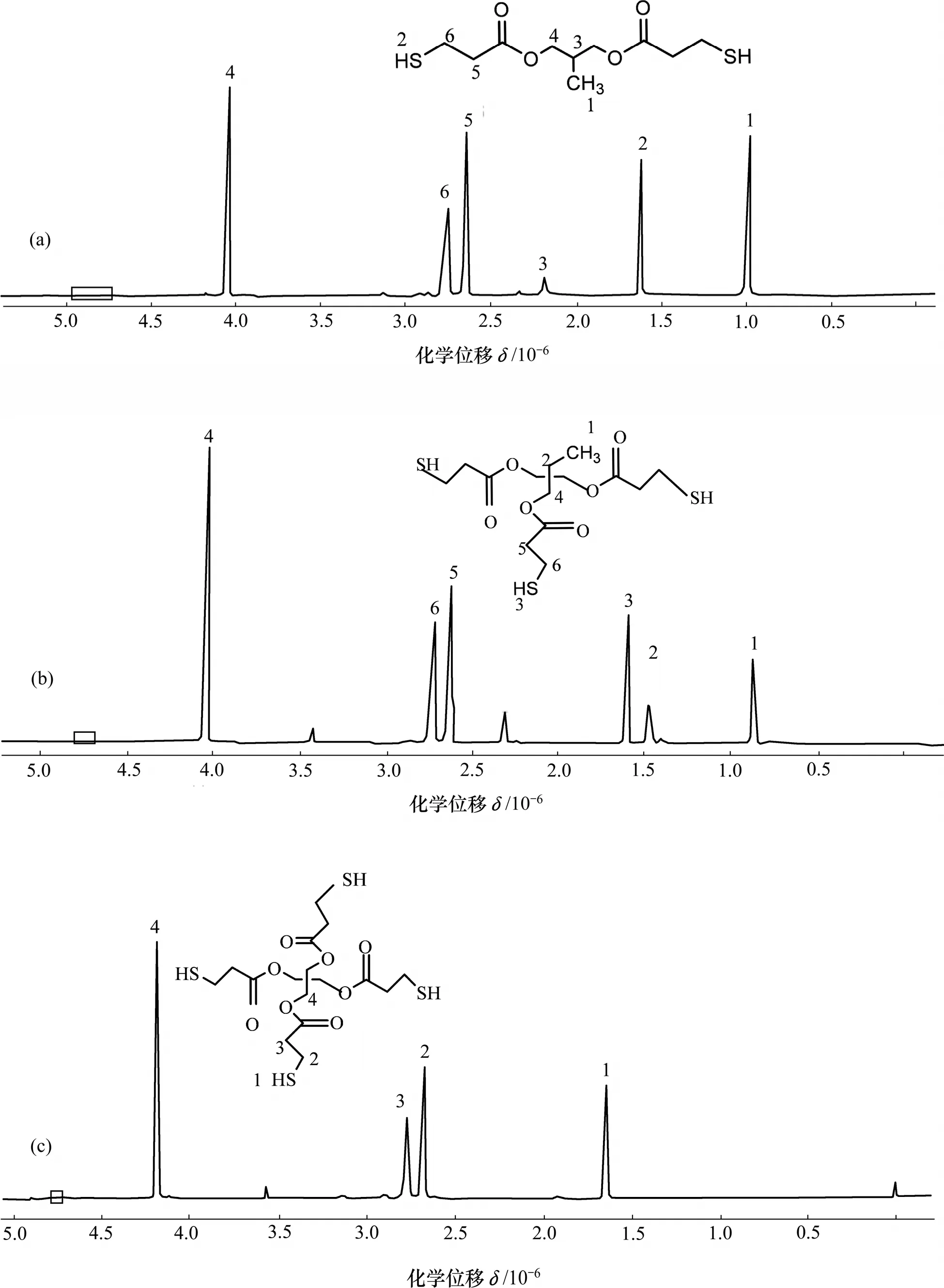
图4 PD3ME,HPT3ME和PT3ME核磁共振氢谱图Fig.4 1H NMR spectra of PD3ME, HPT3ME and PT3ME
(1) 对 PD3ME,n(酸):n(醇)=2.4:1,反应时间为11 h,反应温度为120 ℃,催化剂用量为3%(按醇计),带水剂用量16倍(按醇计),产率为96.4%,由极差R分析表明各因素对制备PD3ME的影响由大至小依次为反应时间(C)、反应温度(D)、催化剂用量(B)、带水剂用量(E)、酸醇比(A)。
(2) 对 HPT3ME,n(酸):n(醇)=3.6:1,反应时间为12 h,反应温度为120 ℃,催化剂用量为9%(按醇计),带水剂用量为10倍(按醇计),产率为91.8%,由极差R分析表明各因素对制备HPT3ME的影响由大至小依次为反应时间(C)、催化剂用量(B)、反应温度(D)、带水剂用量(E)、酸醇比(A)。
(3) 对 PT3ME,n(酸):n(醇)=5.5:1,反应时间为 13 h,反应温度为130 ℃,催化剂用量为5%(按醇计),带水剂用量10倍(按醇计),产率为86.3%,由极差R分析表明各因素对制备 PT3ME的影响由大至小依次为催化剂用量(B)、酸醇比(A)、带水剂用量(E)、反应温度(D)、反应时间(C)。

表4 PD3ME正交试验结果及极差分析结果Table 4 Results of orthogonal test and extreme difference analysis for PD3ME
2.4 环氧甲基丙烯酸酯−巯基化合物光聚合速率
将制备的环氧甲基丙烯酸酯−巯基化合物在紫外光辐照下聚合,同时以不含巯基的环氧甲基丙烯酸酯作对比,用红外跟踪双键转化率,图5所示为EA在加入质量分数为 0.5%和 2.5%的光引发剂的双键转化率−时间关系图。从图5可见:随着光引发剂加入量的增加,双键转化率由9.7%增加到20.3%。图6所示为EAM 在加入质量分数为 0.1%的光引发剂的双键转化率−时间关系图。对比图5和图6可见:引入巯基之后,双键转化率由20%增长到88%,而且引发剂质量分数只需0.1%;从图6可见:双键转化率从低到高分别为PD3ME,HPT3ME和PT3ME,随着巯基官能团的增加,提高巯基与双键的接触,从而加大反应速率。
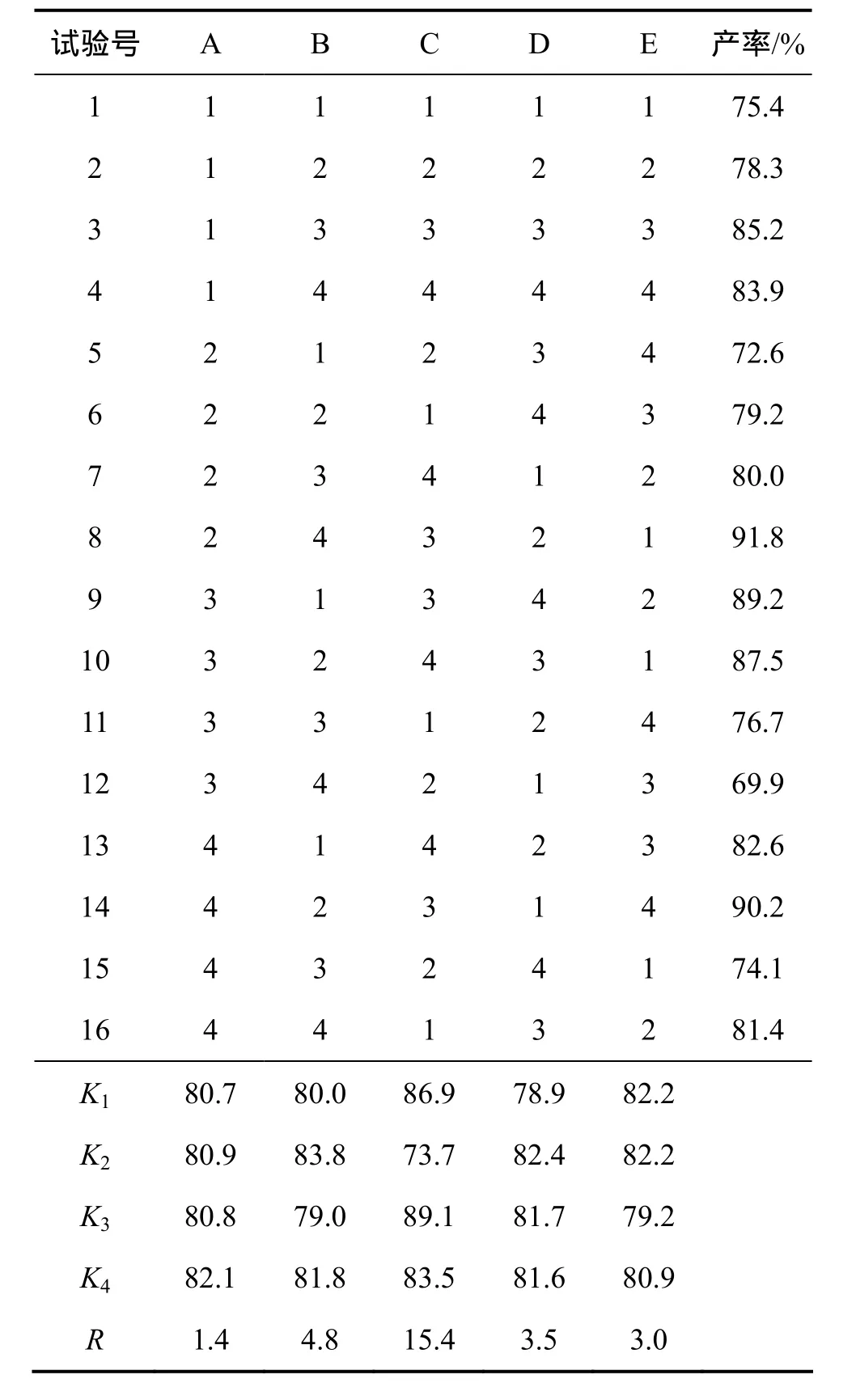
表5 HPT3ME正交试验结果及极差分析结果Table 5 Results of orthogonal test and extreme difference analysis for HPT3ME

表6 PT3ME正交试验结果及极差分析结果Table 6 Results of orthogonal test and extreme difference analysis for PT3ME
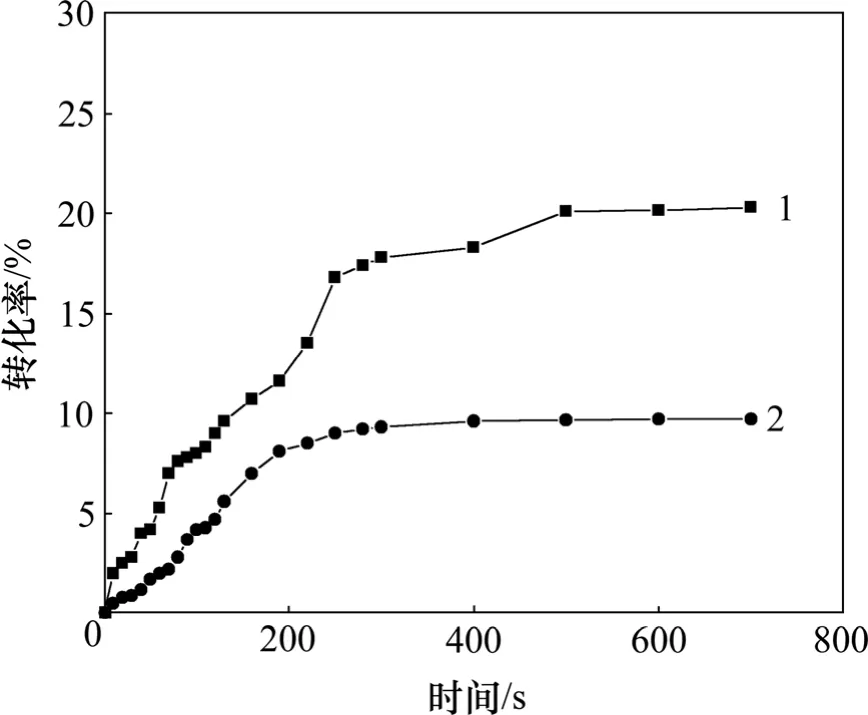
图5 纯环氧甲基丙烯酸酯双键转化率−时间关系图Fig.5 Double bond conversion−time relationship of pure epoxy methyl acrylate

图6 环氧甲基丙烯酸酯−巯基化合物体系(0.1%)双键转化率−时间关系图Fig.6 Double bond conversion−time relationship of epoxy methyl acrylate−thiol compounds
3 结论
(1) 以对甲苯磺酸为催化剂,分别以 2-甲基-1,3-丙二醇、三羟甲基丙烷、季戊四醇与3-巯基丙酸进行酯化反应,合成了巯基化合物2-甲基-1,3-丙二醇缩二(3-巯基丙酸)酯(PD3ME)、三羟甲基丙烷缩三(3-巯基丙酸)酯 (HPT3ME)、季戊四醇缩四(3-巯基丙酸)酯(PT3ME),并采用FTIR和1H NMR进行了结构确证。通过正交试验确定PD3ME,HPT3ME和PT3ME制备的最佳反应条件如下。
① PD3ME最佳反应条件:n(酸):n(醇)=2.4:1,反应时间为 11 h,反应温度为 120 ℃,催化剂用量为3%(按醇计),带水剂用量 16倍(按醇计),产率为96.4%。
② HPT3ME最佳反应条件:n(酸):n(醇)=3.6:1,反应时间为12 h,反应温度为120 ℃,催化剂用量为9%(按醇计),带水剂用量 10倍(按醇计),产率为91.8%。
③ PT3ME最佳反应条件:n(酸):n(醇)=5.5:1,反应时间为 13 h,反应温度为 130 ℃,催化剂用量为5%(按醇计),带水剂用量 10倍(按醇计),产率为86.3%。
(2) 通过在环氧甲基丙烯酸酯中引入巯基化合物替代传统固化剂,使得聚合反应速率及转化率大大提高,双键转化率从20%增加到78%以上;同时极大程度减少光引发剂用量,从2.5%减少到0.1%。
[1] 宋家乐, 陈立新. 巯基/烯类单体光引发聚合研究发展[J]. 化学通报, 2006, 69(4): 1−6.SONG Jale, CHEN Lixin. Progress of thiol-ene photopolymerization[J]. Chemistry Bulletin, 2006, 69(4): 1−6.
[2] Rosh T A. Mayadunne, Graeme M. Multiarm organic compounds for use as riversible chain-thransfer agents in living radical polymerizations[J]. Tetrahedron Letters, 2002, 43(38):6811−6814.
[3] 康富春, 张宏伟. 硫醇固化剂的合成和应用[J]. 热固性树脂,2006, 21(3): 15−19.KANG Fuchun, ZHANG Hongwei. The synthesis and application of polythiol hardener[J]. Thermosetting Resin, 2006,21(3): 15−19.
[4] 廖峰, 赖学军. 紫外光固化环氧丙烯酸酯的研究进展[J]. 化学与黏合, 2010, 32(3): 46−50.LIAO Feng, LAI Xuejun. Research progress in study on UV-curable epoxy acrylate resin[J]. Chemistry and Adhesion 2010, 32(3): 46−50.
[5] 王亚洲, 陈立新. 巯基化合物结构对巯基/乙烯基聚合体系紫外光固化反应活性的影响[J]. 化学学报, 2008, 20(66):2285−2288.WANG Yazhou, CHEN Lixin. Structural effect of thiol-compounds on the activity of thiol-ene system cured by ultraviolet[J]. Acta Chim Ica Sinica, 2008, 20(66): 2285−2288.
[6] Holyce, Leety, Roper T J. Thi01-Enes: Chemistry of the past with promise for the future[J]. Journal of Polymer Science(A):Polymer Chemistry, 2004, 42(21): 5301−5338.
[7] Neil B, Cramer J, Paul Scott, et al. Photopolymerizations of thiol-ene polymers without photoinitiators[J]. Macromolecules,2002, 35(14): 5361−5365.
[8] Cramer N B, Davies T. Mechanism and modeling of a thiol: Ene photopolymerizatio[J]. Macromolecules, 2003, 36(12): 4631−4636.
[9] 李善君, 纪才佳. 高分子光化学原理及应用[M]. 上海: 复旦大学出版社, 1993: 190−191.LI Shanjun, JI Caijia. The principles and applications of polymer photochemical[M]. Shanghai: The Press of Fudan University,1993: 190−191.
[10] Gramer N B, Reddy S K, O′Brien A K, et al. Thiol-ene photopolymerization mechanism and rate limiting step changes for various vinyl functional group chemistries[J].Macromolecules, 2003, 36(21): 7964−7969.
[11] 宋家乐, 陈立新. 光固化巯基一乙烯基硅氮烷陶瓷前驱体制备氮化硅陶瓷[J]. 航空材料学报, 2008, 28(6): 88−92.SONG Jiale, CHEN Lixin. Preparation of silicon nitride by light curing sulfhydryl-vinyl silazane preceramics ceramics[J]. Journal of Aeronautical Materials, 2008, 28(6): 88−92.
[12] Reddy S K, Cramer N B, Cross T, et al. Polymer-derived ceramic materials from thiol-ene Photopolymerizations[J]. Chem Mater,2003, 15(22): 4257−4261.
[13] Essilor International. Synthesis of pentaerythritol 3-mercapropionic ester: EP2147685 A1[P]. 2010.
[14] 李健, 张连红. 季戊四醇四(2-巯基乙酸)酯的合成研究[J]. 广州化工, 2010, 38(10): 143−144.LI Jian, ZHANG Lianhong. Study on the synthesis of pentaerythritol tetrakis(2-mercaptoacetate)[J]. Guangzhou Chemical Industry, 2010, 38(10): 143−144.
[15] 张教强, 陈少杰. 季戊四醇四(3-巯基丙酸)酯/乙烯基硅氮烷体系光聚合反应动力学红外光谱法研究[J]. 应用化工, 2008,37(11): 1285−1288.ZHANG Jiaoqiang, CHEN Shaojie. Study on the photopolymerization kinetics of thiol·vinyl silazane system by infrared spectrum method[J]. Applied Chemical Industry, 2008,37(11): 1285−1288.
[16] 陈伟伟, 陈立新. 巯基化合物的合成及巯基-乙烯基光固化工艺[J]. 高分子材料科学与工程, 2008, 24(6): 65−67.CHEN Weiwei, CHEN Lixin. Synthesis of thiol-compounds and process of thiol-vinyl light curing[J]. Polymer Materials Science and Engineering, 2008, 24(6): 65−67.
