响应面法优化提取柳树叶化感物质及抑藻效应
2013-01-08江中央郭沛涌陈丽平许文修万禁禁李世雄
江中央 ,郭沛涌 ,陈丽平 ,许文修 ,万禁禁 ,李世雄
(1.华侨大学 环境科学与工程系,福建 厦门,361021;2.华侨大学 环境与资源技术研究所,福建 厦门,361021)
水体富营养化加剧导致藻类爆发性生长形成水华,对水体的生态功能和饮用水源的安全产生严重影响。向水体中直接投加化学杀藻剂(如硫酸铜)仍是现有的最常用、最简便且效果较好的抑藻方法之一。这类杀藻剂虽能短时间达到杀灭藻的效果,但因易形成二次污染等问题,严重危害生态环境,甚至危及人类健康[1]。利用植物产生的化感物质抑制藻类的生长具有高效、生态安全性较好等特点,为寻找环境友好的抑藻方法提供了一种思路[2−3]。化感作用即一种植物通过向环境中释放化学物质(化感物质)影响其他生物生长的现象[4]。目前,利用植物化感作用及化感物质抑制藻类生长的方式主要包括 3类:(1) 在水体中种植植物,使其在水体中分泌化感物质抑制藻类生长,如用人工浮岛抑藻[5];(2) 将干燥的植物体投到待处理水体中,植物体腐败降解后释放化感物质抑藻,如大麦秸秆[6−7];(3) 从植物体中提取化感物质投加到待处理水体中进行藻类控制[8−9]。其中,最后一类方式操作简便,易工业化,更受人们推崇[4,10]。但目前该方面的研究主要集中于沉水植物[11−13]、挺水植物[14−16]和浮水植物[17]等水生植物,对于陆生植物尤其是大型木本植物的研究较少,而基于响应面法超声辅助技术提取植物抑藻物质的研究更少。在此,本文作者以广泛分布于河岸旁、生物量大、生长快的柳树为研究对象,利用该方法最大限度提取植物抑藻物质,分析其主要成分,研究化感物质对蛋白核小球藻生长的影响,探讨可能的抑藻机理,以期为利用陆生植物化感物质控制水华提供参考。
1 实验材料和方法
1.1 实验材料及试剂
柳树叶片采自华侨大学校园内绿化区。取新采集的柳树叶片,置于60 ℃烘箱中干燥48 h,用粉碎机粉碎,保存。蛋白核小球藻(Chlorella pyrenoidosa)购于中国科学院武汉水生所并培养于SE培养基[18]中。试验前将藻分别接种于新配置的 SE培养基,使之达指数生长期后用于试验。
试验中的试剂均为分析纯,用于质谱检测的溶剂甲醇为色谱纯。
1.2 柳树叶化感物质的提取方法及分离流程
称取柳树叶粉末于具塞锥形瓶中,加入乙醇溶液,超声波提取(超声功率为 250 W)。超声结束后,提取液先后经滤纸抽滤、孔径为0.22 μm有机系滤膜抽滤用以去除颗粒物,得到清液。然后,通过旋转蒸发除去溶剂,得到浸膏,备用。
分离流程:柳树叶粉末→乙醇超声提取→过滤浓缩→乙酸乙酯萃取→硅胶柱层析(以三氯甲烷和甲醇为淋洗剂,配比为3∶1)→甲醇重结晶→化感物质(结构鉴定)。
1.3 提取条件优化方案
前期单因素试验发现,在乙醇体积分数为70%,时间为180 min,温度为50 ℃和液料比为40.03∶1 mL/g时,柳树叶活性物质有较好的抑藻作用。因此,本实验以上述4个因素作为考察对象,采用Design Expert 7.0统计分析软件,以中心组合设计(central composite design (CCD))为基础的响应面分析法设计实验,以获取最适实验条件。四因素五水平编码表见表1。
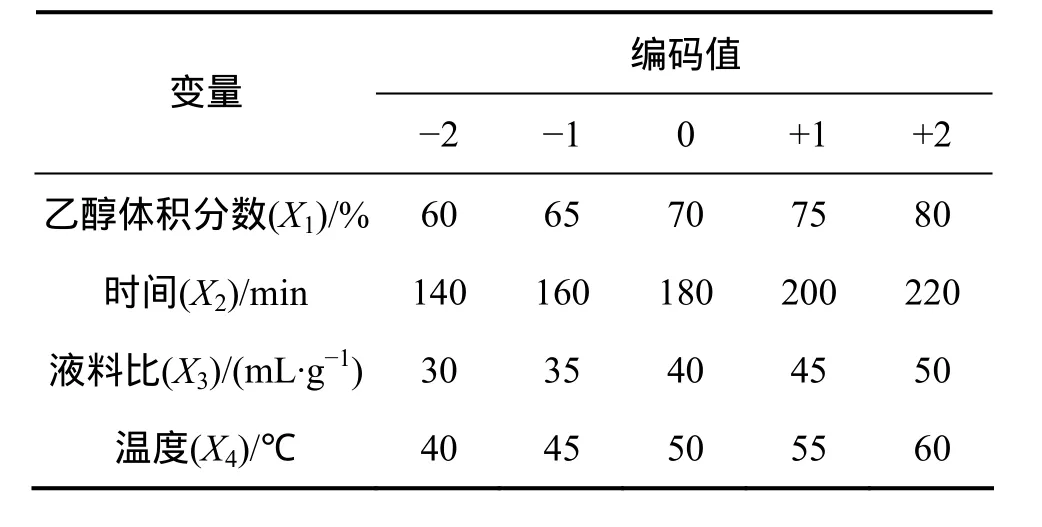
表1 中心组合设计试验因素水平表Table 1 Range of different factors investigated with CCD design
1.4 化感组分的气相色谱−质谱(GC-MS)测定
用GC-MS(Agilent 7890A/5975C)对化感组分进行结构鉴定。
气相条件:色谱柱 HP−5 (长×内径×膜厚为30 m×0.25 mm×0.25 μm),载气为He,进样口温度都为280 ℃。不分流进样,进样量为1 μL,柱流速为1 mL/min;程序升温初始炉温50 ℃保持3 min,然后,以20 ℃/min速度升温至170 ℃,保持2 min,最后以10 ℃/min升温至280 ℃,保持3 min。
质谱(MS)条件:EI离子源,电子能量为70 eV。样品各组分的质谱数据,参照 NIST02标准谱库,鉴定各组分的化学结构。
1.5 抑藻测试及数据处理
采用培养液法对各提取组分进行抑藻活性生物检测。培养基经过高压灭菌0.5 h,然后分装到250 mL锥形瓶中。每瓶中100 mL,其中包括5 mL处于对数生长期的藻种液和 0.5 mL待测液和培养液。在PYX−250Q−B型人工气候箱内进行,培养条件如下:温度为25 ℃,光照为3 000~4 000 lx,光暗比为14 h∶10 h。每隔24 h取液1次,利用血球计数法记录各个生长时期的细胞数目。计算抑制率,以抑制率表示化感物质提取率RI,公式如下:

式中:RI为抑制率;N为加入化感组分试验组的藻密度(个/mL);N0为对照组藻密度。
2 结果与讨论
2.1 响应模型的建立及显著性检验
以A=(X1−70)/5,B=(X2−180)/20,C=(X3−40)/5 和D=(X4−50)/5为自变量,以柳树叶化感物质对蛋白核小球藻(C.pyrenoidosa)的抑制率为响应值(Y)进行响应面分析实验(X1,X2和X3含义见表1)。采用CCD设计方案所得结果如表2所示。将30个实验点分为2类:第1~24为析因实验点,自变量取值为各因素所构成的三维顶点;第25~30为中心实验点即零点,为区域的中心点。零点实验重复6次,以估计实验误差。
笔者对美国学的理解是,这是一门以跨学科理论与方法为特色,重点考察美国文化价值观、重要思想或文化模式在美国历史与现实相应议题上的作用范式、影响途径的人文社会科学。美国学者做美国学是为了传承与发展、反思与批评美国文化价值观和美国文明特性,中国学者做美国学是为了深度解读美国文化,深刻评析美国文明,促进不同文明之间的对话,服务于国家对外战略需求。
利用Design-Expert 7.0软件对表2中的数据进行二次回归拟合,得到柳树化感物提取率对乙醇体积分数(A)、时间(B)、液料比(C)和超声温度(D)多元二次回归模型为

上式中,常数项76表示柳树叶化感物质的平均抑制率在实验设计范围内处于较高的水平。
利用软件对回归方程可信度分析,其中相关系数R2=90.56%,表明90.56%的实验数据可用该模型进行解释,说明方程可靠性较高。信噪比为 9.717,大于4.000,说明模型信号强,可以用于指导实验。可见:该回归方程为优化超声提取化感物质的实验条件提供了一个良好的模型。
对实验结果进行方差分析,结果见表 3。表中模型P<0.000 1,表明回归模型极显著,说明该方程与实际情况拟合很好,能够正确反映柳树叶化感物质的抑制率与乙醇体积分数(A)、提取时间(B)、液料比(C)和超声温度(D)之间的关系。B和BC对Y的影响显著(P<0.05);A,C,D,AD,BD,A2,C2和D2对Y的影响极显著(P<0.01);AB,AC,CD和B2对Y的影响不显著(P>0.05),表明实验因子对响应值不是简单的线性关系。从表3也可知:各因素对响应值的影响从大至小依次为超声温度(D)、液料比(C)、乙醇体积分数、时间(B)。失拟检验P=0.741 9>0.05,不显著,说明模型完全可以用来对试验进行拟合。
2.2 提取工艺的响应面分析与优化
图 1(a)~(f)所示可直观地反映各因素对响应值的影响。从图1中轴方向变化的密集程度可以判断两因素之间交互作用对响应值的影响程度,即响应面曲线越陡峭,说明该因素对化感物质超声提取的影响越显著。这与方差分析结果相一致。
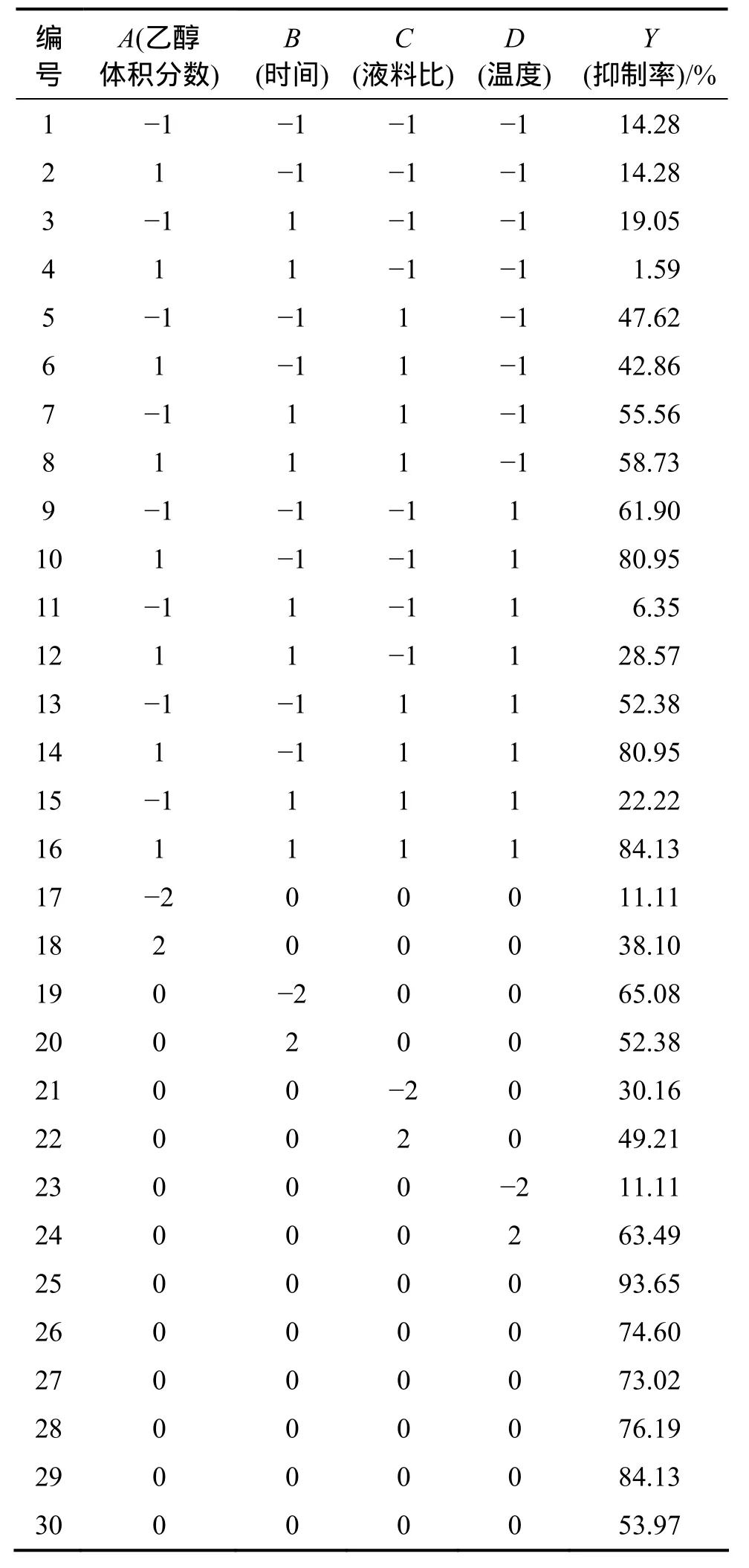
表2 超声提取试验设计与试验结果Table 2 Design and results of tests
由图 1(a)可以看出:乙醇体积分数和时间交互作用不显著;不同的乙醇体积分数具有不同的极性。根据相似相溶原理可知:不同极性的溶液势必会影响到化感物质的提取率,同时,极性不同的溶液也会影响超声破碎的过程。当乙醇体积分数较低时,易将蛋白质、糖等水溶性物质提取出来,不利于脂溶性化感物质的浸出;当乙醇体积分数太大时,产生很大的渗透压,脂溶性物质溶出增加,但会使植物细胞蛋白质很快凝固,妨碍乙醇向植物细胞内渗透,影响浸出,提取率反而降低。试验结果表明:在一定范围内,提取率随着乙醇体积分数的增大而增大,在乙醇体积分数为70%时,提取效果最好;而当乙醇体积分数大于70%时,提取率有减小趋势。
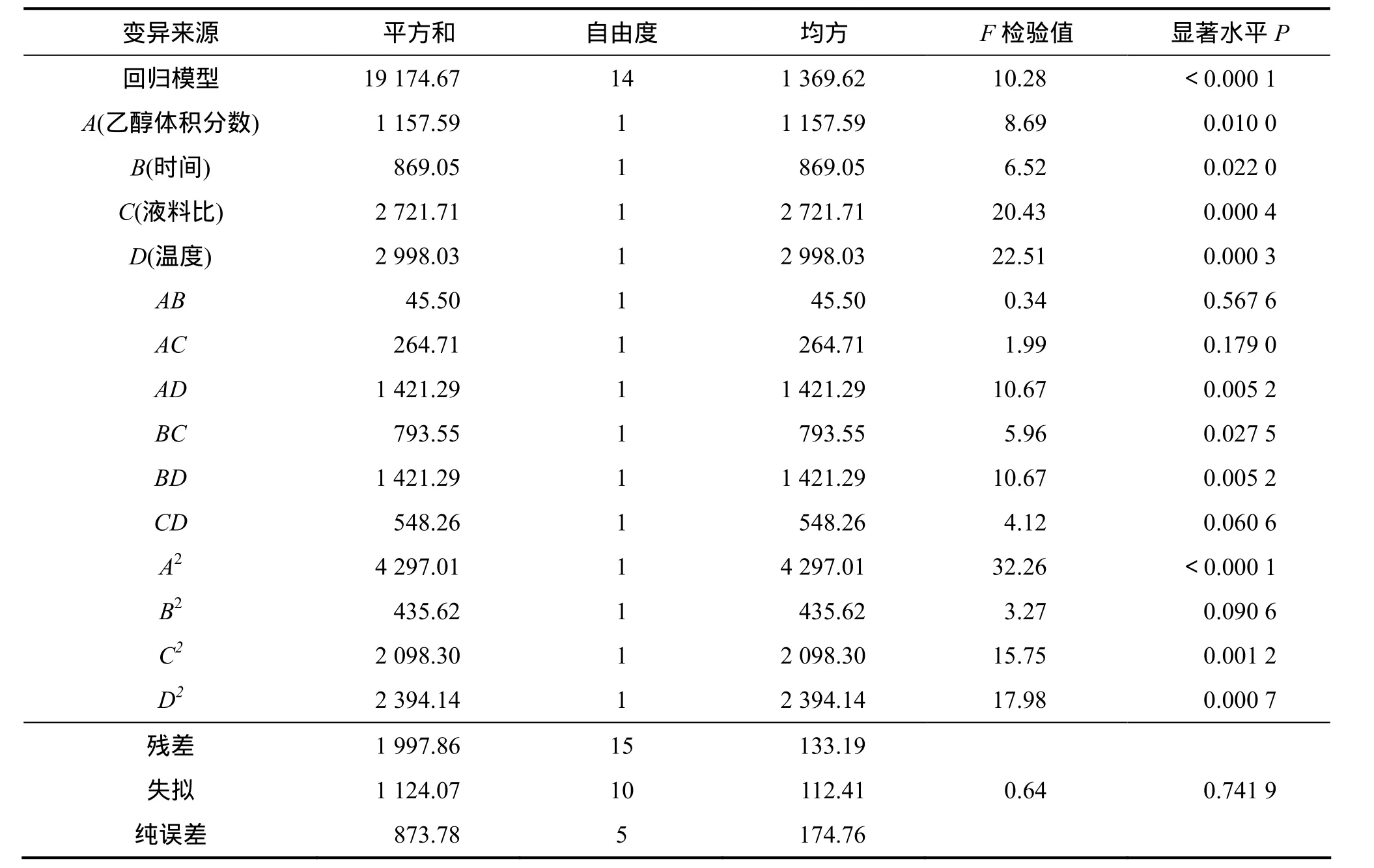
表3 回归方程的方差分析Table 3 Variance analysis of regression equation
从图1(b)可以看出:乙醇体积分数和液料比交互作用不显著;随着乙醇体积分数和液料比的增大,提取率呈现先增加后减小的趋势。液料比是提取过程中的一个重要因素,根据传质速率原理,主要表现在影响固相主体和液相主体的体积分数差,即传质推动力。料液比越小,两相间的体积分数差越小,从而传质推动力就越小。另外,料液比也会影响两相的混合情况。提高液料比尽管会在较大程度上提高传质推动力,但大量的溶剂影响提取体系的传热和传质,反而不利于化感物质的提取,同时,提高了生产成本和溶剂回收成本的难度。因此,液料比不宜太高。
从图 1(c)可以看出:乙醇体积分数和超声温度交互作用显著;随着乙醇体积分数和超声温度的增大,提取率先增加后减小;当温度较低时,物质分子平均运动速率小,扩散速率小;当温度升高时,物质分子平均运动速率越大,扩散速率越大,加速了溶剂与溶质的混合。另外,温度升高对植物组织的浸润和对有效成分的溶解也有促进作用,能够使蛋白质凝固,破坏酶类有利于物质的浸出。当温度过高时,一方面易加速活性成分的分解,使其受到破坏,降低抑藻活性,且杂质的溶出量增加,给后续操作带来不便;另一方面使乙醇易挥发,造成溶剂损失,且降低乙醇体积分数,影响提取率。
从图1(d)可以看出:时间和液料比交互作用显著;提取率随着液料比的增大而增大,但液料比过高会降低提取率。而提取率随着时间的延长而逐渐降低。可见:液料比干扰时间对提取率有较大影响。
从图 1(f)可以看出:超声温度和液料比交互作用不显著;化感物质提取率随超声温度和液料比的增大快速增加,但若超声温度和液料比过高,会降低提取率。
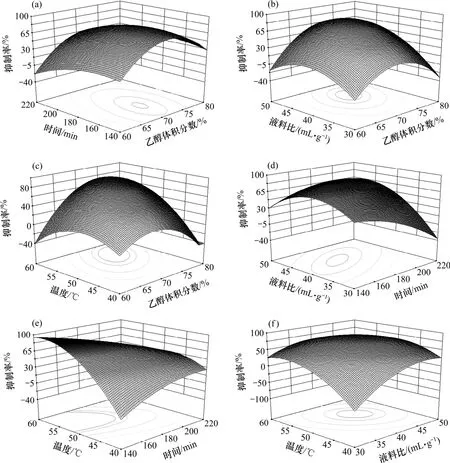
图1 不同因素对抑制率影响的响应面图Fig.1 Response surface(3D) that effects of different extraction parameters on inhibition rate
2.3 最佳工艺条件的确定与验证试验
从图1(a)~(f)所示的响应面最高点可以看出:化感物质对蛋白核小球藻的抑制率在一定范围内与乙醇体积分数、超声温度、时间、和液料比成正相关,但是,当乙醇体积分数为70%~72.5%、时间为60~180 min、液料比为42.50∶1 mL/g以及温度为55 ℃左右时提取效果最好。由此可知在实验所选的范围内存在极值,即响应点的最高值。由上述拟合的二次回归方程求偏导得出最佳的提取条件参数如下:乙醇体积分数为72.92%,液料比为40.03∶1 mL/g,时间和温度分别为160 min和55 ℃,在此最佳条件下,化感物质提取率最高,其对蛋白核小球藻的抑制率理论值可达到93.52%。
为检验 RSM 法的可靠性,采用上述最优提取条件进行柳树叶化感物质的提取实验。为对比超声提取和常规浸提法的优劣,采用同一种原料在上述相同实验条件下恒温振荡48 h得到提取液用于抑藻测试,结果见表4。由表4可知:以拟合条件重复实验3次,化感物质抑制率平均值为91.34%,与预测值93.52 %较接近,重复性很好,说明优化结果可靠;与传统提取法相比,在抑制率相同情况下超声法提取时间缩短了17倍,化感物质的提取效果也有了一定程度提高。
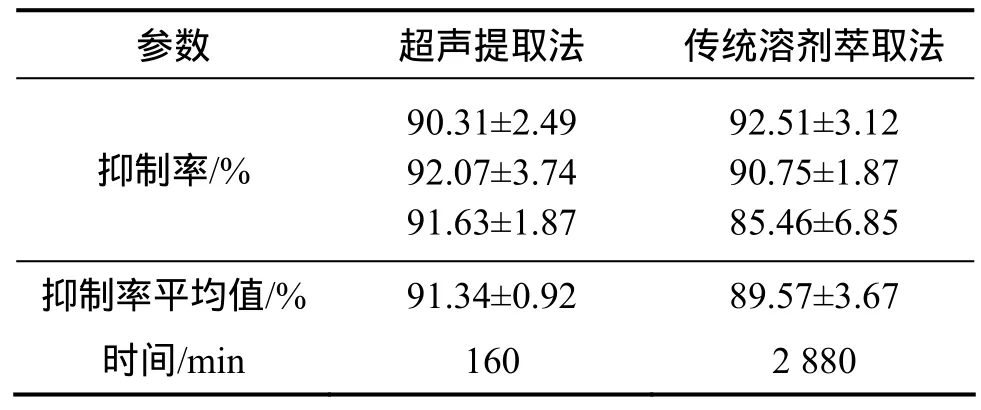
表4 超声提取法与常规溶剂提取法的实验结果Table 4 Results of ultrasonic and conventional solvent extraction technology
2.4 化感物质结构分析
将分离纯化后的化感物质用甲醇溶解后经 0.22 μm有机滤膜过滤后,通过上柱检测分析,结果见表5。从表5可见:主要化感物质按照质量分数由高到低依次为对羟基肉桂酸乙酯(Ethyl 4-hydroxy cinnamate)、4-羟基-3-甲氧基肉桂酸乙酯(Ethyl 4-hydroxy-3-methoxycinnamate)、棕榈酸(Palmitic acid)、茉莉酸甲酯(Methyl 3-oxo-2-(2-pentenyl)cyclopentaneacetate)、对羟基肉桂酸甲酯(Methyl 4-hydroxycinnamate)、对羟基苯甲酸甲酯(Methyl 4-hydroxybenzoate),其质量分数分别为12.76%,4.97%,3.35%,2.64%,1.88%和1.07%。化感物质是供体植物释放的作用于受体植物的次生代谢物质。Rice[19]将化感物质分为14类,目前普遍的化感物质分类主要是4类[20−21]:(1) 酚类;(2) 萜类;(3)糖和糖苷类;(4) 生物碱和非蛋白氨基酸,其中最为常见的是长链脂肪酸、酚酸以及萜类化感物质。本研究发现柳树叶化感物质主要属于酚酸类衍生物和少量脂肪酸族物质(统称为酚酸类组分,下同)。
近年来,利用植物的化感物质来抑制藻类生长的研究较为活跃[22],其中酚酸类物质是活性较强的一类化感物质[23]。Greca等[24]报道马蹄莲中的抑藻物质为酚类和多酚类物质。Nakai等[25]从穗花狐尾藻中分离出单宁酸、鞣花酸、五倍子酸、焦棓酸和儿茶酸等多种酚酸类化感物质,并证明对铜绿微囊藻的生长有较强的抑制作用;Wu等[26]用聚乙烯吡咯烷酮 PVPP将伊乐藻、黑藻和苦草的分泌物中的酚类化合物去除后,发现3种沉水植物对无毒铜绿微囊藻株的抑制率分别下降35.7%,43.4%和59.1%,表明这3种沉水植物释放的酚类化合物是进入周围水中抑制藻类生长的主要化感物质。本研究将柳树叶经过多次分离提取和柱层析得到的化感物质经鉴定主要为酚酸类物质,如对羟基肉桂酸乙酯、4-羟基-3-甲氧基肉桂酸乙酯等,且这些物质能有效地抑制蛋白核小球藻的生长。
2.5 酚酸类组分对蛋白核小球藻生长的影响
图2所示为不同体积分数柳树叶酚酸类组分对蛋白核小球藻抑制率变化情况。从图2可见:不同体积分数的酚酸类组分对蛋白核小球藻抑制率有所不同。各组分在2 d后抑制率都在75%以上(P<0.05),表现出快速高效的抑制效果,这与Hong等[16]的研究结果较相似,这对于控制水体藻华具有良好的现实意义。3 d后0.1~0.3 g/L组分抑制率随时间的延长都有不同程度下降,0.1 g/L处理组抑制率在7 d仅为21.2%,但0.4 g/L处理组抑制率维持在89.1~98.2%,表现出较强的抑制作用。在培养结束时(7 d),抑制率随着体积分数的增大而升高,表明此化感物质的抑制效果对其体积分数具有一定的依赖性,化感物质体积分数越大,其抑制效果越好。

表5 柳树叶化感物质GC-MS分析结果Table 5 Analytical results of allelochemical from the Leaves of S.babylonica by GC-MS
酚酸类物质是一类具有酚羟基结构的化合物,其对微藻化感作用的主要机制可能是酚酸类物质的自氧化[23,27]。实验中培养基含有一定量的Cu2+和Fe3+等过渡金属离子,能与酚酸类物质上羟基发生自氧化,产生 H2O2[28]。H2O2可进一步造成细胞脂质过氧化[29],进而使得膜结构和功能受损,细胞代谢失调甚至死亡。张庭廷等[30]研究酚酸类物质对水华藻类的化感作用时发现:阿魏酸和对羟基苯甲酸能使水华鱼腥藻及蛋白核小球藻的细胞叶绿素a含量下降,细胞内超氧阴离子自由基增高,膜脂质过氧化产物丙二醛(MDA)积累,细胞超氧化物歧化酶(SOD)的活力开始时应急性升高。花铭等[31]发现邻苯三酚和咖啡酸会引起铜绿微囊藻膜脂过氧化,干扰酯类代谢并抑制酯酶活性,同时降低膜的完整性,使细胞固缩,邻苯三酚还能显著抑制铜绿微囊藻的SOD酶活性,破坏细胞抗氧化防御系统。本研究中的肉桂酸衍生物、苯甲酸衍生物等一些酚酸类物质苯环上的羟基可能与培养基中的Cu2+和Fe3+等过渡金属离子结合,诱导发生自氧化,产生H2O2,被藻细胞吸收后破坏细胞酶活系统,影响细胞正常生理活性,从而抑制微藻生长。

图2 酚酸类质量浓度对蛋白核小球藻抑制率的影响Fig.2 Effects of mass concentration of allelopathic fraction on inhibition rate of C.pyrenoidosa
3 结论
(1) 超声提取柳树化感物质的数学回归模型为:

其中各变量的编码为:A=(X1−70)/5;B=(X2−180)/20;C=(X3−40)/5;D=(X4−50)/5;对柳树化感物提取的影响程度从大至小依次为超声温度(D)、液料比(C)、乙醇体积分数(A)、时间(B)。
(2) 超声提取柳树化感物质的最佳实验条件如下:乙醇体积分数为72.92%,液料比为40.03∶1 mL/g,温度为55 ℃,时间为160 min,预测抑制率为93.52%,实际抑制率为 91.34%。实验值和预测值没有显著差异,即该数学模型可以较好地预测乙醇体积分数、时间、液料比和超声温度这4个因素与蛋白核小球藻抑制率的关系,重复性较好。
(3) 对柳树叶化感物质分离鉴定得到其主要抑藻活性物质为对羟基肉桂酸乙酯等酚酸类物质,且质量浓度为0.1~0.4 g/L的酚酸类组分对蛋白核小球藻抑制率为21.2%~89.1%;抑制作用随着投加化感物质体积分数的增大而增强,,抑制作用对化感物质体积分数具有一定的依赖性。
[1] Alamsjah M A, Hirao S, Ishibashi F, et al.Isolation and structure determination of algicidal compounds fromUlva fasciata[J].Bioscience Biotechnology and Biochemistry, 2005, 69(11)∶2186−2192.
[2] Ball A S, Williams M, Vincent D, et al.Algal growth control by a barley straw extract[J].Bioresource Technology, 2001, 77(2)∶177−181.
[3] Vyvyan J R.Allelochemicals as leads for new herbicides and agrochemicals[J].Tetrahedron, 2002, 58(9)∶ 1631−1646.
[4] Rice E L.Allelopathy[M].2nd ed.Orlando∶ Academic Press,1984∶ 1−2.
[5] Nakai S, Zou G, Okuda T, et al.Anti-cyanobacterial allelopathic effects of plants used for artificial floating islands[J].Allelopathy Journal, 2010, 26(1)∶ 113−121.
[6] Newman J R, Barrett P R F.Control of microcystis aeruginosa by decomposing barley straw[J].Journal of Aquatic Plant Management, 1993, 31∶ 203−206.
[7] Everall N C, Lees D R.The identification and significance of chemicals released from decomposing barley straw during reservoir algal control[J].Water Research, 1997, 31(3)∶614−620.
[8] Nakai S, Inoue Y, Hosomi M.Algal growth inhibition effects and inducement modes by plant-producing phenols[J].Water Research, 2001, 35(7)∶ 1855−1859.
[9] Shanab S M M, Shalaby E A, Lightfoot D A, et al.Allelopathic effects of water hyacinth [Eichhornia crassipes][J].Plos One,2010, 5(10)∶ 1−8.
[10] 洪喻, 胡洪营, 黄晶晶, 等.不同溶剂提取芦竹化感物质对铜绿微囊藻生长的影响[J].环境科学, 2008, 29(11)∶ 3143−3147.HONG Yu, HU Hongying, HUANG Jingjing, et al.Growth of microcystis aeruginosa affected by allelochemicals of arundo donax Linn extracted with different solvents[J].Environmental Science, 2008, 29(11)∶ 3143−3147.
[11] Nakai S, Hosomi M.Allelopathic inhibitory effects of polyphenols released byMyriophyllum spicatumon algal growth[J].Allelopathy Journal, 2002, 10(2)∶ 123−131.
[12] Gross E M.Allelopathy of aquatic autotrophs[J].Critical Reviews in Plant Sciences, 2003, 22(3/4)∶ 313−339.
[13] Mulderij G, van Donk E, Roelofs J G M.Differential sensitivity of green algae to allelopathic substances from Chara[J].Hydrobiologia, 2003, 491(1)∶ 261−271.
[14] Li F M, Hu H Y.Isolation and characterization of a novel antialgal allelochemical fromPhragmites communis[J].Applied and Environmental Microbiology, 2005, 71(11)∶ 6545−6553.
[15] He C Q, Wang C K.Allelopathic effect ofAcorus tatarinowiiupon algae[J].Journal of Environmental Science, 2001, 13(4)∶481−484.
[16] Hong Y, Hu H Y, Sakoda A, et al.Isolation and characterization of antialgal allelochemicals fromArundo donax L[J].Allelopathy Journal, 2010, 25(2)∶ 357−367.
[17] Sun W H, Yu S W, Yang S Y, et al.Allelochemicals from root exudates of water hyacinth (Eichhornis crassipes)[J].Acta Phytophysiol Sinica, 1993, 19(1)∶ 92−96.
[18] Bold H C.The morphology of chlamydomonas chlamydogama,Sp.Nov[J].Bulletin of the Torrey Botanical Club, 1949, 76(2)∶101−108.
[19] Rice E L.Allelopathy[M].New York∶ Academic Press, 1974∶166−179.
[20] 孔垂华, 胡飞.植物化感(相生相克)作用及其应用[M].北京∶中国农业出版社, 2001∶ 12−42.KONG Chuihua, HU Fei.Plant allelopathy and its application[M].Beijing∶ China Agriculture Press, 2001∶ 12−42.
[21] 林娟, 殷全玉, 杨丙钊, 等.植物化感作用研究进展[J].中国农学通报, 2007, 23(1)∶ 68−72.LIN Juan, YIN Quanyu, YANG Bingzhao, et al.Review on allelopathy of plants[J].Chinese Agricultural Science Bulletin,2007, 23(1)∶ 68−72.
[22] Gross E M, Erhard D, Ivanyi E.Allelopathic activity ofCeratophyllum demersum L.andNajas marina sspintermedia(Wolfgang) Casper[J].Hydrobiologia, 2003, 506(1/2/3)∶583−589.
[23] Inderjit K.Plant phenolics in allelopathy[J].The Botanical Review, 1996, 62(2)∶ 186−202.
[24] Greca M D, Ferrara M, Fiorentino A, et al. Previtera L.Antialgal compounds fromZantedeschiaaethiopica[J].Phytochemistry, 1998, 49(5)∶ 1299−1304.
[25] Nakai S, Inoue Y, Hosomi M, et al.Myriophyllum spicatum-released allelopathic polyphenols inhibiting growth of blue-green algaeMicrocystis aeruginosa[J].Water Research,2000, 34(11)∶ 3026−3032.
[26] Wu Z B, Gao Y N, Wang J, et al.Allelopathic effects of phenolic compounds present in submerged macrophytes onMicrocystis aeruginosa[J].Allelopathy Journal, 2009, 23(2)∶403−410.
[27] Dziga D, Suda M, Bialczyk J, et al.The alteration ofMicrocystis aeruginosabiomass and dissolved microcystin-LR concentration following exposure to plant-producing phenols[J].Environmental Toxicology, 2007, 22(4)∶ 341−346.
[28] Tayama S, Nakagawa Y.Cytogenetic effects of propyl gallate in CHO-K1 cells[J].Mutation Research-Genetic Toxicology and Environmental Mutagenesis, 2001, 498(1/2)∶ 117−127.
[29] Furukawa A, Oikawa S, Murata M, et al.(-)-epigallocatechin gallate causes oxidative damage to isolated and cellular DNA[J].Biochemical Pharmacology, 2003, 66(9)∶ 1769−1778.
[30] 张庭廷, 吴安平, 何梅, 等.酚酸类物质对水华藻类的化感作用及其机理[J].中国环境科学, 2007, 27(4)∶ 472−476.ZHANG Tingting, WU Anping, HE Mei, et al.The allelopathy and its mechanism of phenolic acids on water-bloom algae[J].China Environmental Science, 2007, 27(4)∶ 472−476.
[31] 花铭, 陈良燕, 尹大强.邻苯三酚和咖啡酸对铜绿微囊藻的化感作用及其机理[J].环境化学, 2008, 27(3)∶ 331−334.HUA Ming, CHEN Liangyan, YIN Daqiang.The compare on the mechanism of pyrogallic acid and caffeic acid allelochemicals to algae (Microcystisaeruginosa)[J].Environmental Chemistry, 2008, 27(3)∶ 331−334.
