基于SSR标记的8个山荆子居群遗传多样性和遗传关系分析
2012-12-31王雷宏郑玉红汤庚国
王雷宏,郑玉红,汤庚国
〔1.安徽农业大学林学与园林学院,安徽 合肥 230036;2.江苏省·中国科学院植物研究所(南京中山植物园),江苏 南京 210014;3.南京林业大学森林资源与环境学院,江苏 南京 210037〕
山荆子〔Malus baccata(L.)Borkh.〕是苹果属(Malus Mill.)脱萼组(Sect.Gymnomeles Koehne)种类中分布范围最广的一个种,集中分布于中国,为东亚分布型,是典型的多型性发达种[1]。山荆子生长速度快、易繁殖,与苹果(M.pumila Mill.)嫁接后亲和力强、耐寒性强,是东北、华北和西北山区苹果嫁接的主要砧木材料;山荆子花、果美丽,果实、种子、嫩叶和木材等均具有很高的经济价值,是苹果属的珍贵野生植物资源[2]。有关该种形态变异、遗传多样性等方面的研究结果表明:山荆子居群间的遗传分化和亲缘关系较为复杂[3-6]。Nei[7]认为:物种表型进化是由相互作用的基因突变引起的,不同分类等级物种的表型多样性是新突变和遗传基因的累积产物,新突变基因通过自然选择和基因漂变被纳入基因组中并产生遗传保守性,从而影响表型进化的方向;Rouzine等[8]通过对植物的病毒学实验,认为:低多样性居群受中性变异控制,高多样性居群受自然选择控制,不同物种的遗传变异差异明显。因此,探明山荆子的居群遗传结构和遗传分化规律及地理居群的多样性是阐明其系统进化和演化的主要途径,对山荆子的物种起源和遗传进化研究具有重要意义。
作者采用SSR标记技术对山荆子主要分布区的8个居群140个单株的遗传多样性、居群遗传结构以及居群间的亲缘关系进行了分析,以期为该种的起源和地理演化规律研究提供一定的实验依据。
1 材料和方法
1.1 材料
选取分布于黑龙江、吉林、河北、山西和北京等地的8个山荆子居群进行取样,各居群的概况见表1。每个居群随机选取20株以上生长状况良好的植株作为样株,总株数不足20株的居群则全部选为样株,8个居群共计140个样株。在样株上采集健康的幼嫩叶片,用变色硅胶迅速干燥并带回实验室,常温条件下保存、备用。

表1 供试的8个山荆子居群概况Table1 Status of eight populations of Malus baccata(L.)Borkh.tested
1.2 方法
参照Doyle等[9]的CTAB法提取叶片基因组总DNA。将获得的DNA溶解于灭菌双蒸水中,-20℃贮存、备用。根据文献[10-12]确定30对引物进行扩增反应预实验,通过预实验筛选出扩增条带丰富、信号强的10对引物用于SSR扩增反应。引物均由上海英骏生物工程技术有限公司合成。
采用PE-9700 PCR仪(美国GeneAmp公司)进行SSR-PCR扩增反应,PCR反应相关试剂均购自宝生物工程(大连)有限公司。反应体系总体积10μL,包含0.4μmol·L-1的d ATP、d GTP、d CTP和d TTP,1× Taq DNA聚合酶缓冲液(含有10 mmol·L-1Tris-HCl、50 mmol·L-1KCl和体积分数0.1%Trion X-100,pH8.4),2.5 mmol·L-1MgCl2,0.5 U Taq DNA聚合酶,20 ng模板DNA,0.4μmol·L-1上下游引物,双蒸水补足至10μL。扩增程序为:94℃预变性4 min;94℃变性30 s,55℃~60℃退火1 min,72℃延伸1 min,共35个循环反应;最后于72℃延伸5 min。扩增产物置于4℃冰箱中保存。
用质量体积分数10%的聚丙烯酰胺凝胶对扩增产物进行电泳检测,采用50 bp Marker〔购自宝生物工程(大连)有限公司〕进行分子量标记,电压240 V,电泳时间1 h。电泳结束后用银染法染色,染色方法为:凝胶先用体积分数10%乙醇和体积分数0.5%冰乙酸混合溶液固定12 min,然后用质量体积分数0.2% AgNO3水溶液处理12 min;水洗后用含质量体积分数1.5%NaOH、体积分数0.4%甲醛和质量体积分数0.02%Na2S2O3的混合液显色5~10 min,至谱带清晰为止。染色结束后,将凝胶用自来水冲洗干净,用FR-200A凝胶成像系统(上海复日科技有限公司)观察电泳结果并拍照。
1.3 数据分析
人工判读条带,并应用POPGENE v1.31软件[13]计算等位基因数、有效等位基因数、Nei’s基因多样性指数、Shannon信息指数和多态性条带百分率;基于等位基因频率,在假设遗传平衡的条件下,计算居群间的基因分化系数(G st)和基因流(N m),并用UPGMA法进行聚类分析。
2 结果和分析
2.1 SSR扩增结果分析
采用10对SSR引物对8个山荆子地理居群140个单株的基因组总DNA进行SSR扩增,引物的序列及扩增结果见表2。10对引物共扩增出91条带,平均每对引物扩增出9.1条带,多态性条带百分率达100.00%。其中,引物CH02b12扩增出的条带最多,达13条;引物U78949扩增出的条带最少,仅4条。
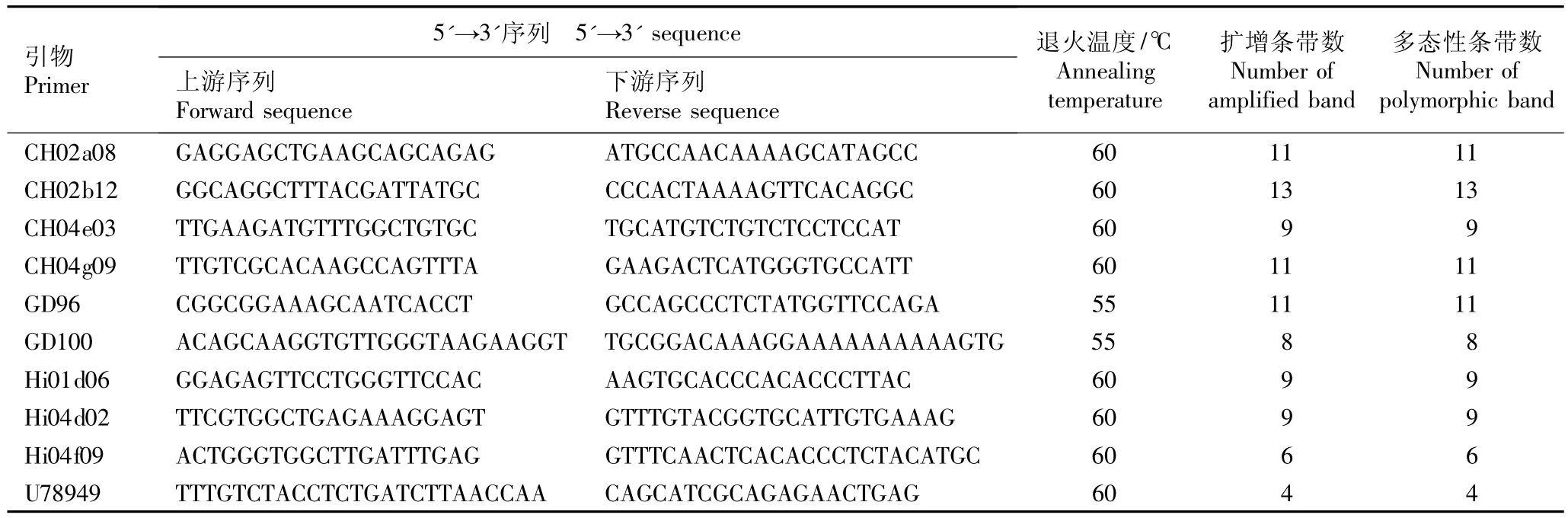
表2 8个山荆子居群的SSR-PCR扩增结果Table2 Amplified results of SSR-PCR of eight populations of Malus baccata(L.)Borkh.
2.2 居群的遗传多样性分析
根据SSR标记分析结果得出的8个山荆子居群的遗传参数见表3。由表3可知:吉林长白山山荆子居群的有效等位基因数最大,为1.5350;山西中条山山荆子居群的Nei’s基因多样性指数和Shannon信息指数最高,分别为0.3092和0.4592;河北塞罕坝居群的有效等位基因数和Nei’s基因多样性指数最低,分别为1.4379和0.2560;山西管涔山居群的Shannon信息指数最低,为0.3767。吉林长白山居群和山西中条山居群的多态性条带最多,均为78条;山西五台山居群的多态性条带最少,仅59条。从居群的多态性条带百分率来看,山西五台山居群最低,为64.84%;吉林长白山居群和山西中条山居群最高,均为85.71%。
由表3还可以看出:供试的8个山荆子居群间的有效等位基因数为1.6169,Nei’s基因多样性指数为0.3551,Shannon信息指数为0.5285,多态性条带百分率达100.00%,居群间的各项遗传多样性指数均高于居群内。
2.3 居群的聚类分析结果
基于Nei’s遗传距离获得的8个山荆子居群的UPGMA聚类结果见图1。在Nei’s遗传距离0.1486处,8个居群被分成3个大组:第1组包括山西五台山居群和北京东灵山居群;第2组包括山西中条山居群、吉林长白山居群、黑龙江小兴安岭居群、山西灵空山居群和山西管涔山居群;第3组仅含河北塞罕坝1个居群。由图1可见:发生明显地理分化的是山西五台山居群、北京东灵山居群、山西管涔山居群和河北塞罕坝居群;山西灵空山居群、黑龙江小兴安岭居群、吉林长白山居群和山西中条山居群可能是山荆子的多样性核心居群。山西五台山居群和北京东灵山居群的地理位置较近,遗传关系也最近,而其他居群间的遗传关系与地理位置没有明显的相关性。

表3 基于SSR标记分析的8个山荆子居群的遗传多样性分析结果Table3 Analysis results of genetic diversity of eight populations of Malus baccata(L.)Borkh.based on SSR marker analysis

图1 基于SSR标记分析结果的8个山荆子居群的UPGMA聚类图Fig.1 UPGMA cluster dendrogram of eight populations of Malus baccata(L.)Borkh.based on SSR marker analysis result
2.4 居群间的基因分化分析
对8个山荆子居群进行基因分化分析,居群间的基因分化系数(G st)为0.2233,说明在总的遗传变异中有22.33%存在于居群间;基因流(N m)为1.7395,说明居群间的基因交换较多。
3 结论和讨论
采用10对SSR引物对8个山荆子居群的基因组总DNA进行PCR扩增,根据其基因位点多态性可知:山西中条山居群的遗传多样性最高,其Nei’s基因多样性指数(H)为0.3092,Shannon信息指数(I)为0.4592;山西灵空山居群的遗传多样性也较高,H为0.3056,I为0.4532。陈曦等[5]根据山荆子居群的RAPD分析结果,认为山西灵空山居群的遗传多样性最高(H=0.3045,I=0.4526)。虽然2种方法的结果不一致,但从绝对数值来看,二者差异不大。本研究结果表明:与苹果属植物的遗传多样性[14]相比,山荆子居群间的遗传多样性(H=0.3551,I=0.5285)明显低于苹果属野生种(H=0.86,I=2.07)及苹果砧木(H=0.76,I=1.63),其原因与居群划分方法的不同有关;但本研究结果与苹果属其他种类,如新疆野苹果〔Malus sieversii(Ledeb.)Roem.〕[8]、湖北海棠〔M.hupehensis(Pamp.)Rehd.〕[15]、变叶海棠〔M.toringoides(Rehd.)Hughes〕[16]和小金海棠(M.xiaojinensis Cheng et Jiang)[17]等种类的遗传多样性水平相近。
聚类分析结果表明:在Nei’s遗传距离0.1486处,供试的8个山荆子居群被分成3组,居群间的Nei’s遗传距离最大值为0.2274,与RAPD标记的聚类分析结果相似(RAPD标记的Nei’s遗传距离最大值为0.2249)[5]。但是,同一地域内小居群间基于SSR和RAPD标记的遗传关系分析结果并不完全一致,其中山西中条山和管涔山居群以及黑龙江小兴安岭居群的差异较大,推测这些山荆子居群在遗传上可能具有特定的杂合性和分化方向,也可能与这些居群处于从随机进化向定向进化的过渡状态有关。
基于SSR标记的8个山荆子居群的遗传组成和基因流大小与其RAPD标记[5]和ISSR分析[18]的结论基本一致,按照Wright[19]的理论,表明山荆子群体相对稳定,不存在遗传漂变,但分化程度较高。聚类结果显示:地理位置相近的居群并没有聚在一起,如山西五台山居群、北京东灵山居群和山西管涔山居群地理位置相近,但仅前二者紧密相聚,山西管涔山居群则与中部的核心居群聚在一起。推测山荆子的迁移扩散可能是从核心居群向外扩展,由于同区域内小居群间基因流不对称或不均等,加之特定地理居群可能受到强有力的外界选择压力,产生了遗传分化。结合“多样性中心就是起源中心”的理论推测:山荆子起源于我国的华北和东北地区,向四周扩散后在基因流不对称和生境的强有力选择压力下形成了现有的多样性分布格局。
[1]梁国鲁,李晓林.中国苹果属植物染色体研究[J].植物分类学报,1993,31(3):236-251.
[2]余德浚,阎振茏,张 鹏.中国果树砧木资源[M]∥中国农业科学院郑州果树所.果树砧木论文集.西安:陕西科学技术出版社,1985:3-10.
[3]王雷宏,汤庚国.山荆子腊叶标本表型性状变异分析[J].西北植物学报,2007,27(8):1690-1694.
[4]王雷宏,汤庚国,夏海武,等.山荆子叶脉序的研究[J].南京林业大学学报:自然科学版,2008,32(2):39-42.
[5]陈 曦,汤庚国,郑玉红,等.苹果属山荆子遗传多样性的RAPD分析[J].西北植物学报,2008,28(10):1954-1959.
[6]ROBINSON JP,HARRIS S A,JUNIPER BE.Taxonomy of the genus Malus Mill.(Rosaceae)with emphasis on the cultivated apple,Malusdomestica Borkh.[J].Plant Systematic and Evolution,2001,226(1/2):35-58.
[7]NEIM.The new mutation theory of phenotypic evolution[J].Proceedings of the National Academy of Sciences of the United States of America,2007,104:12235-12242.
[8]ROUZINE IM,RODRIGO A,COFFIN JM.Transition between stochastic evolution and deterministic evolution in the presence of selection:general theory and application to virology[J].Microbiology and Molecular Biology Reviews,2001,65(1):151-185.
[9]DOYLE JJ,DICKSON E E.Preservation of plant samples for DNA restriction endonuclease analysis[J].Taxon,1987,36(4):715-722.
[10]LIEBHARD R,GIANFRANCESCHIL,KOLLER B,et al.Development and characterisation of 140 new microsatellites in apple(Malus×domestica Borkh.)[J].Molecular Breeding,2002,10(4):217-241.
[11]GOULÃO L,OLIVEIRA C M.Molecular characterisation of cultivars of apple(Malus×domestica Borkh.)usingmicrosatellite(SSR and ISSR)markers[J].Euphytica,2001,122(1):81-89.
[12]BENSON L L,LAMBOY WF,ZIMMERMAN R H.Molecular identification of Malus hupehensis(tea crabapple)accessions using simple sequence repeats[J].HortScience,2001,36(5):961-966.
[13]YEH F C,YANG R C,BOYLE T.POPGENE version1.31: Micros of t Window-based Freeware for Population Genetic Analysis[CP/CD].Edmonton:University of Alberta,1999.
[14]GHARGHANIA,ZAMANIZ,TALAIE A,et al.Genetic identity and relationships of Iranian apple(Malus×domestica Borkh.) cultivars and landraces,wild Malus species and representative old apple cultivars based on simple sequence repeat(SSR)marker analysis[J].Genetic Resources and Crop Evolution,2009,56(6):829-842.
[15]康 明,黄宏文.湖北海棠的等位酶变异和遗传多样性研究[J].生物多样性,2002,10(4):376-385.
[16]张元元,周志钦.苹果属植物变叶海棠遗传多样性形成机理研究进展[J].果树学报,2008,25(6):896-900.
[17]周志钦,成明昊,宋洪元,等.苹果属小金海棠的遗传多样性初步研究[J].生物多样性,2001,9(2):145-150.
[18]王雷宏,郑玉红,汤庚国.8个山荆子居群遗传多样性的ISSR分析[J].西北植物学报,2010,30(7):1337-1343.
[19]WRIGHT S.Evolution and the Genetics of Populations(Vol.4): Variability Within and Among Natural Populations[M].Chicago: University of Chicago Press,1978:4.
