NaCl胁迫对5个引自北美的树种叶肉细胞超微结构的影响
2012-12-31郝明灼梁有旺谭鹏鹏彭方仁
郝明灼,马 健,梁有旺,谭鹏鹏,彭方仁
叶片是植物的主要同化器官,生理功能较为活跃,对植物的光合、呼吸、水分代谢以及养分运输等生理活动有直接影响。叶绿体和线粒体是叶肉细胞中对环境条件变化最敏感的细胞器,其形态结构、大小、数量和分布常常因环境条件变化而改变,在一定程度上可作为表征植物对逆境条件耐受性的依据[1-3]。
结合沿海防护林营造和城市园林建设的需要,近年来,国内先后从北美引进了一些适应性和观赏性相对较强的树种,如美国白蜡(Fraxinus americana L.)、茶条槭(Acer ginnala Maxim.)、红桤木(Alnus rubra Bong.)、水紫树(Nyssa aquatica L.)和美国皂荚(Gleditsia triacanthos L.)等,并对这些引进树种开展了耐涝、耐盐和育苗技术等方面的研究[4-13],但对不同浓度NaCl胁迫条件下这些树种叶肉细胞超微结构的变化目前尚未见研究报道。
作者以上述5个树种为研究对象,在人工气候室内用水培方法进行NaCl胁迫处理,采用透射电镜技术对5个树种叶肉细胞超微结构的变化进行了观察比较,并在此基础上分析了NaCl胁迫对5个树种叶肉细胞超微结构的影响及其耐盐能力,旨在为沿海地区的人工林营造及树种选择提供实验依据。
1 材料和方法
1.1 材料
供试的美国皂荚、红桤木、美国白蜡、茶条槭和水紫树种子均引自北美,于2006年12月由中国种子进出口公司引进;于2007年3月播种,并种植于南京林业大学树木园苗圃。实验材料为1年生实生苗。
1.2 方法
1.2.1 NaCl胁迫处理方法 于2008年6月中旬在南京林业大学森林培育系人工气候室中进行NaCl胁迫处理。选取生长状况良好且长势基本一致的各树种幼苗,将根洗净后移入盛有Hoagland营养液的水培箱(长44.5 cm、宽31.7 cm、高15.2 cm)中进行适应性培养,10 d后进行NaCl胁迫处理。共设置2个处理组和1个对照组,直接向Hoagland营养液中添加一定质量的NaCl固体粉末并充分搅拌使溶液中NaCl的最终质量浓度分别为4和8 g·L-1,对照为未添加NaCl固体粉末的 Hoagland营养液(0 g·L-1NaCl)。胁迫过程中,人工气候室温度为(25±1)℃、空气相对湿度为(70±5)%、光照度1 500 lx、光照时间为12 h·d-1,每天早晚向处理液中补充氧气各30 min。每个树种每处理各5株幼苗,均重复3次。在NaCl胁迫处理的第3天,采集各树种幼苗同一部位的3~5片功能叶用于制片。
1.2.2 透射电镜样品的制备与观察 将叶片切成面积约1 mm2小块,迅速用含质量体积分数4%多聚甲醛和体积分数0.5%戊二醛的混合液(体积比9∶1,pH 7.2)固定,采用汪贵斌等[14]的方法依次进行洗涤、脱水、渗透、包埋、聚合、切片和染色,用H-600型透射电镜(日本日立公司生产)进行观察并拍照。
2 结果和分析
2.1 正常条件(0 g·L-1 NaCl)下5个树种叶肉细胞的超微结构
在正常条件(0 g·L-1NaCl,对照)下,5个树种叶肉细胞的超微结构见图1。在正常条件下,虽然各树种叶肉细胞的超微结构有一定差异,但它们的叶肉细胞均未发生质壁分离现象。美国白蜡叶肉细胞的叶绿体紧贴细胞壁排列,呈椭圆状,且外膜完整;类囊体片层排列方向与长轴平行,含有少量且较大的嗜锇颗粒;细胞核核膜清晰,染色质分布均匀(图1-1,2)。茶条槭叶肉细胞的叶绿体结构完整,也紧贴细胞壁排列;类囊体片层排列规则,含有较多嗜锇颗粒;细胞核正常(图1-3,4)。红桤木叶肉细胞的叶绿体结构也很完整;类囊体片层无扩张现象;细胞核核膜完整,内部染色质分布均匀(图1-5,6)。水紫树叶肉细胞的叶绿体紧贴细胞壁排列,呈狭长的带状;类囊体片层结构正常;细胞核核膜完整(图1-7~9)。美国皂荚叶肉细胞的叶绿体也紧贴细胞壁排列;类囊体片层结构完整,含有极少量嗜锇颗粒且颜色较深;细胞核核膜清晰,染色质无凝缩(图1-10~12)。
2.2 经4 g·L-1 NaCl胁迫处理后5个树种叶肉细胞的超微结构
经4 g·L-1NaCl 胁迫处理3 d后,5个树种叶肉细胞的超微结构见图2。与对照相比,5个树种叶肉细胞的超微结构均发生了一定的变化。美国白蜡叶肉细胞的叶绿体仍紧贴细胞壁排列,但略微肿胀;类囊体片层轻微扩张,嗜锇颗粒数量增加;细胞核状况与正常条件下的细胞核接近,但部分染色质消失;叶肉细胞内出现大量的环状片层,但细胞未发生质壁分离现象(图2-1~3)。茶条槭叶肉细胞的叶绿体也出现肿胀现象,形状接近于圆柱形;类囊体片层结构不规则,嗜锇颗粒数量增加;细胞核仍处于正常状态;但叶肉细胞有轻微的质壁分离现象(图2-4,5)。红桤木叶肉细胞的叶绿体也发生肿胀;类囊体片层呈扩张状态,嗜锇颗粒数量增多且颜色较浅;细胞核的部分核膜消失;叶肉细胞内出现环状片层,但细胞并未发生质壁分离现象(图2-6~8)。水紫树叶肉细胞的叶绿体也发生肿胀,叶绿体游离于细胞中央;类囊体片层结构混乱,嗜锇颗粒大量增加;细胞核内的染色质减少并发生凝聚;叶肉细胞内出现环状片层,且细胞发生质壁分离现象(图2-9~11)。美国皂荚叶肉细胞的叶绿体出现肿胀变形,外膜部分消失,嗜锇颗粒增大并增多;细胞核的部分核膜消失、染色质减少并开始凝聚到核膜边缘;细胞发生轻微的质壁分离现象(图2-12)。

图1 正常条件下(0 g·L-1 NaCl)5个树种幼苗叶肉细胞的超微结构Fig.1 The ultrastructure ofmesophyll cells of seedlings of five tree species under normal condition(0 g·L-1 NaC l)
2.3 经8 g·L-1 NaCl胁迫处理后5个树种叶肉细胞的超微结构
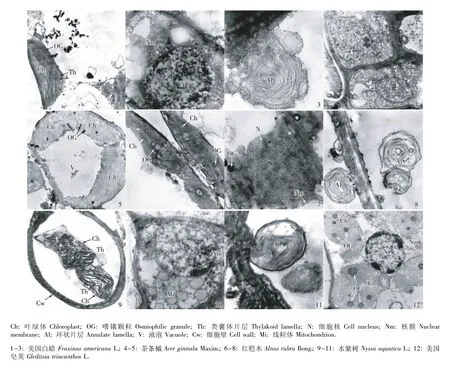
图2 经4 g·L-1 NaCl胁迫处理后5个树种幼苗叶肉细胞的超微结构Fig.2 The ultrastructure ofmesophyll cells of seed lings of five tree species after stressed w ith 4 g·L-1 NaCl
经8 g·L-1NaCl胁迫处理3 d后,5个树种叶肉细胞的超微结构见图3。与对照及4 g·L-1NaCl胁迫处理组相比,经8 g·L-1NaCl胁迫处理后5个树种叶肉细胞超微结构的变化更明显。美国白蜡叶肉细胞叶绿体的类囊体片层扩张程度更大且排列不规则;细胞核内染色质减少,部分核膜受损;但细胞未发生质壁分离现象(图3-1)。茶条槭叶肉细胞的叶绿体严重肿胀;类囊体片层排列不规则,嗜锇颗粒增大且颜色加深;细胞核内染色质严重凝聚,核膜破裂;细胞的质壁分离现象更明显(图3-2)。红桤木叶肉细胞的叶绿体也发生肿胀;类囊体片层排列较规则,嗜锇颗粒增多;细胞核内染色质较少,核膜消失但仍有环状片层;细胞未发生质壁分离现象(图3-3,4)。水紫树叶肉细胞的叶绿体破裂,结构严重受损;嗜锇颗粒增大并增多,且部分嗜锇颗粒变空;细胞核内染色质凝缩严重,核膜破裂;细胞发生严重的质壁分离现象(图3-5,6)。美国皂荚叶肉细胞的叶绿体外膜破裂,嗜锇颗粒增大并增多;细胞核严重降解并凝聚到核膜附近,细胞的质壁分离现象更加严重(图3-7,8)。
3 讨论和结论
经过不同质量浓度NaCl胁迫处理后5个树种叶肉细胞的超微结构均有一定的变化,但叶肉细胞内各细胞器对NaCl胁迫的敏感性和耐受性不同,其中叶绿体和细胞核对NaCl胁迫较敏感。叶绿体是植物细胞产生活性氧的重要细胞器,在正常情况下,叶绿体内活性氧的产生和清除处于动态平衡状态,叶绿体内的SOD可将超氧阴离子自由基歧化为H2O2,并主要通过AsA-GSH循环途径清除H2O2[1,15]。胁迫环境可导致叶绿体中H2O2的积累,H2O2通过Haber-Weiss反应产生攻击力更强的羟自由基,并启动膜脂过氧化反应,致使膜脂和膜蛋白遭到破坏,从而影响细胞膜结构[16-17]。本研究结果表明:随NaCl胁迫程度的加强,叶肉细胞中叶绿体结构受到不同程度的破坏,叶绿体发生肿胀、外膜破裂、类囊体片层结构混乱,这些特征与贾恢先等[18]和殷秀杰等[19]的研究结果相似。

图3 经8 g·L-1 NaCl胁迫处理后5个树种幼苗叶肉细胞的超微结构Fig.3 The ultrastructure ofmesophyll cells of seed lings of five tree species after stressed w ith 8 g·L-1 NaCl
细胞核也是植物细胞内的重要细胞器之一,是遗传信息储存、复制、表达的主要场所。有学者认为细胞核的变形和核膜的内折会影响基因的表达和细胞内蛋白质的合成及细胞分化[20-21]。NaCl胁迫条件下,细胞核最明显的受害特征是核染色质凝聚,这种现象会造成细胞器功能与结构的缺陷,直接影响细胞活动。本研究结果表明:在NaCl质量浓度较低(4 g·L-1)的条件下,叶肉细胞的细胞核结构基本维持正常,仅少量染色质减少;而在NaCl质量浓度较高(8 g·L-1)的条件下,细胞核内染色质发生凝聚,并聚集至核膜附近。推测染色质的凝聚可能是由于NaCl胁迫改变了细胞核内生物大分子(如核酸)的结构等,从而在分子水平上造成DNA损伤,对细胞核造成不可逆的损害[22-23]。
在NaCl胁迫过程中,红桤木、美国白蜡和水紫树的叶肉细胞中均产生了环状片层。吴晓东等[24]在荠菜〔Capsella bursa-pastoris(L.)Medic.〕胚细胞和胚柄细胞中均发现了环状片层,指出环状片层是内质网的一种存在类型,由2~100个片层结构平行排列成弧状或同心圆状;并认为环状片层可能与细胞分裂、细胞增殖、细胞对损伤的保护性反应有关。而在本研究供试的5个树种的叶肉细胞中,环状片层出现在NaCl胁迫之后,说明细胞中的环状片层可能是植物细胞对损伤的保护性反应,与植物的抗逆性机制密切相关,但其功能还有待于进一步研究确认。
赵曼容等[25]认为:嗜锇颗粒是脂类物质和锇酸的聚合物,它的产生一方面是由于类囊体降解以及降解脂质聚集的结果,可作为植物遭受损害程度的鉴定指标;另一方面,在同一胁迫条件下,嗜锇颗粒越多,表明植物体内的脂类物质越多,对膜结构完整性和植物重要器官进行正常代谢活动的保护能力越强,所以,嗜锇颗粒还能作为判断植物抗逆性能力的指标。在本研究中,随NaCl胁迫程度的增强,5个树种叶肉细胞受破坏程度加剧,类囊体片层结构中嗜锇颗粒明显增多,与汪贵斌等[14]和葛秀秀等[26]的研究结果基本一致。
细胞器和膜结构的破坏是植物受到盐害的共同特征,破坏程度取决于植物耐盐性的强弱。一般来说,耐盐性强的种类,其细胞膜系统及细胞器的稳定性均较高,受破坏的程度较小[1]。在8 g·L-1NaCl胁迫条件下,红桤木叶肉细胞的细胞器最稳定,未发生质壁分离现象;美国白蜡的叶肉细胞尽管核膜部分受损但并未发生质壁分离现象;美国皂荚和茶条槭叶肉细胞膜系统的破坏程度不大,仅有轻微的质壁分离现象;而水紫树叶肉细胞的细胞膜系统破坏程度较严重,在NaCl质量浓度较低(4 g·L-1)的条件下质壁分离现象就较为明显。因而,红桤木和美国白蜡对NaCl胁迫的耐性相对较强,美国皂荚和茶条槭也有一定的耐性,水紫树对NaCl胁迫的耐性最弱。
[1]CHEESEMAN JM.Mechanisms of salinity tolerance in plants[J].Plant Physiology,1988,87(3):547-550.
[2]郑敏娜,李向林,万里强,等.水分胁迫对6种禾草叶绿体、线粒体超微结构及光合作用的影响[J].草地学报,2009,17(5): 643-649.
[3]王小平,宋东杰,周泉澄,等.Cr3+胁迫对苦草叶片活性氧清除系统和叶细胞超微结构的影响[J].植物资源与环境学报,2008,17(2):56-60.
[4]郝明灼,彭方仁,梁有旺,等.4个北美引进树种种子品质检验及播种育苗方法[J].林业科技开发,2009,23(4):85-88.
[5]MCLEOD KW,CIRAVOLO TG.Cobaltuptake by Nyssa aquatica,N.sylvatica var.biflora,and Taxodium distichum seedlings[J].Wetlands,2007,27(1):40-43.
[6]季琳琳,杨 李.种子不同保存方法及播种时间对水紫树发芽和幼苗生长的影响[J].江苏林业科技,2010,37(3):22-24.
[7]尤禄祥,吕 梅,方炎明.红桤木引种栽培试验[J].林业科技开发,2009,36(6):6-9.
[8]程 钧,张晓平,方炎明.不同浓度NaCl胁迫对红桤木幼苗生长及部分生理指标的影响[J].中国农学通报,2010,26(6): 142-145.
[9]曹学锋,尹伟伦,夏新莉.北京引种无刺美国皂荚试验初报[J].山东林业科技,2008,38(5):11-12,27.
[10]董必慧.盐城沿海湿地美国白蜡树引种造林试验[J].东北林业大学学报,2006,34(2):22-23.
[11]孙 晶,王庆成,刘 强,等.NaHCO3胁迫下朝鲜接骨木和茶条槭苗木的生长及生理响应[J].林业科学,2010,46(8): 71-77.
[12]杨 静,陈金林,徐柏森,等.盐胁迫对美国白蜡和滨梅根系超微结构的影响[J].西南林学院学报,2009,29(5):23-27.
[13]彭方仁,朱振贤,谭鹏鹏,等.NaCl胁迫对5个树种幼苗叶片叶绿素荧光参数的影响[J].植物资源与环境学报,2010,19 (3):42-47.
[14]汪贵斌,曹福亮,景 茂,等.水分胁迫对银杏叶片叶肉细胞超微结构的影响[J].南京林业大学学报:自然科学版,2008,32(5):65-70.
[15]ASADA K.The water-water cycle in chloroplasts:scavenging of active oxygen and dissipation of excess photons[J].Annual Review of Plant Physiology and PlantMolecular Biology,1999,50 (1):601-639.
[16]林植芳,李双顺,林桂珠,等.水稻叶片的衰老与超氧物歧化酶活性及脂质过氧化作用的关系[J].植物学报,1984,26 (6):605-615.
[17]蒋明义,杨文英,徐 江,等.渗透胁迫下水稻幼苗中叶绿素降解的活性氧损伤作用[J].植物学报,1994,36(4):289-295.
[18]贾恢先,赵曼容.典型盐地植物叶绿体超微结构的研究[J].西北植物学报,1990,10(1):70-72.
[19]殷秀杰,胡宝忠,崔国文,等.盐胁迫对白三叶叶肉细胞超微结构的影响[J].东北农业大学学报,2011,42(4):125-128.
[20]孙 辉,陆 敏,徐爱菊.沙打旺组织培养中脱分化细胞的超微结构及细胞核的动态变化[J].武汉植物学研究,1994,12 (1):53-59.
[21]王凤茹,张 红,商振清,等.干旱逆境下小麦幼苗叶片细胞核超微结构与钙离子的关系[J].华北农学报,2000,15(S1): 4-7.
[22]龚 明,丁念诚,贺子义,等.盐胁迫下大麦和小麦叶片脂质过氧化伤害与超微结构变化的关系[J].植物学报,1989,31 (11):841-846.
[23]秘彩莉,黄占景,邵素霞,等.近似等位基因系小麦盐胁迫下叶绿体超微结构的比较研究[J].电子显微学报,2001,20 (2):95-101.
[24]吴晓东,向国胜,杨世杰.被子植物胚性细胞及嫁接愈伤组织中的环状片层[J].电子显微学报,1998,17(2):119-124.
[25]赵曼容,贾恢先.几种典型盐地植物超微结构的研究[J].干旱区资源与环境,1993,7(3/4):334-337.
[26]葛秀秀,房克凤,郝 强,等.北方四种卫矛属常绿阔叶植物叶肉细胞超微结构在冬季的适应性变化[J].电子显微学报,2010,29(2):167-172.
