模拟昆虫取食对红皮云杉幼苗根部酶活性的影响
——根部中保护性酶和防御酶活性的变化情况
2012-12-29马晓乾宋小双赵红盈遇文婧范海娟
马晓乾,滑 莎,宋小双,赵红盈,遇文婧,范海娟
(1.黑龙江省林业科学院 森林保护研究所,黑龙江 哈尔滨 150040;2.东北林业大学 林学院,黑龙江 哈尔滨 150040)
模拟昆虫取食对红皮云杉幼苗根部酶活性的影响
——根部中保护性酶和防御酶活性的变化情况
马晓乾1,滑 莎1,宋小双1,赵红盈1,遇文婧1,范海娟2
(1.黑龙江省林业科学院 森林保护研究所,黑龙江 哈尔滨 150040;2.东北林业大学 林学院,黑龙江 哈尔滨 150040)
通过不同损伤处理模拟地下害虫取食红皮云杉幼苗根部,分析测定不同程度损伤后红皮云杉幼苗根部中保护性酶和防御酶活力的变化情况。结果表明:不同损伤处理模拟地下害虫取食后,均不同程度诱导了幼苗根部保护酶和防御酶活力的升高,表明模拟昆虫取食后诱导红皮云杉幼苗增加了抗虫性;其中25%损伤诱导红皮云杉幼苗根部过氧化氢酶(CAT) 、超氧化物歧化酶(SOD) 、苯丙氨酸解氨酶(PAL)和多酚氧化酶(PPO)活力均较对照升高明显,而50%和75%损伤程度诱导与对照相比较有所升高,但不明显;其中25%损伤后5 d CAT活力,25%损伤后12h和3d、50%损伤后6 h和10 d SOD活力,25%损伤后3、6、12h和1d、50%损伤后3、6、12h和3d PAL活力和25%损伤后12、1d和10 d、50%损伤后12h、75%损伤后3d PPO活力均与对照差异显著。
模拟昆虫取食;红皮云杉;酶活性;过氧化氢酶;超氧化物歧化酶;苯丙氨酸解氨酶;多酚氧化酶
植物在自然界长期进化的过程中形成了多种自我防御机制,这种自我防御机制是植物与生境长期相互作用逐步发展而成的,可分为组织防御和诱导防御。植物受到损伤、昆虫取食等影响后,不仅营养物质会发生变化,而且还会诱导植物体内保护性酶和防御酶等的变化。保护性酶包括过氧化氢酶(CAT) 、过氧化物酶(POD) 和超氧化物歧化酶(SOD) ,这些都是植物体内重要的抗氧化酶[1],能有效地抑制活性氧(ROS )对植物细胞膜、DNA 和蛋白质的侵害[2-3],维持体内氧化代谢的平衡,从而保证植物的健康生长。许多研究表明:CAT、POD 和 SOD的活性与抗虫性有关[4-7]。苯丙氨酸解氨酶(PAL)和多酚氧化酶(PPO)的活力是反应植物抗性指标的生化指标[8],有研究发现昆虫取食和病原菌攻击后防御酶活力水平升高[9-10]。对寄主植物受到损伤或昆虫取食后诱导寄主植物体内保护性酶和防御酶活性变化的研究,有助于揭示寄主植物诱导抗虫的原理及植食性昆虫与寄主植物之间的相互作用机制关系。红皮云杉Picea koraiensis为东北及华北地区主要森林及城市绿化树种,目前有关损伤模拟昆虫取食后红皮云杉幼苗体内保护性酶和防御酶活性的变化等相关研究还未见报道。本研究通过不同损伤处理模拟地下害虫取食红皮云杉幼苗根部,探讨不同处理后对红皮云杉幼苗根部中过氧化氢酶、超氧化物歧化酶、苯丙氨酸解氨酶和多酚氧化酶活力的诱导随时间变化情况及不同处理诱导变化的差异性,为红皮云杉遗传改良和抗虫育种提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 标本采集
于2011年6月下旬至8月上旬期间,在黑龙江省伊春市带岭区国家级实验苗圃基地(东经 128°37′44″~ 129°17′51″; 北 纬 46°50′10″~47°21′33″),选择2年生红皮云杉幼苗,进行根部损伤(25%、50%、75%)处理,以无损伤云杉幼苗为对照(CK)。处理后分3、6、12h及1、2、3、5、10、15、20、25、30、40 d采集标本,置入便携式冰箱带回室内,而后放入-20℃冰箱内保存。
1.1.2 主要仪器及药剂
主要仪器:T6-751紫外分光光度计、TG16-WS台式高速离心机均为北京六一仪器厂制造。主要试剂:pH7.8磷酸缓冲液(内含1%聚乙烯比咯烷酮)、甲硫氨酸、氮蓝四唑、EDTA-Na2、核黄素、pH值为8.8的硼酸盐缓冲溶液、苯丙氨酸、羟基乙醇硼酸缓冲液等均由哈尔滨市化学试剂公司提供。
1.2 试验方法
1.2.1 样品的制备
将采集的2年生云杉幼苗除根部外全剪去,然后将根部剪成1cm左右小段,称取0.100~0.400 g,移入研钵,加液氮研磨呈匀浆,转移至5 mL离心管中,待液氮蒸发后置-20 ℃冰箱内保存,一周内测定。
1.2.2 测定方法
过氧化氢酶、超氧化物歧化酶、苯丙氨酸解氨酶和多酚氧化酶活力测定分别采用紫外吸收法、氮蓝四唑法、紫外吸收法和分光光度法[11]。
1.2.3 数据统计及分析方法
实验中所有数据采用Excel及SPSS18.0软件进行统计和分析。对不同损伤程度模拟昆虫取食后,红皮云杉幼苗根部中过氧化氢酶、超氧化物歧化酶、苯丙氨酸解氨酶和多酚氧化酶活力随时间的变化用Duncan’s法分析其差异性。
2 结果与分析
2.1 不同损伤程度对红皮云杉幼苗根部中过氧化氢酶活力的影响
通过不同程度损伤模拟地下害虫取食后,红皮云杉幼苗根部中过氧化氢酶活力有所升高,因损伤程度不同表现出一定的差异,在不同时间也呈现一定的差异(见图1)。3h后,不同损伤程度红皮云杉幼苗根部中过氧化氢活力与对照无明显差异;6 h后,不同程度损伤后过氧化氢酶活力均有所升高,而后表现出一定的差异性。25%损伤后过氧化氢酶活力不断升高至1d时呈下降趋势,与对照接近,3d时又呈上升趋势至5 d时达到最高值,后呈下降趋势,10 d后略高于对照并逐渐向对照靠近。50%损伤后过氧过氧化氢酶活力呈现升高至1d时开始表现为下降趋势,至2d时与对照接近后呈现与对照无明显差异。75%损伤后过氧化氢酶活力6 h后表现为下降,1d时与对照接近,而后继续下降至2d时为最低,后逐渐升高接近对照,5 d后与对照无明显差异。对不同程度损伤后不同时间红皮云杉幼苗根部中过氧化氢酶活力所测的数据经Duncan’s法进行差异性分析,结果显示,25%损伤后5 d时过氧化氢酶活力与对照相比较差异显著。

图1 不同损伤程度对红皮云杉幼苗根部中过氧化氢酶活力的影响Fig.1Effects of different damage degree on CAT activity in roots of Picea koraiensis seedling
2.2 不同损伤程度对红皮云杉幼苗根部中超氧化物歧化酶活力的影响
通过不同程度损伤红皮云杉幼苗根部模拟地下害虫取食后,诱导了红皮云杉幼苗根部中超氧化物歧化酶的变化,不同损伤程度呈现一定的差异性(见图2)。3h后不同损伤程度后红皮云杉幼苗根部中超氧化物歧化酶活力均有所升高。25%损伤后超氧化物歧化酶活力表现为升高并呈一定的波动性,12h达到最高值,1d时与对照接近,后又呈上升趋势,在3d时达到高峰,而后逐渐波动趋向对照,25 d后接近对照并与对照波动一致。50%损伤后6 h后下降, 12h后与对照超氧化物歧化酶活力变化无明显差异。75%损伤后超氧化物歧化酶活力在1d至3d间低于对照,而后呈波动变化,与对照无明显差异。对不同程度损伤后不同时间红皮云杉幼苗根部中超氧化物歧化酶活力所测的数据经Duncan’s法进行差异性分析,结果显示,25%损伤后12h和3d时,50%损伤后6 h和10 d时超氧化物歧化酶活力与对照相比较差异显著。
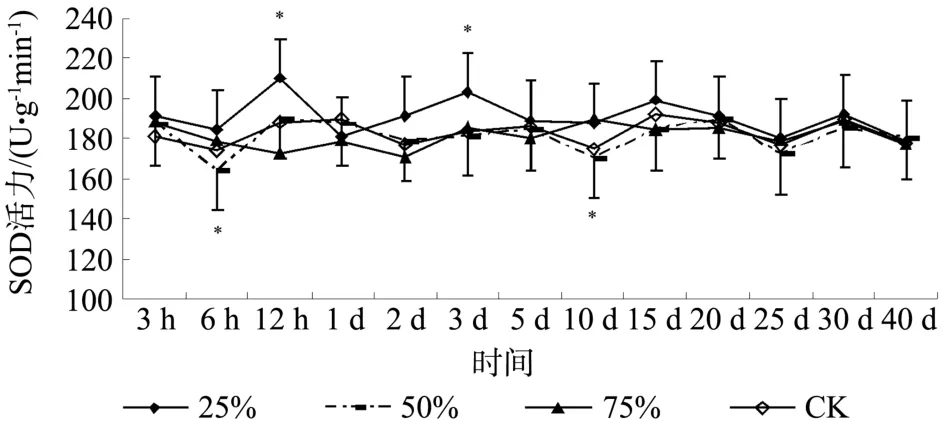
图2 不同损伤程度对红皮云杉幼苗根部中超氧化物歧化酶活力的影响Fig.2Effects of different damage degree on SOD activity in roots of Picea koraiensis seedling
2.3 不同损伤程度对红皮云杉幼苗根部中苯丙氨酸解氨酶活力的影响
通过不同程度损伤红皮云杉幼苗根部模拟地下害虫取食后,诱导了红皮云杉幼苗根部中苯丙氨酸解氨酶活力的变化,不同损伤程度诱导酶活力变化有一定的差异性(见图3)。不同损伤程度3~6 h之间苯丙氨酸解氨酶活力均表现为升高,其中25%和75%损伤酶活力升高比较明显,而后呈现不同波动趋势。25%损伤6 h后苯丙氨酸解氨酶酶活力呈平稳逐渐下降趋势至10 d时基本与对照接近,而后与对照无明显差异。50%损伤6 h后苯丙氨酸解氨酶活力表现为下降趋势至1d时与对照接近,而后又表现为升高趋势至3d时为最高值,接着表现为下降趋势至10 d后与对照接近,而后与对照无明显差异并呈现一致的波动性。75%损伤苯丙氨酸解氨酶活力6 h后也表现为下降趋势至1d后与对照基本一致。对不同程度损伤后不同时间红皮云杉幼苗根部中苯丙氨酸解氨酶活力所测的数据经Duncan’s法进行差异性分析,结果显示,25%损伤后3、6 、12h和1d,50%损伤后3h、6 h、12h和3d时苯丙氨酸解氨酶活力与对照相比较差异显著。
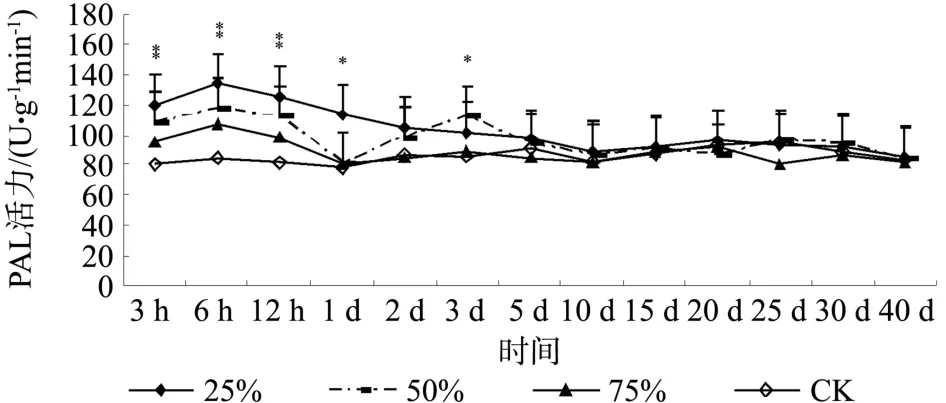
图3 不同损伤程度对红皮云杉幼苗根部中苯丙氨酸解氨酶活力的影响Fig.3Effects of different damage degree on PAL activity in roots of Picea koraiensis seedling
2.4 不同损伤程度对红皮云杉幼苗根部中多酚氧化酶活力的影响
通过不同损伤程度模拟地下害虫取食红皮云杉幼苗根部后,诱导了红皮云杉幼苗根部中多酚氧化酶活力的变化,不同损伤程度酶活力变化表现为一定的差异性(见图4)。3h后,不同程度损伤后多酚氧化酶活力均无明显变化,而后表现出一定的差异性。25%损伤后6 h多酚氧化酶活力表现为升高趋势至12h后为最高,后呈缓慢下降趋势至3d时与对照接近,于10 d时又呈现升高趋势,而后表现出逐渐下降,于30 d时基本与对照一致。50%损伤后多酚氧化酶活力在6 h、2d、和15 d时表现为略高于对照,12h表现为略低于对照,其他时间点与对照无明显差异。75%损伤后多酚氧化酶活力在6 h、3d时略低于对照,其余时间点与对照均无明显差异。对不同程度损伤后不同时间红皮云杉幼苗根部中多酚氧化酶活力所测的数据经Duncan’s法进行差异性分析,结果显示,25%损伤后12h、1d和10 d时,50%损伤后12h时,75%损伤后3d时多酚氧化酶活力与对照相比较差异显著。

图4 不同损伤程度对红皮云杉幼苗根部中多酚氧化酶活力的影响Fig.4 Effects of different damage degree on PPO activity in roots of Picea koraiensis seedling
3 结论与讨论
植物在长期适应生境的过程中,形成了多种自我防御体系,在受到植食性昆虫等生物侵害时,能够诱导植物自身防御机制的启动即诱导抗虫性[12]。系统获得的抗性,是植物抵抗植食性昆虫侵害的机制之一[13]。研究发现,植物在受到植食性昆虫侵害时,其体内保护酶和防御酶系会发生适应性的变化,如过氧化氢酶(CAT) 、超氧化物歧化酶(SOD) 、苯丙氨酸解氨酶(PAL)和多酚氧化酶(PPO)是植物诱导抗性机制中发挥保护作用的物质[14-15]。植物诱导抗性是保护性酶和防御性酶催化和调节下实现的[16]。超氧化物歧化酶是活性氧的清除剂,具有维持植物体内活性氧平衡的功能。过氧化氢酶能够清除超氧化物岐化酶催化产生的H2O2,抑制其在细胞内的增加。苯丙氨酸解氨酶和多酚氧化酶在植物体内莽草酸代谢途径中能介导合成木质素、酚类物质等,因此产生抗虫性[17]。在该项研究中,通过不同损伤处理模拟地下害虫取食红皮云杉幼苗根部后,均不同程度诱导了幼苗根部保护酶和防御酶活力的升高,表明模拟昆虫取食后诱导红皮云杉幼苗增加了抗虫性。其中25%损伤诱导红皮云杉幼苗根部过氧化氢酶
(CAT) 、超氧化物歧化酶(SOD) 、苯丙氨酸解氨酶(PAL)和多酚氧化酶(PPO)活力均较对照升高明显,而50%和75%损伤程度诱导与对照相比较有所升高,但不明显。表明随着损伤程度的加重,保护性酶和防御性酶活力增加并不显著,且有接近或低于对照的现象,这一现象是由于红皮云杉幼苗根部不同损伤模拟昆虫取食后,不同程度的抑制或阻止、催化或加速了寄主植物体内发生的多途径的代谢过程的综合表现。
[1] Hema Kumar Chandru, Eunsun Kim, Yongin Kuk, et al. Kinetics of wound-induced activation of antioxidative enzymes in Oryza sativa: differential activation at different growth stages[J]. Plant Science, 2003,164(6):935-941.
[2] Wang Zunsheng, Gu Yuxiang, Yuan Qinsheng. Effect of nutrition factors on the synthesis of superoxide dismutase, catalase,and membrane lipid peroxide levels in Cordyceps militaris mycelium[J]. Current Microbiology, 2006, 52(1):74-79.
[3] Rusina Yordanova Yordanova, Kaloyan Nikolov Christov,Losanka Petrova Popova. Antioxidative enzymes in barley plants subjected to soil flooding[J]. Environmental and Experimental Botany, 2004,51(2):93-101.
[4] Krishnan N, Kodrík D. Antioxidant enzymes in Spodoptera littoralis (Boisduval):Are they enhanced to protect gut tissues during oxidative stress[J]. Journal of Insect Physiology, 2006,52(1):11-20.
[5] Huang Wei, Jia Zhikuan, Han Qingfang. Effects of herbivore stress by Aphis medicaginis Koch on the malondialdehyde contents and the activities of protective enzymes in different alfalfa varieties[J]. Acta. Ecologica. Sinca., 2007, 27(6):2177-2183.
[6] 史 瑞, 迟德富, 张晟铭. 10种杨树酶活性与抗性的关系[J].东北林业大学学报, 2008,36(9):74-75.
[7] 严善春, 门莉娜, 石 蕾,等. 杂种落叶松不同子代针叶内抗氧化酶活性的比较[J]. 林业科学, 2011,47(10):111-114.
[8] 徐 伟. 兴安落叶松诱导抗虫性研究[D].哈尔滨: 东北林业大学, 2006.
[9] 李亚玲, 龙书生, 张宇宏,等. 玉米镰刀菌茎腐病抗性的生化反应[J]. 中国农学通报,2005,21(10):299-302.
[10] 刘裕强, 江 铃, 孙立宏,等. 褐飞虱刺吸诱导的水稻一些防御性酶活性的变化[J]. 植物生理与分子生物学学报, 2005,31(6):643-650.
[11] 王学奎. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社,2006:5.
[12] 谢 辉, 王 燕, 刘银泉,等. 植物组成防御对植食性昆虫的影响[J]. 植物保护, 2012,38(1):1-5.
[13] Jones J D G, Dangl J L. The plant immune system[J]. Nature,2006,444(7117):323-329.
[14] 李 明, 王根轩. 干旱胁迫对甘草幼苗保护酶活性及脂质过氧化作用的影响[J]. 生态学报, 2002,22(4):503-507.
[15] 麻耀华, 尹淑丽, 张丽萍,等. 复合微生态制剂对黄瓜根际土壤微生物数量和酶活性的影响[J]. 植物保护, 2012,38(2):46-50.
[16] 陈年来, 张玉鑫, 王春林,等. BHT处理对甜瓜叶片活性氧代谢的诱导作用[J]. 植物保护学报, 2011,38(6)499-505.
[17] Mauch-Mani B, Slisarenko A j. Production of salicylic acid precursors is a major function of phenylalanine ammonia-lyase in the resistance of Arabidopsis to Peronospora parasitica[J]. Plant Cell, 1996,8(2):203-212.
Effects of simulating insect feeding on enzyme activity in roots of Picea koraiensis seedling: changes of protective and defense enzyme activity
MA Xiao-qian1, HUA Sha1, SONG Xiao-shuang1, ZHAO Hong-ying1, YU Wen-jing1, FAN Hai-juan2
(1. Forest Protection, Heilongjiang Academy of Forestry Institute, Harbin 150040, Heilongjiang, China; 2. College of Forestry, Northeast Forestry University, Harbin 150040, Heilongjiang, China)
Through simulating soil pests feeding Picea koraiensis seedlings roots with different injury, the protective and defense enzyme activity changes in the roots of Picea koraiensis seedlings in varying degrees of damage were determined and analyzed. The results show that after different injury treatments of simulated soil pests feeding, at the seedling roots, the protective enzymes and defense enzyme activity were induced and increased by different levels, this showed that the simulated insect feeding induced by Picea koraiensis seedlings had increased the insect resistance; of the 25% injured toots’ CAT SOD, PAL and PPO activities increased signif i cantly comparing with the control, the 50% and75% injured toots’ induction and activity increased slightly but not obvious; after 5 days 25% damage CAT activity, 25% damage after 12hours and 3days, 6 hours and 10 days after the 50% damage SOD activity, 25%damage 3hours, 6 hours, 12hours and 1day, 50% damage after 3hours, 6 hours,12hours, 12hours and 3days the PAL vitality, and 25%after injury, 1day and 10 days 50% 12hours after damage, 75% after damage, their PPO activities had signif i cant differences compared with the control.
simulated insect feeding; Picea koraiensis; enzyme activity; CAT; SOD; PAL; PPO
S763
A
1673-923X(2012)09-0037-04
2012-05-12
黑龙江省森工总局应用研究项目(sgzjY2010017)
马晓乾(1979-),男,宁夏人,助理研究员,硕士,从事森林病虫害方面的研究工作;E-mail:369086324@qq.com
[本文编校:谢荣秀]
