β-甘露聚糖酶高产菌株发酵条件优化
2012-12-25曲丽娜王瑞明肖静唐卫华孙红梅
曲丽娜,王瑞明,肖静,唐卫华,孙红梅
1(山东轻工业学院食品与生物工程学院,山东济南,250353)2(山东省微生物工程重点实验室,山东济南,250353)
β-甘露聚糖酶(β-1,4-D-mannan mannohydrolase,EC 3.2.1.78)是一种能水解均一甘露聚糖、葡甘露聚糖、半乳甘露聚糖和半乳葡萄甘露聚糖的主链β-1,4-D-甘露糖苷键的半纤维素酶,主要来自于微生物[1-2]。作为一种新型工业用酶,目前存在着发酵酶活力偏低的缺陷,导致其生产和应用成本较高,限制了该酶的广泛应用[3]。
本研究所用菌株Bacillus sp.QYW-1(登录号:JX524224)在单因素优化条件下进行发酵生产,15~16h产酶活力即达到最高,其发酵周期比已报道的芽孢杆菌属其它菌株周期明显缩短,已报道的最短发酵周期为20h左右。Akino等[4]报道的Bacillus sp.AM-001 周期为 24h,Bacillus stearothermophilus 2004[5]和Bacillus sp.N-6[6]的发酵周期分别为 12h 和 18h。该菌株产生的β-甘露聚糖酶与同类其他来源的酶相比具有良好的热稳定性和pH适应性。由于野生菌株产酶活力较低,需要进一步优化培养基及培养条件。Plackett-Burma(PB)实验设计是进行培养基及培养条件优化的常用方法。此方法可以从众多影响因素中快速有效地筛选出最为有效的几个因素[7]。本研究以筛选获得的Bacillus sp.QYW-1为出发菌株,在单因素优化的基础上,确定对产酶活力影响最显著的因素;采用响应面(Response Surface Methodology,RSM)找出影响β-甘露聚糖酶产酶的最佳条件,从而达到对菌株Bacillus sp.QYW-1的产酶条件的优化。
1 材料和方法
1.1 材料
实验菌株:本实验室自行筛选获得的Bacillus sp.QYW-1。
发酵培养基(经单因素实验优化获得):魔芋粉20 g/L,蛋白胨 10 g/L,MgSO45 g/L,NaCl 10 g/L,KCl 6 g/L,NaNO35 g/L,K2HPO44 g/L。
1.2 β-甘露聚糖酶的制备与检测
接6%的种子液(浓度109CFU/mL)于发酵培养基中,37℃,180 r/min培养 15 ~16 h ,8 000 r/min、4℃离心10 min,得粗酶液。
DNS法测定 β-甘露聚糖酶酶活[8]:底物为5 g/L的刺槐豆胶,55℃下反应20 min。酶活力定义为上述条件下产生1 μmol还原糖(甘露糖)所需要的酶量定义为1个酶活单位(U)。
1.3 Plackett-Burman(PB)实验
选用实验次数N=12的实验设计,选取单因素优化实验中对菌株产酶影响较大的培养基的7个组分和培养条件中的1个因素,如下:魔芋粉,NaCl,NaNO3,KCl,接液量,MgSO4,K2HPO4,蛋白胨以及 3个虚拟因素X9、X10、X11等11个因素进行考察,每个因素取高低2个水平,低水平即“-”,高水平即“+”,高水平约为低水平的1.5倍,以β-甘露聚糖酶的酶活力Y(U/mL)为响应值,共进行12次实验以确定每个因素的影响因子。[7]
在Plackett-Burman(PB)实验设计中,运用线性函数进行因素筛选,忽略交互作用的影响[7],线性模型方程见式(1)。
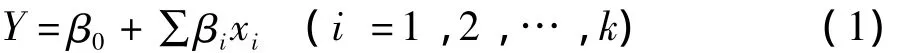
式中:Y为β-甘露聚糖酶酶活力;xi为考察因素;βi是回归系数,与xi的影响程度有关。单一因素的影响由方程(2)计算:
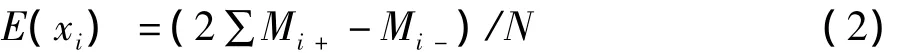
式中:E(xi)是所考察因素的影响水平,Mi+和Mi-为因素i在实验中所测得的酶活力达到最大值和最小值时的数值;N为实验次数。
具体设计见表1,其结果进行方差分析,选取可信度大于95%以上的因素作为影响菌株产β-甘露聚糖酶的主要因素。
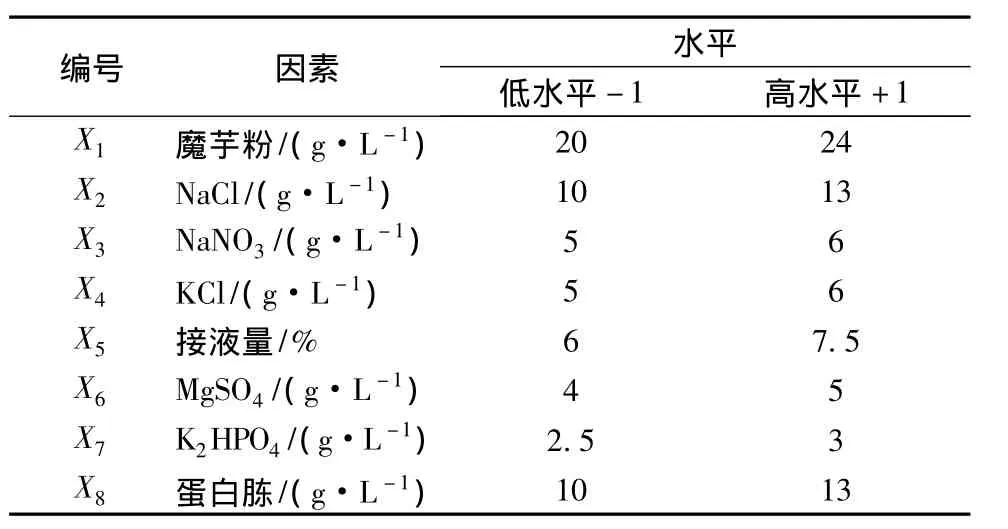
表1 Plackett-Burman(PB)实验设计及因素水平
1.4 最陡爬坡实验设计
根据PB实验所得到的3个重要因素的效应大小的比例设定它们的变化方向及步长进行实验,其余因素的根据各因素效应的正负、大小以及单因素实验结果,正效应的因素取高水平浓度,负效应的因素取低水平浓度,迅速的逼近最佳产酶活力区域以建立有效的响应面拟合方程[9]。
1.5 Box-Behnken响应面优化实验
根据PB实验及最陡爬坡实验结果,选取的每个因素设计3个水平。根据相应的实验设计进行实验后,分析过程中对实验结果采用二阶经验模型对数据进行拟合,得到带交互项和平方项的回归分析模型,分析各因素的主效应和交互效应,最后在一定的水平范围内可求出最佳值。其回归模型(3):
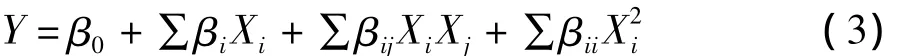
式中:Y 是 β-甘露聚糖酶酶活力;β0、βi、βii依次是偏移项、线性偏移和二阶偏移系数;βij是交互效应系数;Xi、Xj是各因素水平值。
回归方程分别对各自因素水平值求偏导数可得到响应面回归函数的驻点,即可得到实验范围内的最佳产酶培养基组分浓度。根据PB实验结果及最陡爬坡实验结果,3因素的选取水平见表2。其余因素的根据各因素效应的正负、大小以及单因素实验结果,正效应的因素取高水平浓度,负效应的因素取低水平浓度。
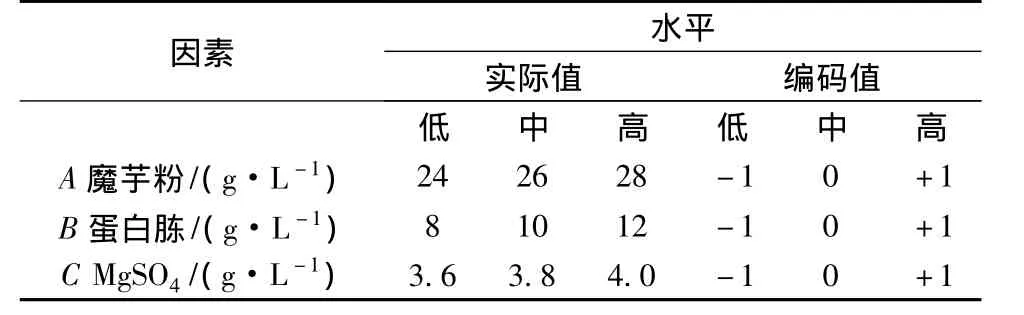
表2 响应面三因素实验水平
1.6 产酶最佳条件验证实验
根据BB实验及Design Expert对回归方程在实验范围内产酶最佳条件的预测培养基组分浓度,进行产酶活力验证实验,实验数据取3次试验结果的平均值,与回归模型的预测值进行比较分析。
2 结果和分析
2.1 Plackett-Burman(PB)实验设计结果与分析
PB实验设计结果见表3。运用Design Expert软件对表1中的β-甘露聚糖酶活力进行回归分析,得到各影响因素的偏回归系数及显著性(表4)。
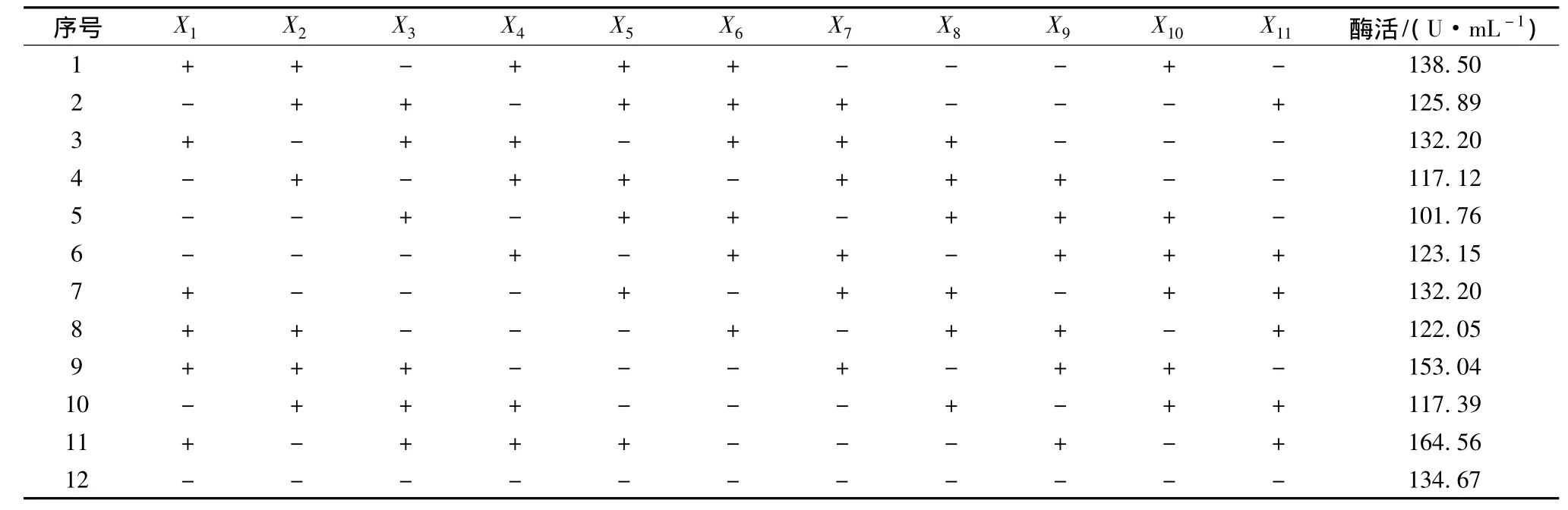
表3 Plackett-Burman(PB)实验设计结果
方差分析模型的Prob(P)>F值为<0.0001,为高度显著,表明该模型在所得回归区域拟合很好;负相关系数R2=0.932 0,说明相关性较好,校正决定系数Adj R2=0.906 5;通常情况下变化系数CV越低,实验的可行度和精确度越高,此实验中CV值等于3.93,表示PB实验的可信度和精确度良好,精密度(Adeq precision)是有效信号与噪声的比值,大于4.0视为合理,该实验中精密度达到17.784。回归方程的方差分析见表5。
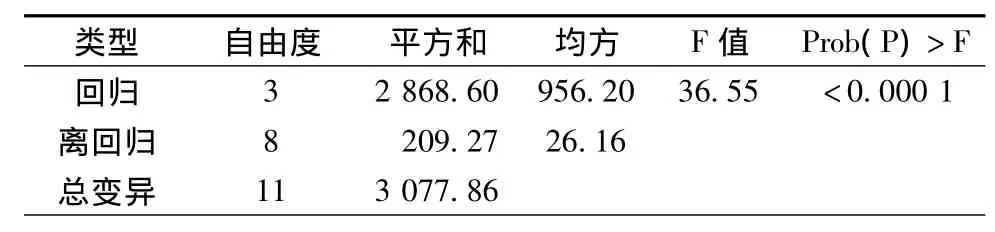
表4 β-甘露聚糖酶产酶活力回归模型方差的方差分析
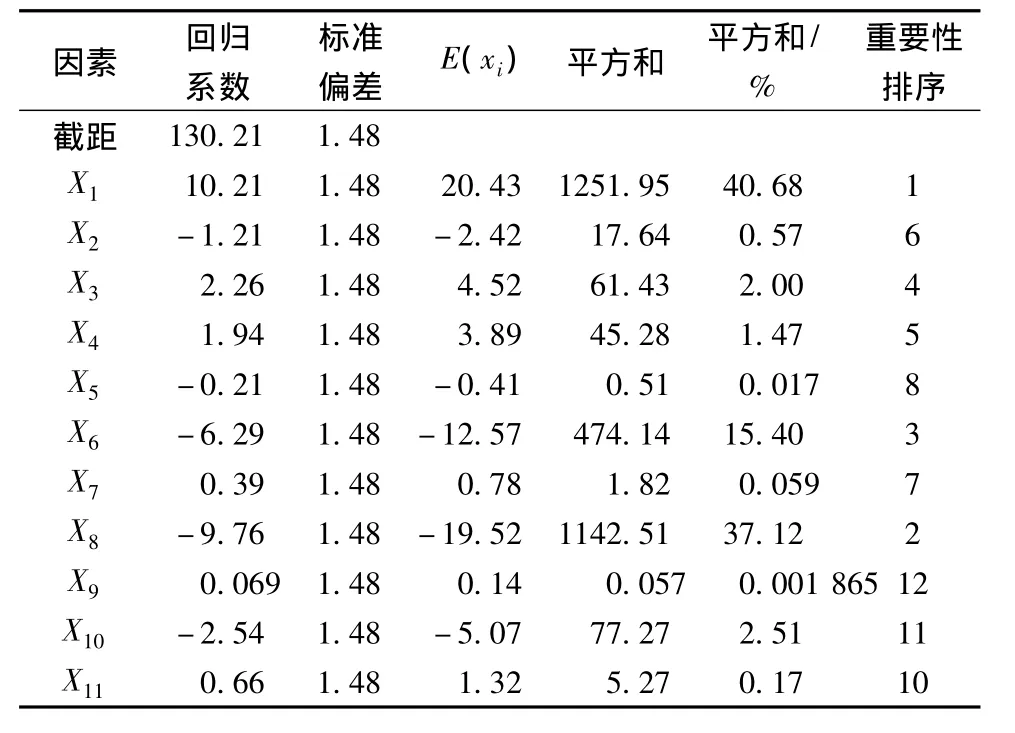
表5 Plackett-Burman(PB)实验偏回归系数的显著性分析
以因素X1魔芋粉添加量为例:其偏回归系数是10.21,标准误差是1.48,影响水平为E(x1)=20.43,表明因素X1对β-甘露聚糖酶产酶活力的影响为正效应,即随着魔芋粉添加量的增加,酶活呈增加趋势,因此在后继因素优化试验中应提高魔芋粉的添加量,因素X1的平方和百分值是40.68%,较之其他因素的相应值明显较高,因此显著性分析结果最为重要。由表7可明显看出因素X1(魔芋粉添加量)、X6(MgSO4添加量)、X8(蛋白胨添加量)为主要影响因子,其影响值分别是40.68%、15.40%、37.12%,而3个虚拟因素 X9、X10和 X11对影响值 (0.0019%、2.51%、0.17%)较低,表明了该线性模型的适用性。经影响因素筛选,得到以酶活为响应值的线性回归方程
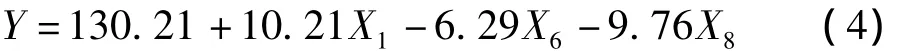
式中:X1=(魔芋粉 -22)/2;X6=(MgSO4-4.5)/0.5;X8=(蛋白胨-13.5)/1.5
通过方差分析,魔芋粉、蛋白胨和MgSO43个因素的可信度均大于95%,对β-甘露聚糖酶产酶活力的影响最为显著,选择这3个因素进一步作最陡爬坡实验和RSM实验。其中魔芋粉高水平好,其它两个因素低水平好。其余因素的根据各因素效应的正负、大小以及单因素实验结果,正效应的因素取高水平浓度,负效应的因素取低水平浓度。
2.2 最陡爬坡实验结果
根据3个重要因素的效应值及单因素实验结果设定,魔芋粉为正方向,步长为2 g/L;蛋白胨与Mg-SO4为负方向,步长分别为1 g/L、0.1 g/L。最佳产酶培养基组成在实验2与4之间(表6)。
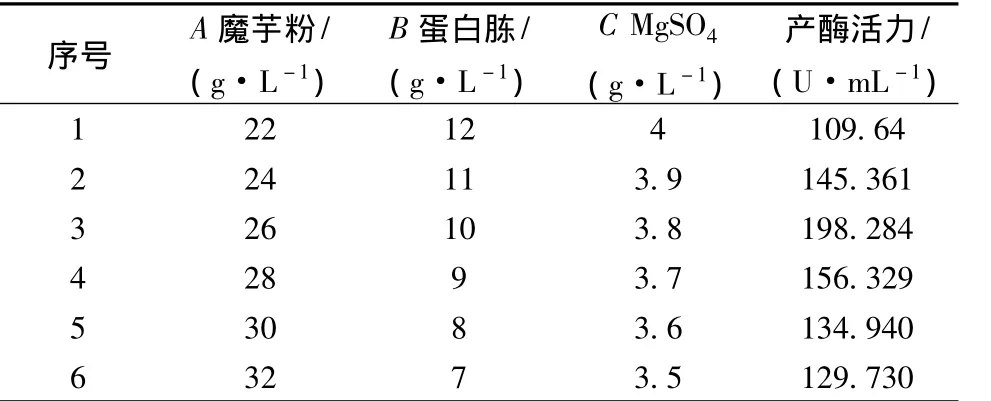
表6 最陡爬坡实验设计与结果
2.3 Box-Behnken优化设计结果与响应面分析
通过对A:魔芋粉、B:蛋白胨、C:MgSO4进行中心组合设计(表7),并利用Design-expert软件对Box-Behnken实验数据进行方差分析后得到模型的二次多项回归方程为:
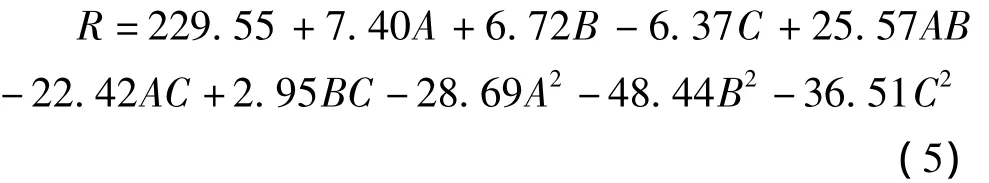
式中:R为响应值,即β-甘露聚糖酶酶活力;A、B、C分别为魔芋粉、蛋白胨、MgSO4添加量。
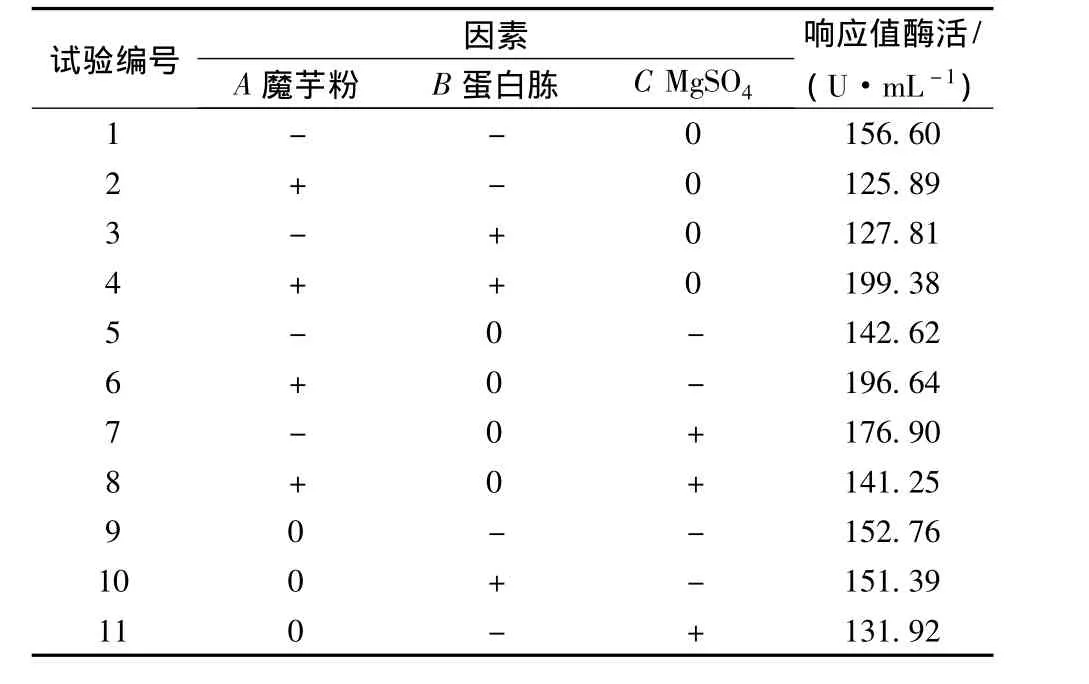
表7 RSM实验方案与结果
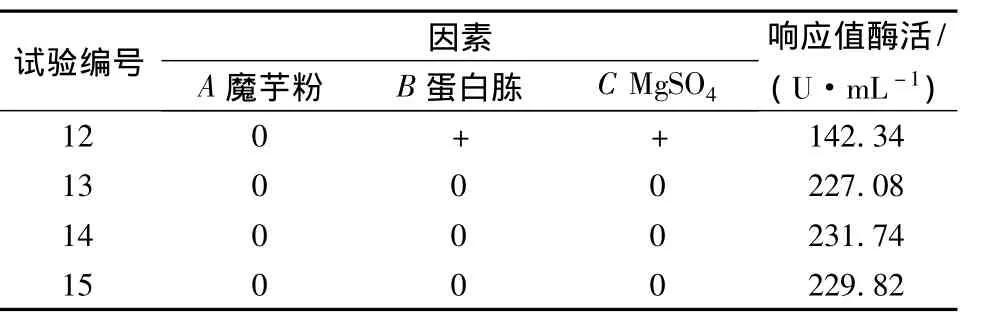
试验编号 因素A魔芋粉 B蛋白胨 C MgSO4响应值酶活/(U·mL-1)12 0 + + 142.34 13 0 0 0 227.08 14 0 0 0 231.74 15 0 0 0 229.82
响应面分析中对Box-Behnken实验结果进行拟合二次模型方差分析如表8。分析结果表明,回归方程的多元相关系数R2=98.82%,校正决定系数Adj R2=96.70%,说明回归方程拟合程度良好。方差分析得知,Prob(P)>F值为0.000 3(<0.05为模型显著),表明该回归模型高度显著,可以用来进行相应值预测。魔芋粉添加浓度对菌株产β-甘露聚糖酶酶活力具有正效应,P=0.029 9;其次为蛋白胨和Mg-SO4,P值分别为0.041 4和0.049 0(皆<0.05)为显著;而失拟项P=0.067 0(>0.05)不显著,说明回归显著;交互项 AB、AC的 P值分别为 0.000 7和0.0013,为显著;交互项BC不显著,P=0.436 1。
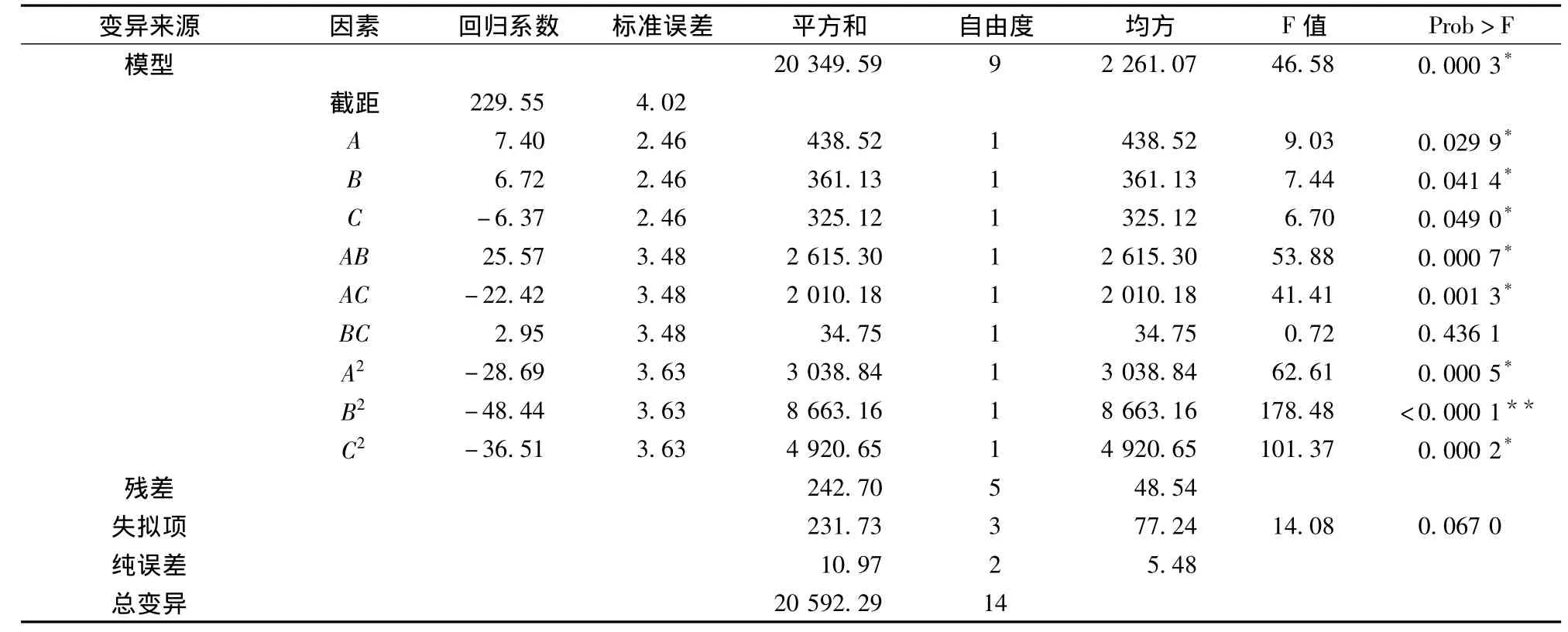
表8 中心组合设计二次模型方差分析
2.4 回归模型的优化
交互项BC(P>0.05)对菌株产酶影响不显著,因此采用手动优化的方法对回归模型进行优化,优化的结果见表9。经手动优化后的回归方程为:
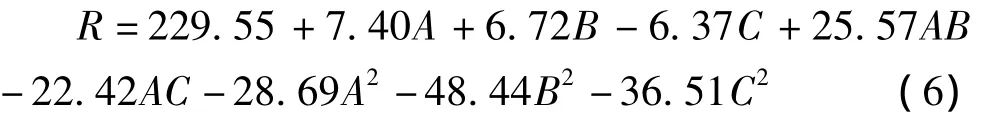
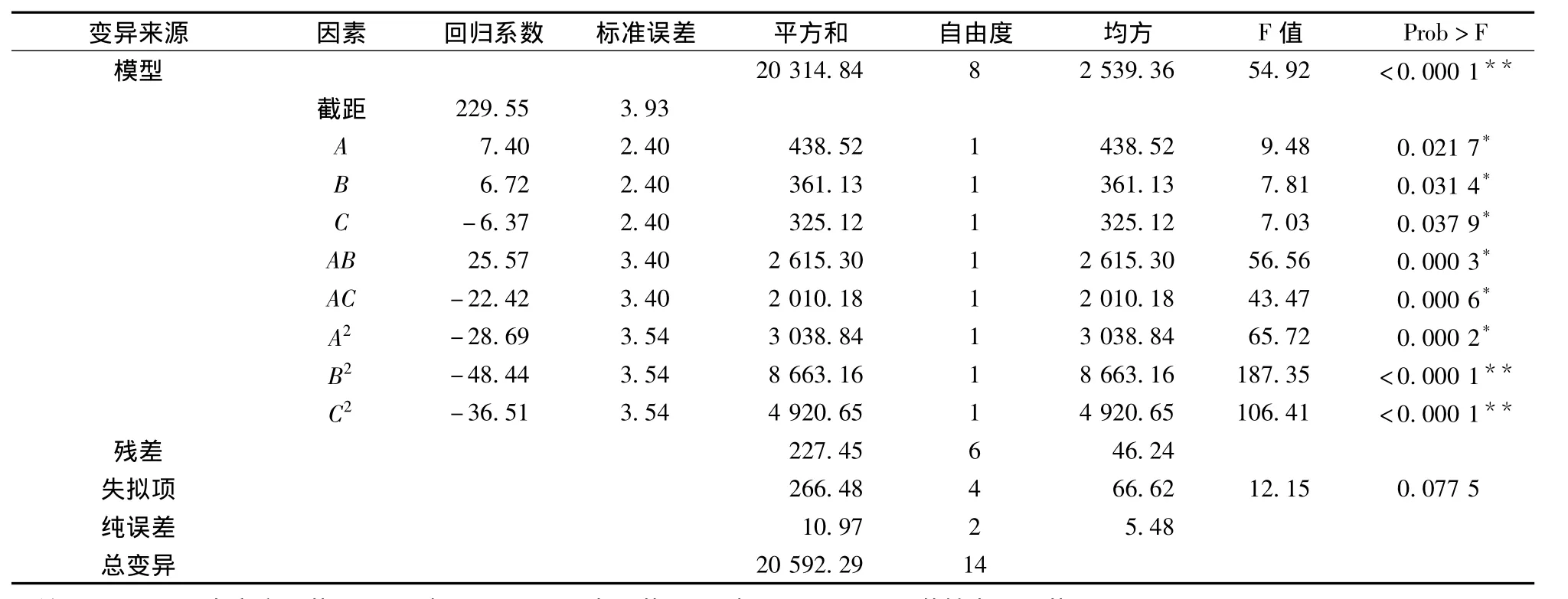
表9 去掉交互项BC后的优化结果
由表9可知,失拟项不显著(P=0.0775>0.05),而模型的P<0.000 1,表明模型高度显著;同时软件分析的复相关系数R2为98.65%,校正后的Adj R2=0.968 6,表明该模型的拟合程度良好,实验误差小,该模型是合适的,可以用此模型对菌株Bacillus sp.QYW-1产β-甘露聚糖酶进行分析和预测;在实验所选取的因素水平范围内,各因素对产酶活力的影响排序为魔芋粉>蛋白胨>MgSO4。
利用Design-Expert对经手动优化后的回归方程中的交互项AB和AC绘制响应面分析图和等高图,椭圆形表示两个因素交互作用显著,圆形表示两因素交互作用微弱,如图1和图2所示。
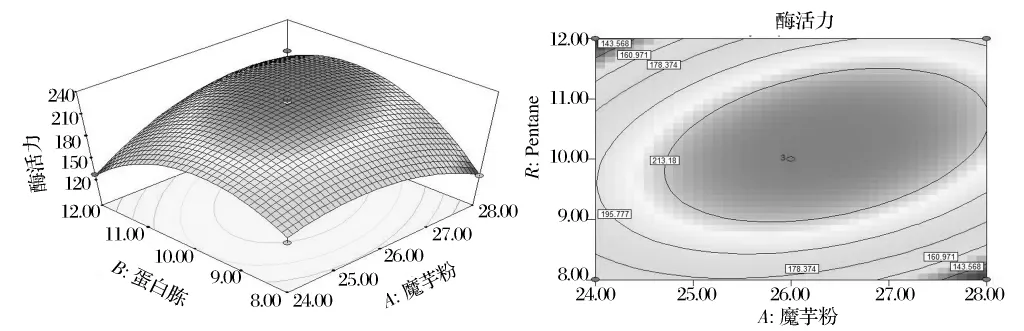
图1 魔芋粉A和蛋白胨B对菌株产酶交互影响响应面图及等高图
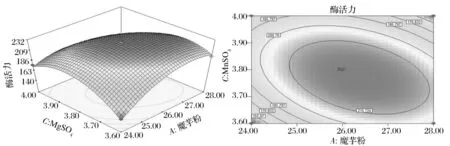
图2 魔芋粉A和MgSO4C对菌株产酶交互影响响应面图及等高图
图1 为MgSO4为3.77 g/L条件下,魔芋粉添加量与蛋白胨添加量的交互影响。当确定魔芋粉添加量不变时,随着蛋白胨添加量的增加,酶活力出现了先增大后减小的趋势。同样,固定蛋白胨的添加量,随着魔芋粉添加量的增加,酶活力业出现先增大后逐渐降低的趋势。图2为蛋白胨添加量为10.26 g/L条件下,魔芋粉和MgSO4添加量的交互影响。当确定其中一个因素的添加量不变时,随着另一因素添加量的增加,酶活力出现了先增大后减小的趋势。上述两图的响应面图呈钟罩型,说明两者的交互作用比较显著,与表9的结果一致(P值小于0.05)。
2.5 最佳发酵条件的预测与验证
通过Design Expert软件对经手动优化后的回归方程求解,在试验的因素水平范围内预测菌株产β-甘露聚糖酶发酵的最佳条件为:魔芋粉添加量26.51 g/L,蛋白胨添加量10.27 g/L,MgSO4添加量3.77 g/L,由于实验操作的可行性,将发酵的最佳条件修正为魔芋粉26 g/L,蛋白胨10 g/L,MgSO43.8 g/L,(其他条件:NaCl 10 g/L,KCl 6 g/L,NaNO36 g/L,K2HPO43 g/L,接液量6%)。在此条件下进行3次验证实验,测得甘露聚糖酶酶活力为233.86 U/mL,与理论预测值231.475 U/mL的相对误差很小,说明经手动优化后的回归方程对Bacillus sp.QYW-1产β-甘露聚糖酶进行的分析和预测非常可靠。
3 结论
对菌株进行16S rRNA基因序列测序结果显示与 Bacillus amyloliquefaciens strain CICC 23753、Bacillus subtilis isolate WL-3、Bacillus subtilis strain K-C-6 等同源性较高,同源性达99%,可判断该菌株为芽孢杆菌属。利用PB实验筛选获得影响该菌株产β-甘露聚糖酶产酶活力的重要因素为魔芋粉、蛋白胨、Mg-SO4。根据最陡爬坡实验和Box-Behnken实验结果得到的回归方程,并根据实际操作可行性优化得到最佳产酶培养基组成为:魔芋粉26 g/L,蛋白胨10 g/L,MgSO43.8 g/L,NaCl 10 g/L,KCl 6 g/L,NaNO36 g/L,K2HPO43 g/L,接液量6%。在此条件下进行3次验证试验,实验结果与理论预测值高度吻合,相对误差很小,β-甘露聚糖酶产酶活力由单因素优化结果的115.62 U/mL提高到233.86 U/mL,提高了102%,是野生菌株的最初酶活21.85 U/mL的10.7倍。
[1] Filho EXF.Hemicellulases and biotechnology.In:Pandalai SG(ed)Recent research developments in microbiology[M].Research Signpost,Trivandrum,1998:165-176.
[2] Petkowicz CLO,Reicher F,Chanzy H,et al.Linear mannan in the endosperm of Schizolobium amazonicum[J].Caebohydr Polym,2001,44:107-112.
[3] 邬敏辰.微生物β-甘露聚糖酶的生产与应用[J].中国商办工业,2001(5):46-47.
[4] Akino T,Nakamura N,Horikoshi K.Characterization of three β-mannanase of an alkaliphilic Bacillus sp.[J].Agri Biol Chem,1988,52(3):773-779.
[5] 马骏双,姚婷婷,石贵阳,等.嗜热芽孢杆菌 2004产 β-甘露聚糖酶产酶条件优化和酶学性质[J].食品与生物技术学报,2006,25(3):25-32.
[6] 张清霞,周洪友,唐文华.芽孢杆菌 N26的鉴定及其产β-甘露聚糖酶最适条件的研究[J].中国农业大学学报,2006,11(3):36-40.
[7] Plackett R L,Burman J P.The design of optimum multifactorial experiments[J].Biometrika,1946,33:858-869.
[8] Ghose TK.Measurement of cellulose activities[J].Pure and Applied Chemistry,1987,59(2):257-268
[9] 陈魁.实验设计与分析[M].北京:清华大学出版社,1996:94-180.
