PCDHα在髓鞘形成和少突胶质细胞发育中的作用
2012-12-25于钰,索伦,吴强
于 钰,索 伦, 吴 强
(上海交通大学 系统生物医学研究院, 上海 200240)
PCDHα在髓鞘形成和少突胶质细胞发育中的作用
于 钰,索 伦, 吴 强*
(上海交通大学 系统生物医学研究院, 上海 200240)
该文通过免疫组化及蛋白免疫印迹的方法分别对Pcdhα基因敲除和对照组小鼠的中枢神经系统内的髓鞘碱性蛋白表达以及少突胶质细胞的发育进行了测定。结果表明:1)Pcdhα基因缺失小鼠中枢神经系统中的髓鞘碱性蛋白较对照组小鼠明显减少;2)Pcdhα基因敲除可导致少突胶质细胞发育异常:在小脑中, 处于成熟期的少突胶质细胞减少, 而处于前体细胞阶段的少突胶质细胞增多。上述结果提示 Pcdhα可以通过调控少突胶质细胞的成熟过程进而影响髓鞘的形成。
原钙黏蛋白;髓鞘;少突胶质细胞;发育
Pcdh是广泛分布于中枢神经系统的一类跨膜蛋白, 根据基因结构分为非成簇原钙黏蛋白(Nonclustered Pcdh)和成簇原钙黏蛋白(Clustered Pcdh)。成簇Pcdh基因包含三个串联的基因簇——Pcdhα、β和γ。其中Pcdhα和Pcdhγ分别由14和 22个可变区及各自共同的恒定区组成, 并通过基因的可变剪接编码36种Pcdh分子, 而Pcdhβ则由 22个可变区进行单独编码(Wu & Maniatis,1999)。多样性的Pcdh分子通过同嗜或异嗜结合的方式特异性地表达于神经元的细胞膜上, 并影响神经细胞间的特异性链接(Weiner et al. 2005;Schreiner & Weiner, 2010; Takeichi, 2007)。Pcdh 分子还可以通过其胞内结构域与其它胞内蛋白相互作用,进而影响神经细胞的存活(Emond & Jontes, 2008;Fernández-Monreal et al, 2009, Han et al, 2010)。
本课题组在前期的研究中对神经元跨膜蛋白原钙黏蛋白(Pcdhα)敲除小鼠的行为学观察发现,该小鼠表现出典型的焦虑及强迫性抓挠行为, 致使头颈部皮肤脱毛, 出现严重的非病理性皮肤损伤。进一步分析发现, 该基因广泛分布于神经元的胞体及树突膜上并可以明显引起海马神经元树突发育异常和树突棘减少, 最终严重阻碍了小鼠正常的神经传导通路(Preparation for publication)。脱髓鞘疾病多发性硬化症和脑白质营养不良困扰人类很多年, 目前科学家还未发现能够彻底治愈低髓鞘化疾病有效的方法。有研究表明, 在人类中幼儿时出现的中枢神经系统低髓鞘化伴随有Pcdhα突变(Shimojima et al, 2011)。然而,Pcdhα基因敲除小鼠是否影响髓鞘的形成, 以及该基因是通过何种途径来调控髓鞘的发育目前还尚不清楚。
为此, 本研究以Pcdhα基因敲除小鼠为研究对象,通过免疫组化及蛋白生化分析的方法对Pcdhα基因敲除对小鼠髓鞘形成及与之密切相关的少突胶质细胞的发育的影响进行研究。
1 材料和方法
1.1 实验材料
Pcdhα基因敲除小鼠(Cre-Loxp系统敲除制备,Cre表达小鼠品系为C57BL6, 由本实验室提供, 遗传背景为C57BL6)。所有动物饲养于室温 (22士1)℃,自由摄食与饮水, 12h光照/12h黑暗期饲养。所有的实验都在遵循国家实验动物指南的基础上进行。
一抗:Rat anti-Myelin Basic protein(Millipore),Rabbit Anti-NG2 chondroitin sulfate proteoglycan(Millipore), Mouse anti-O4(Millipore), Mouse GFAP antibody(Millipore), Mouse NF200 antibody (Millipore),Rabbit Tau antibody(Millipore), Rabbit polyclonal to βactin(Millipore)。
二抗:Donkey anti-mouse IgG Dylight 488(Jackson immuno Research), Goat anti-rat IgG-FITC(Invitrogen), IRDye 800 Goat Anti-Rat IgG(LI-COR Bioscience), IRDye 680 Goat Anti-Rabbit IgG(LI-COR Bioscience), IRDye 800 Goat Anti-Mouse IgG(LI-COR Bioscience)。
1.2 基因型鉴定
鼠尾基因组DNA的PCR检测:1) 按照常规方法进行鼠尾基因组DNA的提取; 2) 采用如下引物及PCR程序进行基因型鉴定:ConF1: AGGCT GAATAACGTGCACAGCTAAG; GFPmutF: CCCCC TGAACCTGAAACATAAAATG; ConR1: GCAGAT TGGTTCAATGGAGTCTTT。PCR反应条件为:94 ℃2 min; 94 ℃ 30 s, 59.5 ℃ 30 s, 72 ℃ 30 s, 35 个循环; 72 ℃ 3 min。1.5%的琼脂糖凝胶电泳观察结果。
1.3 免疫组化
分别取10、21日龄Pcdhα基因敲除小鼠和对照组小鼠各6只麻醉后,经4%多聚甲醛灌注后完整取出小鼠脑组织置于 4%多聚甲醛溶液中 4℃固定过夜, 再分别经15%和30%蔗糖溶液脱水处理至沉入瓶底后进行常规 OCT包埋及冰冻切片。根据小鼠大脑图谱(Paxinos & Franklin, 2001),小鼠脑组织径向连续切片(厚 30 μm)贴于载玻片上。免疫组织化学染色按照试剂盒进行, 一抗(rat anti-myelin basic protein 1:500, rabbit anti-NG2 1:200, mouse anti-O4 1:50)孵育4 ℃过夜, 经PBS充分漂洗后加入对应二抗(goat anti rat FITC, 1:20, goat anti rabbit Alex488, 1:1 000, goat anti mouse Alex488,1:1 000)室温下孵育1 h, DAPI溶液封片后在ZEISS荧光显微镜下进行图片采集。采集图片在Axiovision Rel7.0软件中进行图像分析。
1.4 Western blotting
分别取10、21日龄Pcdhα基因敲除小鼠与对照组小鼠脱颈处死, 在显微镜下快速将小脑, 脑干和大脑迅速分离后电子天平称重, 按照每20 mg组织加入 100~200 μL裂解液的比例加入裂解液(50 mmol/L Tris-HCl pH 7.5, 150 mmol/L NaCl, 1%TritonX-100, 0.5% 脱氧胆酸钠, 0.1%SDS, protease inhibitors cocktail)。组织破碎 5 min, 充分裂解后,14 000g离心3~5 min后取上清, 样品进行BCA法进行蛋白定量后加入等体积的2×SDS-PAGE蛋白上样缓冲液, 95℃水浴加热 3~5 min, 进行SDS-PAGE电泳, 转膜处理。转膜后NC膜用5%脱脂奶室温封闭 1 h后在一抗中 4 ℃孵育过夜, 用TBST清洗5 min×3次, 室温孵育荧光二抗1 h, 用TBST清洗5 min×3次, 最后用Odyssey红外双色激光成像系统扫描。
2 结 果
2.1 Pcdhα基因敲除对髓鞘形成的影响
中枢神经系统髓鞘由70%脂质和30%蛋白质构成,其中髓鞘碱性蛋白(Myelin basic protein, MBP)占蛋白部分的1/3,它不但是髓鞘的主要组成部分,还能起到稳定微管结构的作用。因此,MBP的测定是中枢神经系统中有无髓鞘缺失的重要的指标。在正常小鼠中枢神经系统中,该蛋白在出生时主要在脑干处有少量表达,MBP表达量最高峰发生在小鼠出生21 d。此时,该蛋白不仅广泛分布于小脑叶中,在大脑的胼胝体中也高度表达。由于可变剪切的作用MBP蛋白形成4个亚型。实验取同一窝出生的小鼠,通过PCR鉴定基因型,Pcdhα基因敲除杂合小鼠作对照组,Pcdhα基因敲除纯合小鼠为实验组(图1)。
本研究免疫组化染色结果表明:21日龄Pcdhα基因敲除纯合小鼠髓鞘在脑干处的差异不明显,但在小脑和大脑中髓鞘的形成呈现延迟的状况(图2),在轴突束最为集中的胼胝体尤其显著(图2G, J)。

图1 基因型鉴定结果Fig. 1 Genotyping results
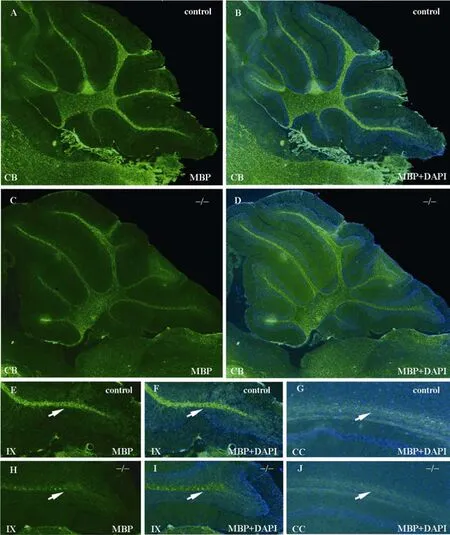
图2 21日龄纯合小鼠与对照组小鼠中枢神经系统白质的髓鞘化的不同(10×)Fig. 2 Myelination differences on white matter of CNS between control and Pcdhα-/- mice(10×magnification)
为了进一步验证上述结果,本研究对 21日龄小鼠的大脑、小脑和脑干分别采集后进行免疫印迹分析,结果显示:MBP 4种亚型的蛋白量都出现不同程度地减少,尤其是在小脑和大脑中比较显著(图3), 验证了免疫组化的结果。所以,我们得出结论:Pcdhα敲除确实导致了小鼠髓鞘的形成缺陷。
2.2 Pcdhα基因敲除对少突胶质细胞发育的影响
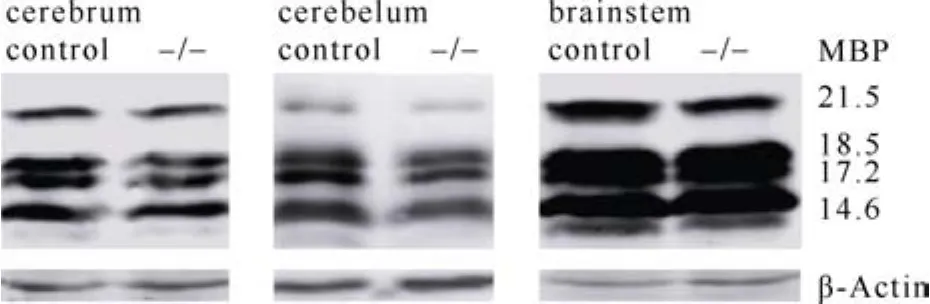
图3 21日龄Pcdhα-基因敲除纯合小鼠和对照组小鼠在中枢神经系统中MBP的表达量差别Fig. 3 Difference in myelination revealed by MBP expression between control mice and Pcdhα-/- mice 21 day after birth
在哺乳动物中枢神经系统中,髓鞘主要由成熟少突胶质细胞将细胞膜围绕轴突多次螺旋缠绕压缩形成。少突胶质细胞经过多潜能神经干细胞期、少突胶质细胞祖细胞期、少突胶质细胞前体细胞期和未成熟的少突胶质细胞期,最终发育成为成熟的少突胶质细胞,成熟的少突胶质细胞可以发射出很多突起,分别包埋轴突,形成髓鞘 (Baumann &Pham-Dinh, 2001)。少突胶质细胞在发育不同阶段特异性的表达不同蛋白,而整个少突胶质细胞的发育又是伴随着一些蛋白的消失和另外一些标记蛋白的产生。其中NG2(CPSG4)是一类硫酸软骨素蛋白多糖,主要在少突胶质前体细胞中表达,而在成熟的少突胶质细胞中消失。少突胶质细胞开始成熟时,能够大量合成硫脂和糖脂,从而可以被O4的抗体所识别。所以,可以分别用NG2和O4标记少突胶质前体细胞和成熟的少突胶质细胞。再次利用Pcdhα敲除的小鼠去探索少突胶质细胞的发育,结果显示与对照组相比,Pcdhα敲除小鼠小脑中少突胶质前体细胞(NG2+细胞)显著增加(图4A, B)。相反,成熟少突胶质细胞(O4+细胞)则明显减少(图 4C,D)。此外,Western blotting结果同样表明,Pcdhα敲除小鼠小脑中少突胶质前体细胞显著增加(图 4E)。
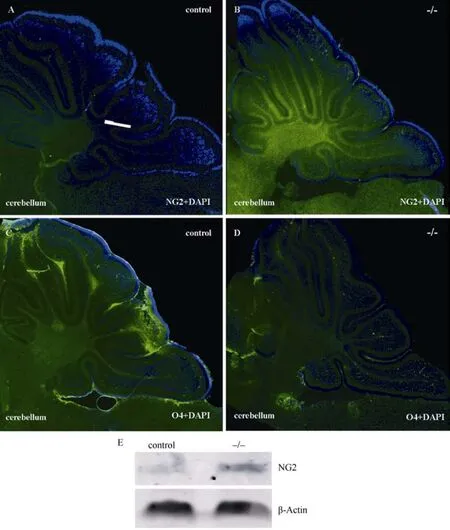
图4 10日龄Pcdhα基因敲除纯合小鼠与对照组小鼠在小脑处NG2着色和O4着色的细胞数目上呈现出不同的现象(10×)Fig. 4 Different phenotype of NG2 and O4 cell number in the cerebellum of Pcdhα-/- and control mice 10 days after birth (10×magnification)
2.3 Pcdhα基因敲除引起的与髓鞘相关水平的变化
星形胶质细胞对于髓鞘外部环境的维护起到重要作用(Ishibashi et al, 2006)。此外,髓鞘形成的延迟或脱髓鞘化小鼠中枢神经系统内经常伴随着轴突的损伤、变性或消失(Fancy et al, 2011)。本课题组采集 21日龄小鼠大脑进行蛋白免疫印迹,结果显示,Pcdhα基因敲除对星形胶质细胞标记蛋白(GFAP)以及轴突标记蛋白(NF200和Tau)均无显著影响(图5)。
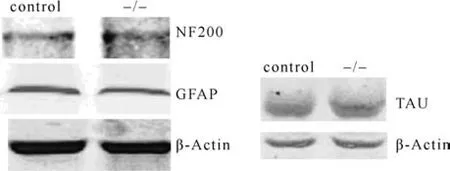
图5 Pcdhα基因敲除对小鼠大脑星形胶质细胞和轴突的影响Fig. 5 Effect of Pcdhα gene knockout on axonal and astrocyte protein markers in the mouse cerebrum
3 讨 论
Pcdhα基因敲除小鼠中枢神经系统中存在普遍的低髓鞘化现象,与此同时也伴随着大量少突胶质细胞前体细胞的聚集,但成熟的少突胶质细胞数目却有减少的趋势。由于只有成熟的少突胶质细胞才具有形成髓鞘的潜能,大量存在的少突胶质细胞前体有可能导致了小鼠的低髓鞘现象。我们的结论是Pcdhα的确在少突胶质细胞前体到成熟的少突胶质细胞的这个阶段中起作用。同时,本研究结果显示,在个体成熟的基因敲除小鼠中,轴突没有因为低髓鞘化而出现变性,消失或损伤的表型。这可能是由于在成年Pcdhα基因敲除小鼠体内存在某种能使轴突再髓鞘化的信号,从而吸引更多的少突胶质细胞前体能够再次聚集到低髓鞘化的轴突上。然而,由于Pcdhα基因的缺失,这些前体细胞无法发育成具有形成髓鞘功能的少突胶质细胞。所以,本项研究为将来基因治疗人类脱髓鞘疾病提供了依据。
致谢:感谢上海交通大学系统生物医学研究院李伟老师在实验上的帮助, 感谢鲁慧囡、陆宇嘉同学在实验技术上给予的建议。
Baumann N, Pham-Dinh D. 2001. Biology of oligodendrocyte and myelin in the mammalian central nervous system [J].Physiol Rev,81(2):871-927.
Emond MR, Jontes JD. 2008. Inhibition of protocadherin-α function results in neuronal death in the developing zebrafish [J].Dev Biol,321(1):175-187.
Fancy SPJ, Chan JR, Baranzini SE, Franklin RJM, Rowitch DH. 2011.Myelin regeneration: a recapitulation of development? [J].Annu Rev Neurosci,34: 21-43.
Fernández-Monreal M, Kang S, Phillips GR. 2009. Gamma-protocadherin homophilic interaction and intracellular trafficking is controlled by the cytoplasmic domain in neurons [J].Mol Cell Neurosci,40(3): 344-353.
Han MH, Lin C, Meng SX, Wang XZ. 2010. Proteomics analysis reveals overlapping functions of clustered protocadherins [J].Mol Cell Proteomics,9(1): 71-83.
Ishibashi T, Dakin K A, Stevens B, Lee P R, Kozlov S V, Stewart C L,Fields R D. 2006. Astrocytes promote myelination in response to electrical impulses [J].Neuron,49(6): 823-832.Paxinos G, Franklin K B J. 2001. The Mouse Brain in Stereotaxic Coordinates [M]. 2nd ed. New York: Academic Press: 101-112.
Schreiner D, Weiner JA. 2010. Combinatorial homophilic interaction between γ-protocadherin multimers greatly expands the molecular diversity of cell adhesion [J].Proc Natl Acad Sci USA,107(33):14893-14898.
Shimojima K, Isidor B, Le Caignec C, Kondo A, Sakata S, Ohno K,Yamamoto T. 2011. A new microdeletion syndrome of 5q31.3 characterized by severe developmental delays, distinctive facial features, and delayed myelination [J].Am J Med Genet A,155A(4):732-736.
Takeichi M. 2007. The cadherin superfamily in neuronal connections and interactions [J].Nat Rev Neurosci,8(1): 11-20.
Weiner JA, Wang XZ, Tapia JC, Sanes JR. 2005. Gamma protocadherins are required for synaptic development in the spinal cord [J].Proc Natl Acad Sci USA,102(1): 8-14.
Wu Q, Maniatis T. 1999. A striking organization of a large family of human neural cadherin-like cell adhesion genes [J].Cell,97(6): 779-790.
Protocadherin α gene cluster is required for myelination and oligodendrocyte development
YU Yu, SUO Lun, WU Qiang*
(Shanghai Center for Systems Biomedicine,Shanghai Jiao Tong University,Shanghai200240,China)
This work used Immunohistochemistry to examine the expression of myelin basic protein and accumulation of oligodendrocytes inPchdαknockout and control littermate mice. Data showed that inPchdαknockout mice, Myelin proteins decrease in the central nervous system and mature oligodendrocytes in the cerebellum also decrease. Furthermore, deletion of the Pcdhα cluster does not cause any change to the axons and astrocytes in quantification of relative marker proteins. These findings suggest that the Pcdhα cluster may be required for myelination and oligodendrite development of the brain in mice, and that Pcdhα cluster may play a key role in the development of the central nervous system.
Protocadherin; Myelin; Oligodendrocyte; Development
Q952.5; Q42
A
0254-5853-(2012)04-0362-05
10.3724/SP.J.1141.2012.04362
2012-04-20;接受日期:2012-07-06
国家自然科学基金资助项目(31171015)
∗通信作者(Corresponding author),E-mail: qwu123@gmail.com
于钰(1985—), 女, 硕士研究生, 研究方向为生物化学与分子生物学, E-mail: sduyuyu@yahoo.com.cn
