Tssk1和Tssk2的克隆、表达及其在成熟精子中的分布与亚细胞定位
2012-12-25杨明华苏金珠李亚辉
杨明华, 苏金珠, 刘 军, 李亚辉,2,*
(1. 云南农业大学 动物科学技术学院, 昆明 650201; 2. 云南农业大学 食品科学技术学院, 昆明 650201)
Tssk1和Tssk2的克隆、表达及其在成熟精子中的分布与亚细胞定位
杨明华1,#, 苏金珠1,#, 刘 军1, 李亚辉1,2,*
(1. 云南农业大学 动物科学技术学院, 昆明 650201; 2. 云南农业大学 食品科学技术学院, 昆明 650201)
睾丸特异性丝氨酸/苏氨酸蛋白激酶(Testis-Specific Serine/Threonine Kinases, TSSKs)可能在精子发生和(或)精子功能调节中起着重要作用, 该文研究克隆并表达了小鼠Tssk1和Tssk2基因, 纯化得到了Tssk1和Tssk2蛋白激酶, 经Western blotting分析, Tssk1和Tssk2皆存在于小鼠和人的成熟精子中。免疫组化的结果显示,Tssk1分布于小鼠的头部(顶体)及整个尾部, Tssk2主要分布在小鼠精子头部顶体后的区域; 获能前后的小鼠精子其Tssk1及Tssk2分布模式未发生改变, 小鼠Tssk2在诱发顶体反应前后精子中的分布模式也无变化。然而, 原来存在于顶体的Tssk1在诱发顶体反应后由于顶体的丢失而未能检出其信号, 但尾部的信号不受影响。在人精子中, Tssk1分布区域为颈部及尾部, Tssk2则分布于赤道板的位置。研究结果提示,Tssk1和Tssk2可能对精子功能具有重要调节作用。
Tssk蛋白激酶; 睾丸特异性; 精子功能; 磷酸化
精子发生(spermatogenesis)是精原细胞在睾丸中经过一系列的增殖、分化变形, 最终形成功能性精子的过程。精子发生是一个复杂而有规律的细胞分化过程, 但在所有哺乳动物中, 精子发生的过程基本一致, 都可分为这样 3个时期:有丝分裂期(spermatocytogenesis)、减数分裂期(spermatidogenesis)和精子形成期(spermiogenesis)。其中, 精子形成期是精子细胞的分化变态过程, 是精子分化的重要环节(Yang et al, 2005)。其间, 圆形的精子细胞(spermatids)发生剧烈的形态变化, 包括细胞伸长、细胞核的浓缩变长、顶体的形成、染色质的浓缩重组、核蛋白的转型、鞭毛、轴丝的发生及尾的成形分化等。这些显著变化是由精子形成期所进行的基因转录(Hecht,1988)和蛋白质翻译(Hake et al, 1990)来调控的,有些在精子细胞中翻译合成的蛋白质会一直保留至成熟精子中。由于后者是高度分化的特异细胞, 其染色质高度浓缩, 既不进行基因转录,也不能进行蛋白质的翻译合成, 细胞活动的调控几乎都是通过蛋白质翻译后修饰的方式进行。蛋白质的磷酸化和去磷酸化是蛋白质翻译后修饰及其活性与功能调节的重要方式之一, 已表明蛋白质的磷酸化和去磷酸化作用在精子细胞的分化变态中起着不可缺少的作用, 有多种蛋白激酶参与精子发生的调节(Sassone-Corsi, 1997)。但是, 仅有少数几种蛋白激酶特异表达于雄性生殖细胞或睾丸中(Johnson, 2009; Nayak et al, 1998; Shalom & Don,1999; Toshima et al, 1998, 1999; Tseng et al, 1998;Walden & Cowan, 1993)。睾丸特异性丝氨酸/苏氨酸蛋白激酶(Testis-Specific Serine/Threonine Kinases,TSSKs)即是这类蛋白激酶中的一个主要类群。Bielke et al (1994)发现首个TSSKs家族成员——小鼠Tssk1, 它是通过简并寡核苷酸引物PCR分离出的一种编码新的丝/苏氨酸蛋白激酶的 cDNA片段,其表达产物能专一地识别睾丸中的两个转录本(1.6 kb和1.4 kb)。随后, Kueng et al (1997)以Tssk1基因为探针, 经非严格杂交克隆并描述了小鼠Tssk2基因的分子特征, 并在此基础上通过酵母双杂交系统识别出小鼠 Tssk1和 Tssk2的一个作用底物——TSKS。Zuercher et al (2000)及 Visconti et al (2001)采用类似的PCR方法分别克隆出小鼠和人的Tssk3基因。Hao et al (2004)利用 PCR技术扩增出人的Tssk1-Tssk3以及Tssk1和Tssk2的作用底物TSKS,并且, 他们及其他研究人员(Spiridonov et al, 2005;Zuercher et al, 2000)通过对人和小鼠基因组的BLAST搜索发现了Tssk4和Tssk6。到目前为止, 已鉴定和克隆了 TSSKs家族的 5个成员(即 Tssk1、Tssk2、Tssk3、Tssk4 和 Tssk6), 随后进行的 Northern blotting的研究结果显示,TSSKs家族成员仅在睾丸中表达(Chen et al, 2005; Hao et al, 2004; Visconti et al, 2001; Zuercher et al, 2000)。但是, 有报道表明,定量RT-PCR的结果显示Tssk1和Tssk2除了在睾丸中丰富表达外, 在其他组织中也有少量表达, 至于这种低水平的表达是否具有明显的生理学意义却不得而知(Spiridonov et al, 2005)。而所有TSSKs家族成员的 mRNA在睾丸中的表达量均高于其他组织, 并且小鼠TSSKs的转录物在出生后24 d的表达量与其在成年小鼠睾丸中的表达量相同, 这说明各TSSKs家族成员在小鼠睾丸中的mRNA都是在减数分裂后表达的(Li et al, 2011)。另外, Kueng et al(1997)利用酵母双杂交系统从小鼠睾丸 cDNA文库中筛选到一个能与Tssk1和Tssk2相互作用的蛋白质——TSKS, 该蛋白(相对分子质量约为 6.5×104)也专一表达于睾丸组织并可被Tssk1和Tssk2磷酸化。Visconti et al( 2001)用同样的方法发现Tssk3在人的睾丸中特异表达。Zuercher et al(2000)的研究表明,Tssk3表达于睾丸间质细胞, 但在附睾或精子中却不表达, 经Western blotting检测, Tssk3蛋白的表达也与其基因的表达模式一致。TSSKs这种高度的组织和时间表达特异性提示它们可能在精子发生和(或)精子功能调节中起关键作用(Bielke et al,1994; Hao et al, 2004; Kueng et al, 1997; Nayak et al,1998; Spiridonov et al, 2005; Visconti et al, 2001)。的确, 初步的研究结果表明TSSK成员在正常精子的发生过程和受精中起关键作用。例如, 敲除Tssk6基因后, 雄性小鼠可产生形态上大体正常的精子,但精子不具备正常的受精功能(Spiridonov et al,2005); 敲除Tssk1和Tssk2基因同样导致雄性不育,并表现为精子形态发生异常, 如不能形成长形精子细胞, 以及精子细胞中线粒体鞘严重受损等(Shang et al, 2007, 2010; Xu et al, 2008a, 2008b); 临床上Tssks基因某些位点的单核苷酸突变也可能与男性不育症相关(Su et al, 2008; Zhang et al, 2010)。尽管如此, 有关 Tssks在成熟精子中的存在及其定位的研究鲜有报道, 而通过免疫组化法检测精子执行不同功能(未获能、获能、顶体反应)时Tssks亚细胞定位的研究目前尚未见报道。本研究结果显示,Tssk1和 Tssk2均表达于成熟的小鼠精子和人精子中, 但两者的表达部位不管在何物种都有明显不同, 这是否暗示着它们在精子功能调节中具有不同的功能。本研究结果为进一步开展Tssks对精子功能的调节机制奠定了基础。
1 材料与方法
1.1 实验材料
7~8周龄的雄性ICR小鼠用于本实验, 它们均来自中国科学院昆明动物研究所实验动物中心。除特殊说明外, 所用的化学试剂均购自Sigma公司(St.Louis, MO, USA)。用于Western blotting 的聚丙烯酰胺(30%)为索莱宝公司产品, 蛋白质相对分子质量marker 为碧云天公司产品, X光片为柯达公司产品; PVDF膜购自Millipore公司, 显影粉和定影粉购自天津世纪奥博商贸有限公司, GST标签重组人Tssk1和Tssk2蛋白购自Abnova公司, 小鼠单克隆抗 Tssk1抗体(clone 4F12)和抗 Tssk2抗体(clone 1E12)购自 Abnova(台湾)公司, Alexa-Fluor-555 二抗(羊抗鼠)、Alexa-Fluor-488 PNA、DAPI 均购自Invitrogen公司, HRP-抗鼠IgG抗体购自Abcam公司, 引物合成及 DNA测序在上海生工生物工程公司进行。
1.2 小鼠Tssk1 和Tssk2的克隆
1.2.1 小鼠睾丸总 RNA的抽提和 cDNA的合成总RNA的抽提采用TINGEN 公司的Trizol 试剂,将小鼠睾丸放入加有液氮的研钵中, 不断研磨使成粉末, 待液氮挥发完以后, 按 50~100 mg组织/mL Trizol 加入Trizol, 室温放置10 min, 使其充分裂解,12 000 r/min 离心 5 min, 弃沉淀; 按 200 µL 氯仿/mL Trizol加入氯仿, 振荡混匀后室温放置15 min,4℃, 12 000g离心15 min, 取上层水相于一新离心管中, 按0.5 mL异丙醇/mL Trizol加入异丙醇混匀,室温放置5~10 min, 4℃, 12 000g离心10 min, 弃上清, 回收沉于管底的RNA, 按1 mL 75%乙醇/mL Trizol加入 75%乙醇, 温和振荡离心管, 悬浮沉淀,4 ℃, 8 000g离心5 min, 弃上清, 室温晾干或真空干燥5~10 min。用无RNase 的灭菌水溶解沉淀, 取少许用1 %琼脂糖凝胶电泳检测RNA的完整性, 其余的置于-80℃保存备用。
1 g 总RNA 用于cDNA 第一链的合成,合成步骤按Reverse Transcription System 反转录试剂盒说明书进行,试剂盒购自TINGEN公司。所用引物系根据NCBI上NM_009435(Tssk1)和 NM_009436(Tssk2)的序列分别自行设计的Tssk1和Tssk2特异引物(Tssk1:Sense:5'-ATGTCTGGCAGGGATGTA G-3'Antisense:5'-GCTTCTTTAGCCGTGTGAG-3';Tssk2:Sense:5'-TGGGAATGAGGACAATGC-3',Antisense:5'-CTGCACACCACGATACCC-3')。RTPCR程序为:94 ℃预变性3 min; 94 ℃变性30 s, 55℃复性30 s, 72 ℃延伸90 s, 共进行35 个循环; 72℃ 延伸10 min。反应完毕后取2 μL 进行1% 琼脂糖凝胶电泳分析。
用1%琼脂糖凝胶电泳纯化回收PCR 产物, 进行 TOPO TA 连接与转化, 用蓝白斑法挑选阳性克隆进行 PCR, 委托上海生工生物工程公司进行DNA 序列测定。
1.2.2 小鼠Tssk1和Tssk2的亚克隆及蛋白表达与纯化 亚克隆:将测序完全正确的Tssks菌株培养后提取质粒作为模板, 分别把Tssk1和Tssk2的开放阅读框(ORF) 亚克隆进 PGEX-5X-1表达载体,所用的亚克隆引物分别为Tssk1引物:Sense: 5'-CC GGAATTCATGGATGACGCTGCCGTCC-3'(带EcoRⅠ酶切位点)Antisense:5'-ATTTGCGGCCGCATCT AAGTATGTGTCTCTGAAGG-3'(带 Not I酶切位点);Tssk2引物:Sense:5'-GAATTCATGGACGATGCG GCGGTCCTA-3'(带 EcoRⅠ酶切位点), Antisense:5'-GTCGACTCCTAGGTACTTGCTTTCTCCAC-3'(带Sal I酶切位点)。PCR程序为:94 ℃预变性3 min;94 ℃变性30 sec, 55 ℃复性30 sec, 72 ℃延伸90 s,共进行35 个循环; 72 ℃ 延伸10 min。用1%琼脂糖凝胶电泳纯化回收PCR 产物, 进行TOPO TA 连接与转化, 挑选阳性克隆进行PCR,提取其质粒, 对目的片段及表达载体(pGEX-5X-1)进行酶切, 然后用T4连接酶将其连接(16 ℃连接过夜)。连接产物转化细菌后用蓝白斑筛选, 摇菌后进行菌液 PCR,阳性结果样品, 一部分用于测序(委托上海生工生物工程公司进行), 剩下的用甘油冷冻保存于-80℃冰箱。
蛋白表达与纯化:将测序正确的菌株提取质粒后转化到BL21, 用IPTG诱导Tssks蛋白的表达, 菌液于4 ℃, 3 000g离心10 min, 弃上清。用预冷的1×PBS(pH8.0)重悬菌体(3 mL PBS/50 mL菌液), 4℃, 3 000g离心10 min, 弃上清。加入预冷PBS(含PMSF和 EDTA), 用超声波细胞破碎仪破碎细胞,超声处理3次, 每次30 s。4 ℃, 12 000离心10 min,将上清转移至一新离心管中, 加入预冷PBS后上柱,平衡后用20倍柱床体积的含有PMSF的1xPBS进行清洗。然后用10~15倍柱床体积的谷胱甘肽洗脱液(0.154 g还原型谷胱甘肽溶解于50 mL 50 mmol/L的Tris-HCl, pH8.0)洗脱GST融合蛋白。洗脱4次,分别收集4次洗脱液, 进行Western blotting分析。
1.3 小鼠和人精子的制备
将性成熟的ICR小鼠脱颈处死, 取附睾尾并在其上剪几个开口, 将剪过的附睾置于 Whitten’s 液中, 37 ℃水浴处理10 min让精子游出来, 取少许镜检、计数, 其余精子用做获能、顶体反应、免疫组化、Western blotting等实验。精子获能参照Visconti et al (1995)报道的方法进行, 即:将洗涤后的精子置于成分完全的Whitten’s 液中, 于37 ℃孵育90 min;顶体反应的诱发:洗涤后的精子于37 ℃ Whitten’s液中孵育 60 min 后, 加入 10 µmol/L Ca2+载体A23187 再孵育30 min 即可 。人精液先经液化处理1 h, 然后在37 ℃的mHTF溶液中上游1 h, 离心洗涤后用于免疫组化或Western blotting分析。
1.4 SDS-PAGE和Western blotting分析
在细胞或精子提取物中加入适量的Laemmli缓冲液, 煮沸5 min, 13 000 r/min, 离心5 min。将上清转至新离心管中, -20 ℃或-80 ℃保存备用。电泳前加入5%的β-巯基乙醇煮沸2 min, 在12%分离胶, 5%浓缩胶中进行SDS-PAGE电泳, 每个泳道精子量为1×106~2×106。电泳结束后, 将蛋白转印至PVDF膜上, 用含5%脱脂乳的T-TBS室温下封闭1 h (Jha et al, 2006), 分别与一抗、二抗孵育后用ECL显色。
1.5 小鼠和人精子免疫荧光染色
小鼠或人精子经处理、洗涤后将其加于载玻片上的小孔中, 晾干后用 3.7%的甲醛于室温下固定20 min, 用含有0.1%Tween20的PBS洗3次, 每次5 min。 用含0.5%Triton X-100的PBS透膜5 min(室温)。用含有0.1%Tween20的PBS洗 3次, 每次5 min。
用封闭液(含有10%BSA的PBS)封闭(室温2 h或在湿盒里4 ℃过夜)。加入相应的一抗(室温下结合2 h, 或在湿盒里4 ℃过夜)。PBS洗3次, 每次10 min。加入二抗及PNA和DAPI, 室温孵育至少2 h。PBS洗10次, 每次2 min。去除多余液体后封片,放4 ℃避光过夜。次日镜检, 拍照。以添加二抗而不添加一抗的精子作为阴性对照组, 检测二抗的假阳性情况。免疫标记的精子用激光共聚焦显微镜进行观察。
2 结 果
2.1 小鼠Tssk1和Tssk2蛋白表达及提取纯化
在成功克隆出小鼠Tssk1和Tssk2的基础上, 本研究建立了小鼠Tssk1和Tssk2蛋白的原核表达体系, 用谷胱甘肽树脂提取纯化了带有GST标签的重组小鼠Tssk1和Tssk2蛋白, 经Western blotting检测, 在第一次和第二次洗脱液中检出相对分子质量为 6.6×104~6.7×104的蛋白分子, 与预期的GST-Tssk1和GST-Tssk2 相对分子质量一致(图1)。

图1 小鼠Tssk1(A)和Tssk2(B)蛋白提取纯化Fig. 1 Purified mouse Tssk1(A) and Tssk2 (B) protein
2.2 小鼠Tssk1和Tssk2蛋白免疫印迹分析
如图2 所示, 抗Tssk1的抗体不但能识别重组小鼠Tssk1蛋白, 而且还能识别重组小鼠Tssk2蛋白,此外, 经Western blotting分析, 在成熟的小鼠精子中有 Tssk1蛋白的存在; 图 2 B 的结果显示, 抗Tssk2的抗体既能识别重组小鼠Tssk2蛋白, 又能识别重组小鼠Tssk1蛋白, 而且, 用抗Tssk2的抗体在成熟小鼠精子中检测到2种蛋白, 其中之一可能是Tssk2蛋白激酶翻译后修饰的一种形式。如图 2 A和 B所示, 抗 Tssks的抗体能同时识别小鼠重组Tssk1和Tssk2, 很可能是由于Tssk1和Tssk2有较高同源性之故。

图2 小鼠Tssk1(A)和Tssk2(B)蛋白免疫印迹分析Fig. 2 Western blotting of mouse Tssk1(A) andTssk2(B)
2.3 人Tssk1和Tssk2蛋白免疫印迹分析
Western blotting的结果显示, Tssk1和Tssk2蛋白分别存在于射出的人精子中(图 3), 而且, 与小鼠的情况不同, 抗 Tssks的抗体只能识别相应的重组人Tssk蛋白(图 3)。像小鼠一样, 用抗 Tssk2的抗体在射出的人精子中检测到2种蛋白(图 3 B)。
2.4 Tssk1和Tssk2在小鼠和人精子中的亚细胞定位
2.4.1 Tssk1和Tssk2在小鼠精子(未获能、获能和顶体反应)中的亚细胞定位 我们用免疫组化方法检测了Tssk1和Tssk2在小鼠未获能、获能及顶体反应精子中的分布与定位, 发现 Tssk1主要分布于小鼠精子的头部(顶体)和整个尾部且在获能前后其分布模式未发生改变, 但原来存在于顶体的 Tssk1在顶体反应后随顶体的丢失而丢失(图 4A)。Tssk2主要分布于小鼠精子头部顶体后区域, 其分布模式在获能前后、顶体反应后均未发生改变(图 4B)。
2.4.2 Tssk1和 Tssk2在人精子中的亚细胞定位经免疫荧光检测, Tssk1分布于人精子颈部及整个尾部(图 5A), Tssk2则分布于人精子赤道板附近(图
5B)。与小鼠精子一样, 人精子中Tssk1和Tssk2 在获能前后、顶体反应后的分布模式也无改变(数据未显示)。
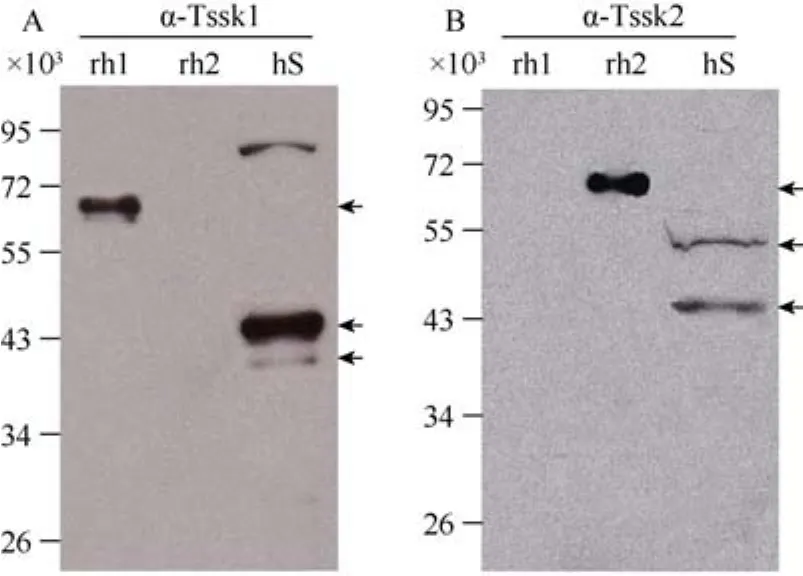
图3 人Tssk1(A)和Tssk2(B)蛋白免疫印迹分析Fig. 3 Western blotting of human Tssk1(A) and Tssk2(B)
3 讨 论

图4 Tssk1(A)和Tssk2(B)在成熟小鼠精子中的亚细胞定位Fig. 4 Subcellular localization of Tssk1 (A) and Tssk2 (B) in mature mouse sperm

图5 Tssk1(A)和Tssk2(B)在成熟人精子中的亚细胞定位Fig. 5 Subcellular localization of Tssk1(A) and Tssk2(B) in mature human sperm
迄今为止, 已鉴定和克隆了TSSKs家族的5个成员,即Tssk1、 Tssk2、 Tssk3、 Tssk4 和Tssk6。Northern blotting 的研究结果显示,TSSKs家族成员仅在睾丸中表达(Visconti et al, 2001; Hao et al,2004; Zuercher et al, 2000; Chen et al, 2005);但是,有报道表明定量 RT-PCR的结果显示,Tssk1和Tssk2除了在睾丸中丰富表达外, 在其他组织中也有少量表达, 至于这种低水平的表达是否具有明显的生理学意义却不得而知(Spiridonov et al, 2005)。而所有TSSKs家族成员的mRNA在睾丸中的表达量均高于其他组织, 并且小鼠TSSKs的转录物在出生后 24 d的表达量与其在成年小鼠睾丸中的表达量相同, 这说明各TSSKs家族成员在小鼠睾丸中的mRNA都是在减数分裂后表达的(Li et al, 2011)。 Li et al (2011)的研究表明,Tssks的mRNA和蛋白在减数分裂后的精子细胞中均有表达, 提示这些蛋白激酶可能参与精子形成的调节过程。Li et al (2011)用多种抗体检测了Tssks在小鼠和人成熟精子中的蛋白表达情况, 除Tssk3外, 其余Tssks蛋白在两个物种的成熟精子中都有表达。本研究中只使用了抗Tssk1及 Tssk2的抗体来检测它们在成熟的小鼠和人精子中的表达, 结果表明,Tssk1和Tssk2都表达于小鼠和人的成熟精子中, 此外, 抗 Tssk1的抗体不但能够识别重组小鼠TSSK1, 而且还能识别重组小鼠的TSSK2, 很可能是两者具有较高的同源性之故, 这与Li et al (2011)的结果一致;但是, Tssk2在小鼠中的情况却与Li et al (2011)的不尽相同, 我们的Western blotting结果显示,抗Tssk2抗体既能识别重组小鼠Tssk2,同时还能识别重组小鼠Tssk1, 而Li et al (2011)的报道中抗Tssk2抗体只能识别重组小鼠的Tssk2。我们用的抗体与Li et al (2011)所用的完全相同, 不同之处仅在于重组 Tssks蛋白的提取纯化方法上, 但这似乎不能解释产生抗体识别差异的原因, 具体原因有待进一步研究。用同样的抗体我们在人精子中检测到有Tssk1和Tssk2 的存在,并且, 与小鼠中的情况不同, 这两种抗体都只识别一种相应的人重组Tssk, 此结果与Li et al (2011)的报道完全一致。
在分析了Tssk1和Tssk2 在成熟精子中表达的基础上, 我们采用免疫组化方法研究了这两种蛋白激酶在精子中的分布与定位, 发现 Tssk1存在于小鼠精子顶体及整个尾部;而Tssk2主要分布于头部顶体后的区域, 研究结果与Li et al (2011)的报道一致。2009年, Sosnik et al (2009)报道小鼠精子上受精所必须的Izumo蛋白分子在顶体反应中会发生迁移,这种迁移是成功受精的先决条件且与Tssk6密切相关, 敲除Tssk6基因的雄性小鼠能产生精子, 但是不能完成正常受精。这说明精子中的一些蛋白分子在受精前的关键环节中会发生动态变化且与受精直接相关, 因此, 我们检测了 Tssk1 和 Tssk2在未获能、获能及顶体反应的小鼠精子中的定位情况, 结果发现它们的分布模式未发生改变;经分析, 人精子中Tssk1和Tssk2的情况也如此(数据未显示)。在射出的人精子中, Tssk1分布于精子的颈部及尾部,Tssk2则分布于赤道板的位置。本研究中Tssk1的分布模式与Li et al (2011)的报道一致, Tssk2在人精子中的定位却与其不同, 而和Hao et al (2004)的报道一致。需要指出的是, 3项研究中用于免疫组化分析的精子其遗传、生殖力背景都不清楚, 因此, 我们认为Tssk2的这种分布模式差异很可能与精子本身的差异有关, 这是否也从另一个侧面说明 Tssk2的亚细胞定位与人精子的内在特性有关。果真如此的话, 我们就可以通过 Tssk2的分布模式来预测精子质量及其受精能力。
通过本研究, 我们证明了Tssk1 和Tssk2存在于成熟的小鼠精子和人精子中, 它们在精子中的分布模式不尽相同, 由于精子是高度分化、区域化明显的特异细胞, Tssks在精子中的不同空间分布图示提示Tssk1和Tssk2可能对精子功能具有重要的调控作用,而且, 它们的调控作用及其机制可能各不相同。本研究结果显示, 小鼠和人精子尾部都有Tssk1的存在, 似乎暗示着它与精子的运动性调控有关; 除在尾部有分布外, Tssk1还分布于小鼠精子的顶体上, 但这是否说明它参与小鼠精子的顶体反应还需要做进一步的研究。与小鼠精子中的情况稍有不同, 在本研究中仅在人精子颈部和尾部检出Tssk1的信号, 而Li et al (2011)则报道像小鼠精子一样, Tssk1存在于人精子的头部(顶体)和尾部。因此, 本研究中观察到不同于小鼠精子的 Tssk1在人精子中的分布模式很可能不是由于物种差异,而是由人精子样本差异所造成的, 至于这种差异意味着什么则有待探明。与Tssk1的分布截然不同, Tssk2分别位于小鼠精子头部顶体后区域和人精子头部赤道板附近, 据Sosnik et al (2009)的报道, 这些区域聚合肌动蛋白较为丰富, 它们与精卵融合与受精直接相关;他们的研究表明,Tssk6基因敲除的雄鼠因其精子中肌动蛋白聚合受阻, 致使精子Izumo蛋白不发生迁移最终导致精卵融合与受精失败。有意思的是, 我们发现在小鼠精子中 Tssk2的分布模式与 Tssk6的分布非常相似。因此, 我们推测, Tssk2很可能也与精子的顶体反应有关, 但这需要进行深入研究来证明, 人精子中 Tssk2的作用是否如此也有待研究。
已有的研究表明,TSSKs在动物(人)精子发生和(或)成熟精子功能发挥中起着重要的调控作用, 而且,Tssks基因敲除的小鼠除生殖力外, 其他表型都不受影响(Spiridonov et al, 2005; Xu et al,2008b), 对这类蛋白激酶的深入研究将有助于理解相关男性不育症的发病机制, 并有望为男性非激素类避孕药物的研发提供新思路。由于蛋白激酶已成为新药研发的重要标靶, 这暗示着可以将TSSKs作为研发非激素类男性避孕药物的标靶, 例如,TSSKs蛋白激酶的特异性抑制剂便是研发男用避孕药物的理想候选物。进一步的工作需要进行TSSKs蛋白空间结构的解析并抓紧寻找、设计TSSKs的抑制剂。
Bielke W, Blaschke RJ, Miescher GC, Zürcher G, Andres AC, Ziemiecki A.1994. Characterization of a novel murine testis-specific serine/threonine kinase [J].Gene,139(2):235-239.
Chen XJ, Lin G, Wei YH, Hexige S, Niu YJ, Liu LL, Yang CY, Yu L. 2005.TSSK5, a novel member of the testis-specific serine/threonine kinase family, phosphorylates CREB atSer-133, and stimulates the CRE/CREB responsive pathway [J].Biochem Biophys Res Commun,333(3): 742-749.
Hake LE, Alcivar AA, Hecht NB. 1990. Changes in mRNA length accompany translational regulation of the somatic and testis-specific cytochrome c genes during spermatogenesis in the mouse [J].Development,110: 249-257.
Hao ZL, Jha KN, Kim YH, Vemuganti S, Westbrook VA, Chertihin O,Markgraf K,Flickinger CJ, Coppola M, Herr JC, Visconti PE. 2004.Expression analysis of the human testis-specific serine/threonine kinase(TSSK) homologues. A TSSK member is presenting the equatorial segment of human sperm [J].Mol Hum Reprod,10(6): 433-444.
Hecht NB. 1988. Post-meiotic gene expression during spermatogenesis [J].Prog Clin BiolRes,267: 291-313.
Jha KN, Salicioni AM, Arcelay E, Chertihin O, Kumari S, Herr JC and Visconti PE.2006. Evidence for the involvement of proline-directed serine/threonine phosphorylation in sperm capacitation [J].Mol Hum Reprod,12:781-789.
Johnson LN. 2009. The regulation of protein phosphorylation [J].Biochem Soc Trans,37(4):627-641.
Kueng P, Nikolova Z, Djonov V, Hemphill A, Rohrbach V, Boehlen D,Zuercher G, Andres AC, Ziemiecki A. 1997. A novel family of serine/threonine kinases participating in spermiogenesis [J].J Cell Biol,139(7): 1851-1859.
Li YH, Sosnik J, Brassard L, Reese M, Spiridinov NA, Bates TC, Johnson GR, Anguita J, Visconti PE, Salicioni AM. 2011. Expression and localization of five members of the testis-specific serine kinase (Tssk)family in mouse and human sperm and testis [J].Mol Hum Reprod,17(1): 42-56.
Nayak S, Galili N, Buck CA. 1998. Immunohistochemical analysis of the expression of two serine-threonine kinases in the maturing mouse testis[J].Mech Dev,74(1-2): 171-174.
Sassone-Corsi P. 1997. Transcriptional checkpoints determining the fate of male germ cells [J].Cell,88(2): 163-166.
Shalom S, Don J. 1999.Tlk, a novel evolutionarily conserved murine serine threonine kinase, encodes multiple testis transcripts [J].Mol Reprod Dev,52(4): 392-405.
Shang P, Baarends WM, Dooijes D, Elfferich P, Wijgerde M, Ooms MP,Looijenga LH,Dohle GR, Van Eenennaam H, Gossen JA. 2007.Testis-specific serine/threonine kinases encoded by the retrogenes Tssk1 and Tssk2 are essential for spermatogenesis in mouse [C]// ASo A, ed. XIX North American Testis Workshop: "Chromosome Structure and Gene Expression". Tampa: Hyatt Regency, 115.
Shang P, Baarends WM, Hoogerbrugge J, Ooms MP, van Cappellen WA, de Jong AAW, DohleGR, van Eenennaam H, Gossen JA, Grootegoed JA.2010. Functional transformation of the chromatoid body in mouse spermatids requires testis-specific serine/threonine kinases [J].J Cell Sci,123(3): 331-339.
Sosnik J, Miranda PV, Spiridonov NA, Yoon SY, Fissore RA, Johnson GR,Visconti PE. 2009. Tssk6 is required for Izumo relocalization and gamete fusion in the mouse [J].J Cell Sci,122(15): 2741-2749.
Spiridonov NA, Wong L, Zerfas PM, Starost MF, Pack SD, Paweletz CP,Johnson GR. 2005. Identification and characterization of SSTK, a serine/threonine protein kinase essential for male fertility [J].Mol Cell Biol,25(10): 4250-4261.
Su D, Zhang W, Yang Y, Deng Y, Ma YX, Song HX, Zhang SZ. 2008.Mutation Screening and association study of theTSSK4gene in Chinese infertile men with impaired spermatogenesis [J].J Androl,29(4): 374-378.
Toshima J, Koji T, Mizuno K. 1998. Stage-specific expression of testis-specific protein kinase 1 (TESK1) in rat spermatogenic cells [J].Biochem Biophys Res Commun,249(1): 107-112.
Toshima J, Tanaka T, Mizuno K. 1999. Dual specificity protein kinase activity of testis-specific protein kinase 1 and its regulation by autophosphorylation of serine-215 within the activation loop.J Biol Chem,274(17): 12171-12176.
Tseng TC, Chen SH, Hsu YP, Tang TK. 1998. Protein kinase profile of sperm and eggs: cloning and characterization of two novel testis-specific protein kinases (AIE1, AIE2) related to yeast and fly chromosome segregation regulators [J].DNA Cell Biol,17(10):823-833.
Visconti PE, Bailey JL, Moore GD, Pan D, Olds-Clarke P, Kopf GS.1995.Capacitation of mouse spermatozoa. I. Correlation between the capacitation state and protein tyrosine phosphorylation [J].Development,121(4): 1129-1137.
Visconti PE, Hao ZL, Purdon MA, Stein P, Balsara BR, Testa JR, Herr JC,Moss SB, Kopf GS. 2001. Cloning and chromosomal localization of a gene encoding a novel serine/threonine kinase belonging to the subfamily of testis-specific kinases [J].Genomics,77(3): 163-170.
Walden PD, Cowan NJ. 1993. A novel 205-kilodalton testis-specific serine/threonine protein kinase associated with microtubules of the spermatid manchette [J].Mol Cell Biol,13(12): 7625-7635.
Xu BF, Hao ZL, Jha KN, Zhang ZB, Urekar C, Digilio L, Pulido S, Strauss JF III, Flickinger CJ, Herr JC. 2008a. TSKS concentrates in spermatid centrioles during flagellogenesis [J].Dev Biol,319(2): 201-210.
Xu BF, Hao ZL, Jha KN, Zhang ZB, Urekar C, Digilio L, Pulido S, Strauss JF III, Flickinger CJ, Herr JC. 2008b. Targeted deletion of Tssk1 and 2 causes male infertility due to haploinsufficiency [J].Dev Biol,319(2):211-222.
Yang ZM, Sun QY, Xia GL. 2005. Reproductive Biology [M]. Beijing:Science Press. [杨增明, 孙青原, 夏国良. 2005. 生殖生物学[M]. 北京: 科学出版社.]
Zhang H, Su D, Yang Y, Zhang W, Liu YQ, Bai G, Ma MY, Ma YX, Zhang SZ. 2010. Some single-nucleotide polymorphisms of the TSSK2 gene may be associated with human spermatogenesis impairment [J].J Androl,31(4): 388-392.
Zuercher G, Rohrbach V, Andres AC, Ziemiecki A. 2000. A novel member of the testis specific serine kinase family,tssk-3, expressed in the Leydig cells of sexually mature mice [J].Mech Dev,93(1-2): 175-177.
Cloning and expression of Tssk1 & Tssk2 in mice and the presence & localization of them in mature sperm
YANG Ming-Hua1,#, SU Jin-Zhu1,#, LIU Jun1, LI Ya-Hui1,2,*
(1.College of Animal Science & Technology,Yunnan Agricultural University,Kunming650201,China;2.College of Food Science & Technology,Yunnan Agricultural University,Kunming650201,China)
We sought to experimentally verify if testis specific serine/threonine kinases (Tssks) play a role in spermatogenesis and/or the regulation of sperm function. Purified Tssk proteins were obtained based on cloning and expression of mouse Tssk1 and Tssk2. Tssk1 and Tssk2 were detected in mature mouse and human sperm by western blotting. Immunofluorescence indicated that Tssk1 is distributed in the acrosome and the entire flagellum of mouse sperm while Tssk2 was mainly distributed in post-acrosomal region. There was no alteration in the distribution pattern of Tssk1 and Tssk2 in non-capacitated and capacitated sperm. Tssk2 distribution remained unchanged after induced acrosome reaction but no signals were detected in the acrosome for Tssk1, which was present before the acrosome reaction, though signals in flagellum were undisturbed. In human sperm, Tssk1 was found in neck and flagellum while Tssk2 was found in the equatorial region. Our results suggest Tssk1 and/or Tssk2 do play an important role(s) in the regulation of sperm function.
Tssk kinases; Testis-specific; Sperm function; Phosphorylation
Q954.434; Q78;Q555
A
0254-5853-(2012)04-0381-08
10.3724/SP.J.1141.2012.04381
2012-02-01;接受日期:2012-05-15
国家自然科学基金专项基金(31040055)
∗通信作者(Corresponding author),E-mail: liyh85@yahoo.com.cn#共同第一作者(Authors contributed equally to the work)
