海兔素对人乳腺癌SK-BR-3细胞的抑制作用及机制研究
2012-12-22马文龙
马文龙,梁 惠,刘 颖
1陕西省杨凌示范区医院,杨凌712100;2青岛大学医学院,青岛266021
表皮生长因子受体(Epidermal Growth Factor Receptor,EGFR)的自体磷酸化及其对下游Akt和ERK等效应分子的活化作用,在促进肿瘤细胞的生长、增殖和分化过程中发挥重要作用。近年来,寻找阻断EGFR细胞信号传导通路的药物,成为人们进行抗癌药物研究的热点。随着海洋抗肿瘤活性物质的不断开发利用,海藻萜类化合物因其结构独特、生物活性强,日益引起人们的广泛关注[1]。研究表明,很多萜类化合物对乳腺癌、黑色素瘤、结肠癌等多种肿瘤细胞都具有良好的抑制作用[2-4]。三列凹顶藻(Laurencia tristicha)属红藻门(Rhodophyta),红藻纲(Rhodophyceae),仙菜目(Ceramiales),松节藻科(Rhodomelaceae),凹顶藻属(Laurencia),是海洋萜类化合物的重要来源。海兔素(Aplysin)是存在于三列凹顶藻中的一种溴代倍半萜类化合物,本课题组前期从三列凹顶藻中提取纯化了海兔素,并对乳腺癌的抑制作用进行了体内外实验。结果表明,海兔素可明显抑制乳腺癌MCF-7细胞增殖,并显著抑制细胞中VEGF表达;动物实验也表明,海兔素无毒副作用,使用安全,可有效抑制二甲基苯蒽诱导的乳腺癌肿瘤组织中VEGF的表达,且具有量效依赖性[5]。但关于从阻断细胞信号传导通路方面阐述海兔素抑瘤机制的研究较少,国内外也未见相关报道。本实验以海兔素为干预物,观察其对乳腺癌细胞增殖和凋亡的影响,并通过EGFR信号通路,进一步探讨海兔素诱导细胞凋亡的可能机制。
1 材料与方法
1.1 溴代倍半萜海兔素的制备
三列凹顶藻由中国科学院海洋研究所提供并鉴定。由青岛大学医学院医学营养研究所将常温风干的海藻样品(5 kg),用体积分数为0.95的乙醇室温浸泡3 d,提取3次,提取液减压浓缩(温度低于40℃)得乙醇提取物325 g;然后将乙醇提取物悬浮于蒸馏水中,用乙酸乙酯萃取,有机相回收溶剂得萃取物105 g。取乙酸乙酯萃取物,干法上样,进行正相硅胶柱色谱分离,用石油醚丙酮梯度洗脱,薄层色谱检查,合并相同部分。洗脱液经过反复正相硅胶、生物胶Bio-beads、凝胶Sephadex LH-20柱色谱和反相HPLC分离纯化,得到一白色化合物,经 IR、13C-及1H NMR鉴定此化合物为溴代倍半萜海兔素单体(Aplysin),分子式为C15H19OBr,分子量为295。
1.2 细胞株、主要试剂及仪器
人乳腺癌细胞 SK-BR-3,为本实验室所有。DMEM/F12培养液和胎牛血清购自Gibco公司;Cell Counting Kit-8试剂盒购自日本Dojindo公司;Annexin V-FITC Apoptosis Detection Kit I试剂盒购自美国BD Pharmingen公司;蛋白裂解液(PRO-PREPTM Protein Extraction Solution)由韩国 iNtRON Biotechnology公司生产;蛋白检测试剂盒(Bio-Rad Protein Assay)购自美国Bio-Rad公司;羊抗人GAPDH抗体购自美国Santa Cruz公司,二抗购自美国invitrogen公司;EGFR、phospho-EGRF、Akt、phosphor-Akt、ERK、Phospho-ERK兔抗人抗体均购自美国Cell Signaling Technology公司,其相应的二抗均购于美国ZYMED公司;化学发光试剂盒(chemiluminescence detection kit)购自美国Santa Cruz公司;流式细胞仪为Beckman Coulter公司制造;酶标仪为Thermo公司制造;胶片冲洗机(CP1000型)为德国AGFA-Gevaert NV公司制造。
1.3 细胞培养及海兔素贮存液的配制
乳腺癌SK-BR-3细胞用DMEM/F12全培养液(含体积分数为0.1的胎牛血清),于37℃,5%CO2水汽培养箱中常规培养。隔天换液一次,三天传代一次,收集指数生长期细胞进行实验。海兔素以二甲亚砜(DMSO)助溶,使用时用DMEM/F12全培养液稀释至终浓度,所有处理组DMSO终浓度体积分数均为0.001(实验证实该浓度对细胞无明显损害)。
1.4 CCK-8实验检测海兔素对乳腺癌细胞增殖的影响
收集指数生长期细胞,按2×104/孔接种于96孔板。培养24 h后,实验组加入药物终浓度分别为10、20、30、40、45、50、55、60 mg/L的培养液;对照组加入含等体积PBS的培养液,每组设3个复孔。继续培养24 h,吸弃上清,每孔加入100 μL新鲜培养液及10 μL CCK-8溶液,继续培养2 h,于酶标仪450 nm处测定各孔OD值,OD值的大小与细胞活性呈正相关。以SPSS 11.5软件计算IC25和IC50,抑制率=(OD对照组-OD实验组/OD对照组)× 100%。实验重复三次。
1.5 流式细胞术(FCM)检测细胞凋亡情况
指数生长期细胞经 IC25和 IC50剂量海兔素(29.4和33.7 mg/L)处理24 h后,用胰酶常规消化并收集细胞。以预冷的PBS洗涤细胞两次,用1×缓冲液调整细胞密度为1×106/mL,然后吸取100 μL细胞悬液于流式细胞仪专用分析试管中,加入5 μL Annexin V-FITC和5 μL PI溶液,轻轻吹打均匀,置于室温,避光孵育15 min。加入400 μL 1×缓冲液,通过流式细胞仪分析细胞凋亡情况。以正常未染色细胞对仪器进行调试,分别以FITC Annextin V和PI单染细胞进行荧光补偿调节和正常与凋亡细胞象限的界定,数据经WinMDI2.9软件分析,总凋亡细胞百分数等于中晚期凋亡细胞(Annexin VFITC+/PI+)与早期凋亡细胞(Annexin V-FITC+/ PI-)百分数之和。实验重复三次。
1.6 Western blot检测细胞中EGFR、Akt及ERK的总蛋白和磷酸化蛋白相对表达水平
指数生长期细胞经 IC25和 IC50剂量海兔素(29.4和33.7 mg/L)处理24 h后,用胰酶常规消化并收集细胞。以预冷的PBS洗涤细胞两次,每管加入150 μL细胞裂解液和10 μL磷酸酶抑制剂,在冰上裂解30 min,4℃12000 rpm,离心15 min,收集上清液,用蛋白检测试剂盒测定蛋白质浓度。蛋白质样品与上样buffer混合后,沸水中煮沸10 min。每孔上样10 μg,经4%~12%SDS-PAGE分离样品后,将蛋白转至PVDF膜上,以封闭液(5%脱脂奶粉,溶于TBS)室温封闭1 h。将膜与溶于抗体稀释液(5%脱脂奶粉,溶于PBS-T)中的一抗(GAPDH抗体1∶1000、EGFR抗体1∶1000,phospho-EGRF抗体1∶1000、ERK抗体1∶1000、phospho-ERK抗体1∶1000、Akt抗体1∶1000、phosphor-Akt抗体1∶1000)封于塑胶袋中,4℃摇晃孵育过夜。PBS-T洗脱5次,每次5 min,将膜与溶于抗体稀释液的二抗室温孵育1 h,PBS-T洗脱5次,每次5 min。采用化学发光试剂盒,对膜进行暗室曝光后,经胶片冲洗机显影,定影后,结果经扫描后输入计算机,经IMAGE-J软件进行图像分析。实验重复三次。
1.7 统计学分析
采用SPSS 11.5统计软件进行数据统计分析,多组比较采用单因素方差分析,P<0.05被认为有统计学意义。
2 结果
2.1 海兔素对SK-BR-3细胞增殖的影响
CCK-8结果显示,经海兔素处理24 h后,对SKBR-3细胞的增殖具有抑制作用,且呈剂量依赖性。其中,10 mg/L海兔素组与对照组比较,无显著性差异(P>0.05),其余各药物组与对照组比较以及药物组之间比较,均表现出显著性差异(P<0.05)。药物浓度越高,对细胞增殖的抑制作用也越明显,当海兔素剂量达到55 mg/L时,99%以上的细胞已经死亡(Table 1、Fig 1)。以SK-BR-3细胞OD值对药液浓度值作药物量效的线性回归分析显示,两者间存在线性关系,给药浓度与细胞OD值呈负相关(y =-0.04x+2.39,r=0.96,P<0.05,x为药液浓度,y为SK-BR-3细胞的OD值)。计算出海兔素作用SK-BR-3细胞24 h的IC25和IC50值为分别为29.4和33.7 mg/L。
表1 海兔素对SK-BR-3细胞增殖的影响Table 1 The effects of Aplysin on the proliferation of SK-BR-3 cell(n=4,±s)

表1 海兔素对SK-BR-3细胞增殖的影响Table 1 The effects of Aplysin on the proliferation of SK-BR-3 cell(n=4,±s)
注:与对照组比较,*P<0.05;与10 mg/L组比较,▲P<0.05;与20 mg/L组比较,△P<0.05;与30 mg/L组比较,★P<0.05;与40 mg/L组比较,☆P<0.05;与45mg/L组比较,※P<0.05;与50 mg/L组比较,#P<0.05。Note:Compare with control,*P<0.05;Compare with 10 mg/Lgroup,▲P<0.05;Compare with 20 mg/L group,△P<0.05;Compare with 30 mg/ Lgroup,★P<0.05;Compare with 40 mg/L group,☆P<0.05;Compare with 45 mg/L group,※P<0.05;Compare with 50 mg/Lgroup,#P<0.05.
组别Group 剂量Dose(mg/L)吸光度值OD450nm抑制率Inhibition ratio(%) 25%抑制剂量IC25(mg/L) 50%抑制剂量IC50(mg/L) Control - 2.062±0.026 0.00 29.4 33.7海兔素Aplysin 10.00 2.057±0.026 0.24对照组99.17 20.00 1.903±0.072*▲ 7.71 30.00 1.397±0.107*▲△ 32.25 40.00 0.576±0.119*▲△★ 72.06 45.00 0.170±0.015*▲△★☆ 91.75 50.00 0.050±0.018*▲△★☆※ 97.57 55.00 0.017±0.001*▲△★☆※# 99.17 60.00 0.017±0.004*▲△★☆※#
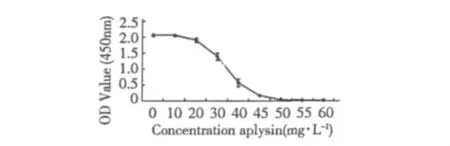
图1 海兔素对SK-BR-3细胞增殖的影响Fig.1 Effects of aplysin on proliferation of SK-BR-3 cells
2.2 海兔素对SK-BR-3细胞凋亡的影响
流式细胞术检测结果显示,SK-BR-3细胞经IC25和IC50剂量的海兔素处理24 h后,可分析得到明显的凋亡细胞(包括早期凋亡细胞和中晚期凋亡细胞),IC25和IC50药物处理组的细胞凋亡率分别是(16.7±1.4)%和(58.3±2.4)%,明显高于正常对照组凋亡率(0±1.2)% ,经统计学处理,有显著性差异(P<0.05),见Fig.2。
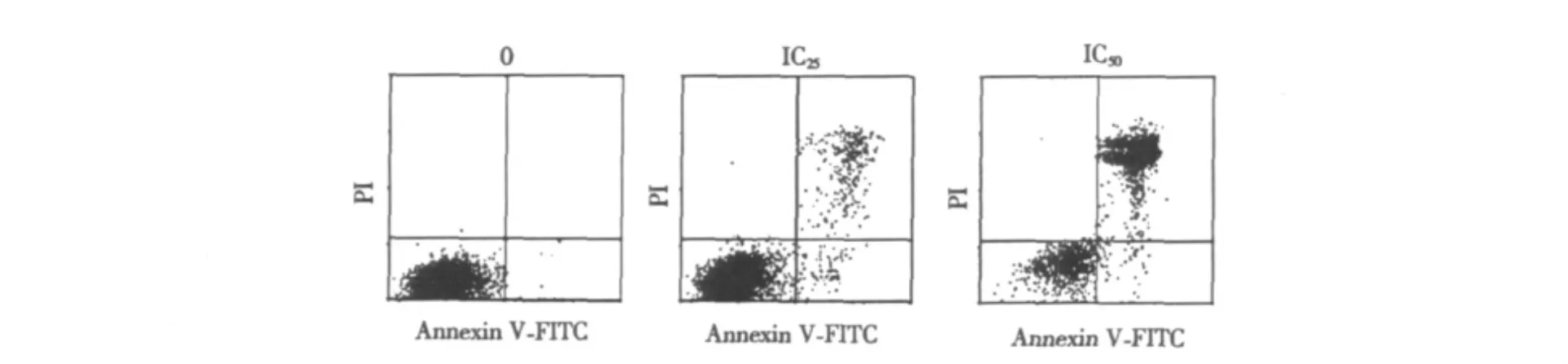
图2 海兔素剂量依赖性诱导SK-BR-3细胞凋亡Fig.2 Dose-dependent apoptosis in SK-BR-3 cells induced by aplysin
2.3 海兔素对SK-BR-3细胞中EGFR总蛋白和磷酸化蛋白相对表达水平的影响
结果显示,经IC25和IC50剂量海兔素处理SKBR-3细胞24 h后,细胞中EGFR总蛋白表达水平未见明显降低,与对照组比较,无显著性差异(P>0.05);而EGFR磷酸化蛋白的表达则明显受到抑制,且随着药物浓度的增大,表达水平逐渐降低,实验组与对照组比较及实验组间比较,差异均具有显著性(P<0.05),见Fig.3。

图3 海兔素对SK-BR-3细胞EGFR总蛋白和磷酸化蛋白表达的影响Fig.3 Effects of aplysin on the expression of phosphorylated and total EGFR in SK-BR-3 cells
2.4 海兔素对SK-BR-3细胞中ERK和Akt总蛋白和磷酸化蛋白相对表达水平的影响
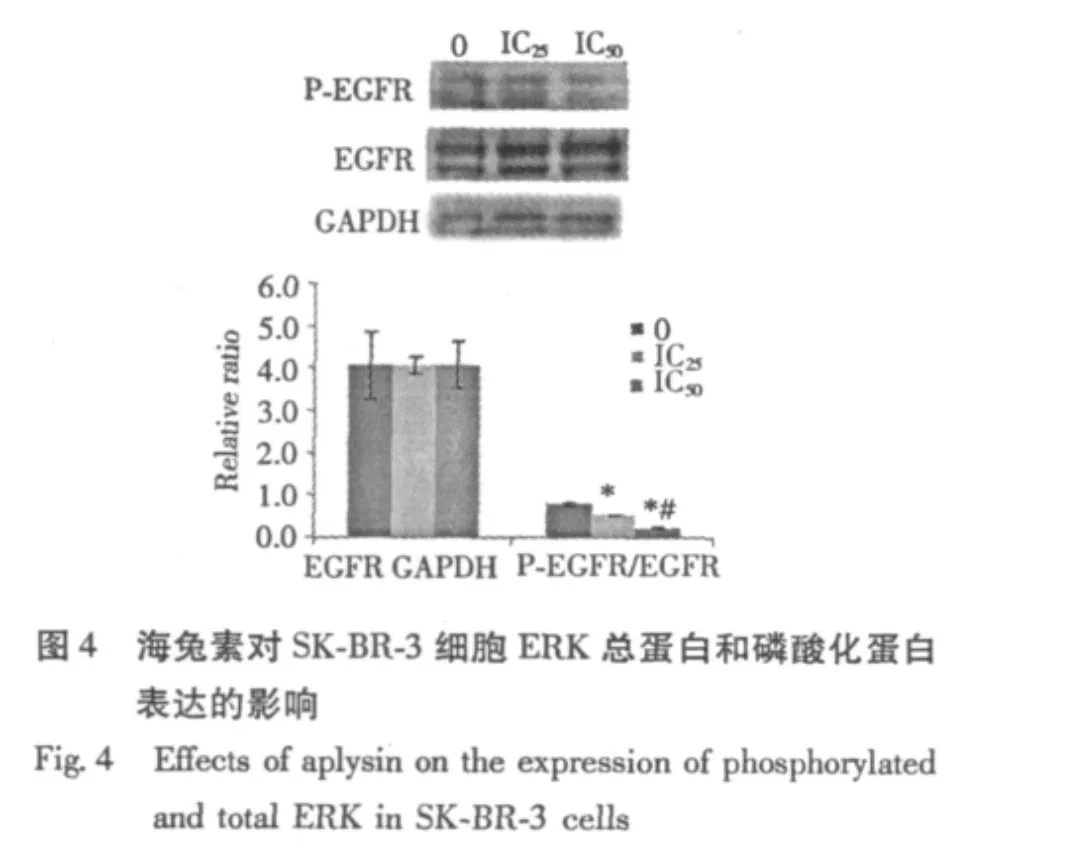
结果显示,经IC25和IC50剂量海兔素处理SKBR-3细胞24 h后,细胞中ERK和Akt总蛋白表达水平均未见明显降低,与对照组比较,无显著性差异(P>0.05);而ERK和Akt磷酸化蛋白的表达均明显受到抑制,且随着药物浓度的增大,表达水平均逐渐降低,实验组与对照组比较及实验组间比较,差异均具有显著性(P<0.05),见Fig.4和Fig.5。

3 讨论
肿瘤是一种多基因异常性疾病,其发病涉及多种原癌基因和抑癌基因的结构和功能异常。原癌基因异常激活和过表达,会引起相应细胞信号转导通路的调控紊乱,使细胞失去正常生长调控,出现无限增殖和凋亡抑制,从而导致肿瘤形成。EGFR是c-(erbB)-1原癌基因编码的170 kD跨膜糖蛋白,EGFR信号转导途径在肿瘤细胞增殖、损伤修复、侵袭及新生血管形成等方面起重要作用。EGFR活化可激活多种下游信号途径,产生多种生物学效应。本课题组研究表明,海兔素是一种安全低毒的天然抗肿瘤活性物质,可抑制多种肿瘤细胞的生长增殖和诱导肿瘤细胞凋亡,但其具体机制尚不明了[6-7]。本研究选择与调控细胞凋亡密切相关的蛋白EGFR及其下游效应分子ERK和Akt,检测其表达情况,以探讨海兔素诱导细胞凋亡的作用机制。本文证实了海兔素可以通过阻断EGRF/ERK和EGFR/Akt信号通路,抑制人乳腺癌细胞SK-BR-3增殖并诱导其发生凋亡。
本实验中,CCK-8结果显示,海兔素能抑制乳腺癌细胞SK-BR-3的增殖,呈剂量依赖性。流式细胞术结果表明,海兔素可诱导SK-BR-3细胞凋亡,且随药物剂量增加,细胞凋亡率明显提高,其中,IC50剂量海兔素可诱导相当高比例的SK-BR-3细胞凋亡,凋亡率达到(58.3±2.4)%,表明海兔素能通过抑制SK-BR-3细胞增殖,诱导细胞发生凋亡,最终抑制乳腺癌细胞生长。
本实验经Western blot检测还发现,海兔素虽不能抑制膜受体蛋白EGFR及其下游效应分子ERK和Akt总蛋白的表达,但可显著抑制EGFR蛋白磷酸化水平,并使下游效应分子ERK和Akt的激活明显受到影响,且随着药物浓度增加,EGFR、ERK和Akt的磷酸化水平均显著下降,呈量效依赖性。EGFR受体及其下游效应分子是肿瘤细胞增殖过程中的重要调节因子[8,9],EGRF与其配体相结合后,发生二聚化和自体磷酸化,进而激活下游的PI3K/ AKT和(或)RAS/MAPK信号通路,从而促进肿瘤细胞的恶性增殖[10,11]。EGFR受体被激活后,经细胞质中各种衔接蛋白酶的级联反应,将信号传导至细胞核内。其中,最主要的信号通路包括MAPK通路,PI3K通路和c-Src通路。ERK1/2是MAPK通路中重要的成员之一,EGFR近膜信号发生后,可诱导丝氨酸/苏氨酸酶Raf和ERK1/2激酶特异性地激活ERK1/2,最终通过调节转录因子,如Elk-1、cfos等,提高相关基因表达水平,进而促进细胞的增殖[12]。Akt是PI3K信号通路下游一个重要的靶分子,当 EGFR与配体结合被激活后,其下游分子Gab1被磷酸化,作为船坞蛋白招募大量的下游信号蛋白,特别是PI3K和Akt,这两种效应分子可通过刺激大量相关蛋白(如调节FasL表达的Forkhead家族转录因子、caspase-9、GSK-3β、NF-κB等)的磷酸化来促进肿瘤细胞的生长增殖。由于EGFR蛋白必须与配体结合才能发生自体磷酸化,以激活下游效应分子,因此,本研究提示,海兔素抑制EGFR蛋白磷酸化的机制,可能是其阻断了EGFR与相应配体的结合,这一发现为海兔素对乳腺癌治疗作用的研究提供了一定的理论依据,本课题将对此进行进一步的深入探讨。
综上所述,海兔素可有效抑制乳腺癌SK-BR-3细胞的生长增殖并诱导细胞凋亡,作为一种抗肿瘤海洋天然活性物质,值得进一步开发利用和深入探索。
1 Yu F(于峰),Wang SM(王思明),Dong M(董玫),et al.Studies of three sesquiterpene compounds on the anti-growth activity of human tumor cell lines.Nat Prod Res Dev(天然产物研究与开发),2010,22:506-509.
2 Adrian TE.Novel marine-derived anti-cancer agents.Curr Pharm Des,2007,33:3417-3426.
3 Laport MS,Santos OC,Muricy G.Marine sponges:potential sources of new antimicrobial drugs.Curr Pharm Biotechnol,2009,10:86-105.
4 Wang L(王潞),Zhao F(赵烽),He EQ(何恩其),et al.Effects of eighteen sesquiterpenes from Saussurea lappa on the Proliferation of six human cancer cell lines.Nat Prod Res Dev(天然产物研究与开发),2008,20:808-812.
5 He J(贺娟),Liang H(梁惠),Han L(韩磊),et al.Effect of aplysin on proliferation and vascular endothelial growth factor expression in human breast cancer cell line.Acta Nutr Sin (营养学报),2009,31:482-485.
6 Liu Y(刘颖),Liang H(梁惠),Su A(苏爱),et al.Effect of aplysin on the proliferation and apoptosis in human gastric cancer cell SGC-7901.Chin Pharmacol Bull(中国药理学通报),2010,26:333-337.
7 Liu Y(刘颖),Liang H(梁惠),Xu HW(徐宏伟),et al.Anticancer activities and immunologic function of Aplysin.Chin Pharmacol Bull(中国药理学通报),2006,22:1403-1405.
8 Kenny PA.Three-dimensional extracellular matrix culture models of EGFR signalling and drug response.Biochem Soc Trans,2007,35:665-668.
9 Kenny PA.TACE:a new target in epidermal growth factor receptor dependent tumors.Differentiation,2007,75:800-808.
10 Datta SR,Brunet A,Greenberg ME.Cellular survival:a play in three Akts.Genes Dev,1999,13:2905-2927.
11 Lal A,Glazer CA,Martinson HM,et al.Mutant epidermal growth factor receptor up-regulates molecular effectors of tumor invasion.Cancer Res,2002,62:3335-3339.
12 Wu JH(吴健虹),Xie QL(谢秋玲),Chen XJ(陈小佳),et al.Epidermal growth factor receptor(EGFR)and its signal transduction.Chin Bull Life Sci(生命科学),2006,18:116-122.
