杜仲绿原酸对高脂小鼠血液流变学作用研究
2012-12-22王建辉刘永乐李赤翎王发祥李向红
王建辉,刘永乐,李赤翎,俞 健,王发祥,李向红,李 艳
1长沙理工大学食品与生物工程系,长沙410114;2长沙高新开发区大自然生物科技有限公司,长沙410205
高血脂和动脉硬化及冠心病的发生发展有着密 切的关系,是动脉粥样硬化发生发展的生化、病理基础,可引起体内脂质过氧化状态的改变,使高血脂动物血浆脂质过氧化物含量增加,抗氧化酶活力降低,易导致动脉血管内膜的损伤,脂类物质附着于动脉血管壁,引起血液流变学病理变化,造成动脉粥样硬化斑化,动脉血管变窄,甚至完全阻塞,造成供血部位缺血性损害[1]。
杜仲作为我国传统中草药,我研究团队已开展杜仲提取物和杜仲绿原酸研究多年,前期研究发现:杜仲提取物尤其是杜仲绿原酸的体内外抗氧化作用,调控营养物质代谢及机体免疫等性能优良[2-4],且具有潜在的降血脂作用。绿原酸等多酚类物质被誉为“第七类营养素”。自1947年首次确定其化学结构以来,大量研究表明绿原酸具有一系列生理活性,其自由基清除活性为IC50=3.09 μg/mL[5];能抑制LDL的氧化,上调细胞抗氧化酶的表达,抗氧化能力优于BHA和生育酚,与BHT相当,其肠道水解产物咖啡酸的抗氧化性能更为优良[6];能有效增加大鼠血浆脂质过氧化产物如TBA反应底物和脂质过氧化体含量[7],提高小鼠肝脏GSH/GSSG和Cys/ CySS比率,稳定肠道GSH/GSSG和Cys/CySS比率,维持其肝脏巯基氧化还原平衡[8]。国外研究发现口服绿原酸有降低大鼠内脏脂肪堆积和体质量的趋势[9];绿原酸静脉给药能显著降低大鼠血浆中胆固醇和甘油三脂的含量,及肝脏中的甘油三脂水平[10]。国内研究发现杜仲的乙醇提取物(含绿原酸约4%)具有降血脂功能[11],然尚无杜仲高纯度绿原酸降血脂作用研究报道,更无绿原酸对高血脂小鼠血液流变学影响的系统研究,本文拟采用高脂和高胆固醇膳食诱导构建小鼠高脂血症模型,通过综合分析杜仲绿原酸对血液流变学变化及体内抗氧化酶活性、过氧化状态的影响,旨以揭示绿原酸改善高血脂动物血液流变学参数的影响及其可能的作用机制。
1 材料与方法
1.1 试剂
杜仲绿原酸(实验室自制,98%);硫代巴比妥酸(上海化学试剂三厂);二甲亚砜AR(津市化学试剂三厂);10 nmol/L四乙氧基丙烷;谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)、丙二醛(MDA)、总抗氧化能力(TAC)、考马斯亮兰蛋白质测定试剂盒(南京建成生物工程研究所),分析所用的其它化学试剂均为国产分析纯。
1.2 仪器
722S型紫外可见分光光度计(上海精密科学仪器有限公司产品);恒温水浴锅(北京国华仪器有限公司产品);台式离心机(湖南赛特湘仪离心机公司);微量式移液器(德国Eppendorf);全自动生化仪(深圳迈瑞医用仪器有限公司);MV IS22035全自动血液流变分析系统(重庆天海医疗设备有限公司)。
1.3 动物及高脂模型建立
1.3.1 试验动物
选取体重18~22 g昆明小鼠70只,♀♂各半。
1.3.2 日粮配方
普通饲料配方:玉米面58.5%;麸皮35%;面粉3%;鱼粉2%;食盐1%;鱼肝油0.5%[12,13];高脂饲料配方:胆固醇3.00%、丙基硫氧嘧啶0.20%、猪油10.00%、普通饲料86.80%[14]。
1.3.3 高脂模型的建立
饲以基础饲料1周后,将小鼠以体重为区组因素随机分成5组,每组10只,除空白对照组给予一般日粮外,其他4组均给予高脂饲料。各组小鼠自由采食,自由饮水。4周后在形态学上和血清检测发现,与正常组小鼠相比,高脂血症模型组血清总胆固醇含量明显升高,肝脏颜色呈淡黄色,说明按该方法建模成功。
1.3.4 试验管理
造模成功小鼠,按试验初始时分组情况分为空白对照组、高脂模型组和杜仲绿原酸组高、中、低剂量组,分别饲喂杜仲绿原酸100,50,25 mg/kg BW,除空白对照组给予普通饲料外,其他4组均给予高脂饲料。同时绿原酸各组以100,50,25 mg/kg BW剂量灌胃,空白和高脂对照组灌服等容量的生理盐水,每天两次,上午8-9点,下午3-4点各一次,连续喂饲4周,每周末禁食12 h称重,试验结束时,眼眶取血,制备血清,备用;并摘取完整肝脏,用0~4℃冷生理盐水洗去血污,滤纸吸干后称重。取适量肝脏,用冷生理盐水和异丙醇制成10%匀浆,4000 rpm离心15 min,-20℃保存备用。
1.4 观察方法与测定指标
血清(肝脏)常规生化指标测定用深圳迈瑞全自动生化分析仪或722S型紫外可见分光光度计完成;血液流变学指标测定采用MV IS22035全自动血液流变分析系统。
1.5 统计分析
试验数据结果以平均值表示,显著性统计采用SAS8.0统计软件的单因素方差分析,并进行Duncan氏多重比较,P<0.05表示差异显著。
2 结果与分析
2.1 CGA小鼠血液流变学指标的影响
杜仲绿原酸对小鼠血液流变学指标的影响见表1。经高脂诱导后,高脂模型组小鼠全血粘度、血浆粘度、红细胞压积和纤维蛋白原水平均显著高于阴性对照组(P<0.05)。饲喂杜仲绿原酸后,各剂量组模型小鼠全血粘度、血浆粘度、红细胞压积和纤维蛋白原水平均显著低于高脂模型组(P<0.05),其中,中剂量组(50 mg/kg BW)模型小鼠血浆粘度和纤维蛋白水平与阴性对照组无显著差异(P> 0.05)。同时,经高脂诱导后,高脂模型组小鼠红细胞变形系数显著降低、刚性和聚集指数显著增加、血沉显著增加(P<0.05)。饲喂杜仲绿原酸后,各剂量组模型小鼠红细胞变形指数显著提高(P<0.05),中、低剂量组与阴性对照组无显著差异 (P>0.05);各剂量组模型小鼠红细胞刚性指数显著降低(P<0.05),其中,中剂量组接近阴性对照组水平(P>0.05);中剂量组聚集指数和血沉均显著低于其余各剂量组(P<0.05),但仍显著高于阴性对照组(P<0.05)。
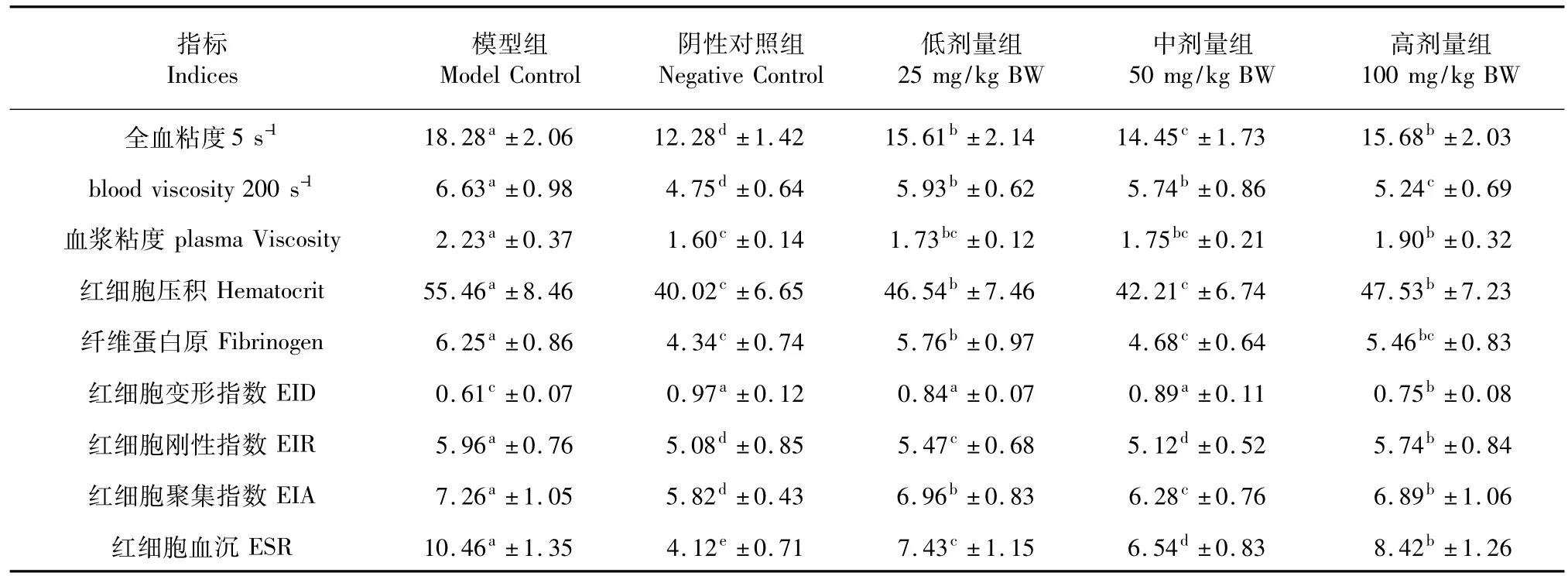
表1 绿原酸对高脂小鼠血液流变学的影响Table 1 Effects of CGA on hemorheological changes of hyperlipidemia mice
2.2 CGA对小鼠血清和肝脏TAC、羟自由基清除能力影响
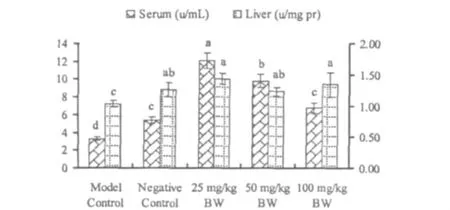
图1 绿原酸对高脂小鼠血清和肝脏匀浆总抗氧化能力的影响Fig.1 Effects of CGA on Total Antioxidant Capabilities levels in serum and liver of hyperlipidemia mice
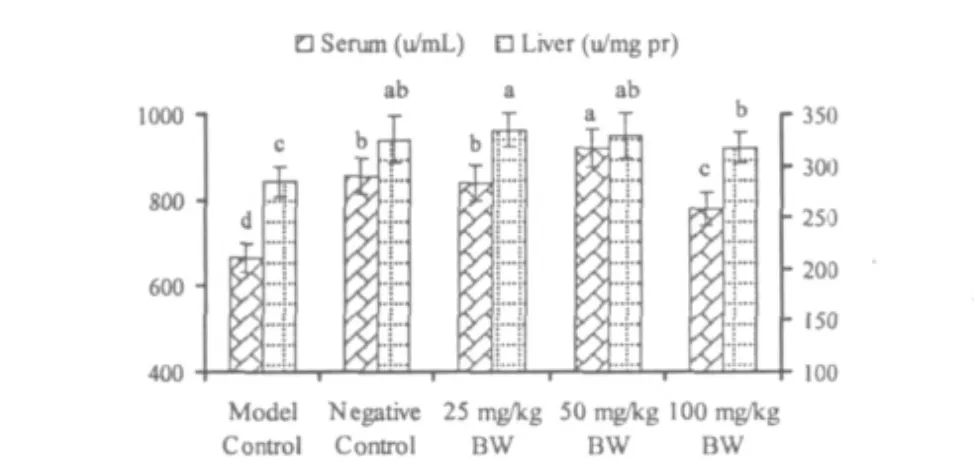
图2 绿原酸对高脂小鼠血清和肝脏匀浆超氧阴离子清除率的影响Fig.2 Effects of CGA on Hydroxyl Radical Scavenging rates in serum and liver of hyperlipidemia mice
杜仲绿原酸对小鼠血清和肝匀浆TAC和羟自由基清除能力的影响结果如图1~2,经高脂饲料诱导后,高脂模型组小鼠血清和肝脏的TAC和羟自由基清除能力较阴性对照组均显著降低(P<0.05),饲喂杜仲绿原酸后,3个剂量组血清中的TAC和羟自由基清除能力均较高脂模型组均显著升高(P<0.05),且两两间差异均达显著水平(P<0.05)。3个剂量组肝脏中的TAC和羟自由基清除率均显著高于高脂模型组(P<0.05),但与阴性对照组间均无显著差异(P>0.05)。
2.3 CGA对小鼠血清和肝脏SOD、GSH-Px、MDA含量影响
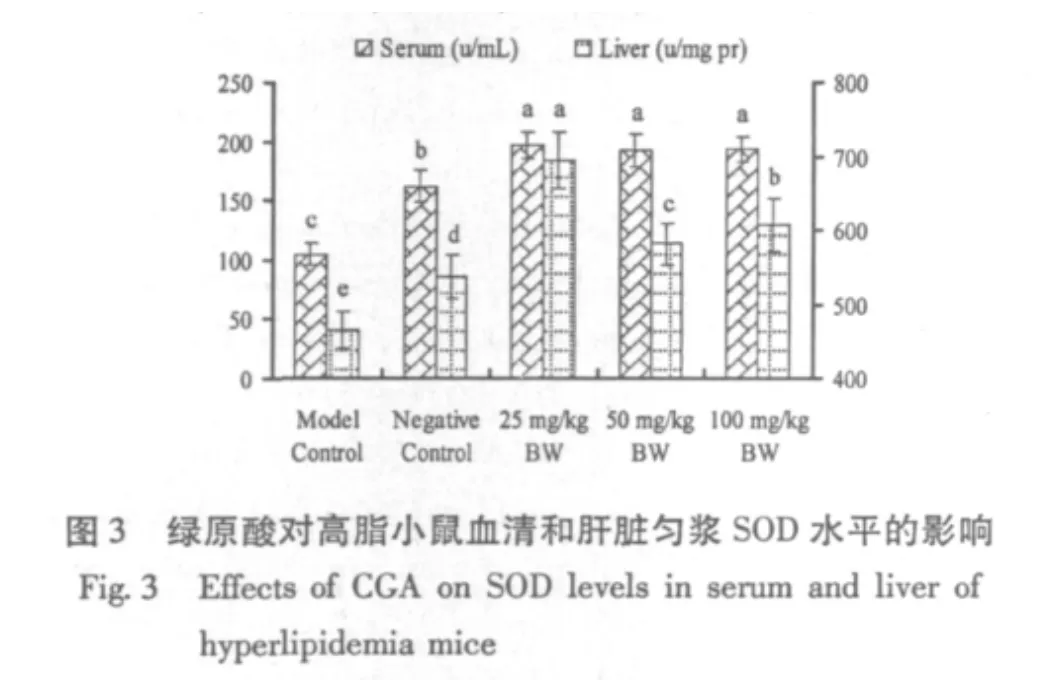
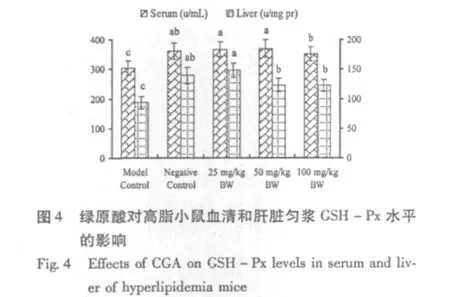

经高脂高胆固醇诱导,高脂模型组小鼠血清和肝脏中SOD、GSH-Px水平显著低于阴性对照组(P<0.05)。饲喂杜仲绿原酸,各剂量组血清和肝脏SOD活性均显著升高(P<0.05),且显著高于阴性对照组(P<0.05)(图3)。各剂量组血清和肝脏GSH-Px活性显著高于模型组(P<0.05),但与阴性对照组间无显著差异(P>0.05)(图4)。同时,各剂量组小鼠血清和肝脏MDA含量较模型组显著下降(P<0.05)(图5)。
3 讨论
高脂血症包括血浆TC过高、TG过高、LDL-C过高和HDL-C过低,符合其中的任何一项或几项,即为高脂血症[15-17],它是人体脂肪代谢异常的表现,是动脉粥样硬化发生发展的生化、病理基础,动脉粥样硬化的重要因素。血胆固醇水平过高可导致动脉血管内膜损伤,易使脂质类物质附着于动脉血管壁上,形成动脉粥样硬化斑化,使动脉血管变窄,甚至完全阻塞,造成供血部位缺血性损害,增加冠心病发生危险。高脂血症患者往往伴随有血液流变学的异常。血液流变学是研究循环血液的流动性、变形性、凝固性、黏弹性以及心血管黏滞性的科学,是从细胞和分子水平上研究血液成分的流变特性,如红细胞膜变形、聚集,纤维蛋白原的水平对流变特性的影响。红细胞本身的流变学异常包括红细胞刚性增大,变形能力下降[18]。
自由基的危害主要为脂质过氧化作用,导致细胞代谢和功能障碍。对MDA的检测可反映出机体内脂质过氧化和机体细胞受自由基攻击的损伤程度[19],MDA是氧自由基攻击生物膜中的不饱和脂肪酸而形成的脂质过氧化物,它能与人体内的蛋白质和DNA聚合,使蛋白质发生结构变异;同时,改变膜的流动性、结构和功能,增加膜脆性。SOD是一种重要的抗氧化酶,其能清除自由基、抑制脂质过氧化反应、维持机体氧化与抗氧化平衡,保护细胞免受损伤[20]。GSH-PX是一种重要的催化过氧化氢分解的酶,其能特异性地催化GSH成为氧化型谷胱甘肽GSSG,将有毒过氧化物自由基还原成无害的羟基化物,保护细胞膜结构和功能的完整性[21]。
本研究表明,小鼠经高脂高胆固醇饲料诱导后,高脂血症小鼠的全血粘度、血浆粘度、红细胞压积、血沉、纤维蛋白原、红细胞刚性指数和聚集指数显著升高,红细胞变形指数显著降低,饲喂杜仲绿原酸后,高、中、低3个剂量组对高血脂小鼠的全血粘度、血浆粘度、红细胞压积、血沉、纤维蛋白原、红细胞刚性指数和聚集指数均显著降低,红细胞变形指数显著升高,显著改善了因血脂升高和脂类代谢紊乱所引起的一系列血液流变学指标的改变,使血液处于低浓、低粘、低聚、低凝状态,可有效防止高脂血症的发展。进一步研究发现,饲喂杜仲绿原酸后,高、中、低3个剂量组模型小鼠血清和肝脏SOD、GSH-Px水平、总抗氧化能力和羟自由基清除能力均显著升高,MDA水平显著降低,这表明在高脂诱导下,杜仲绿原酸能有效提高血清和肝脏清除自由基能力和抗氧化水平,降低体内脂质过氧化水平,引起小鼠物质代谢的显著变化。这些物质抑或通过提高脂肪酶活性,分解血液中LDL-C乳糜颗粒,从而起到预防和治疗高脂血症的作用;抑或促使机体合成更多的HDL进入血清,加速胆固醇在肝脏的分解,降低血脂水平;抑或是因为绿原酸可直接减少血清内脂质向红细胞内的侵入或促进红细胞内的胆固醇外移,或使GSH-Px活力升高,提高内皮细胞防御氧化LPL损伤能力[22],从而起到降血脂和抗动脉硬化的作用。
国内外尚无绿原酸毒理研究的文献报道,仅有些许报道指出绿原酸可能存在致敏性,且分歧较大[23-25]。而本研究发现杜仲绿原酸中剂量组效果最佳,高剂量组效果反而下降,究其原因,可能缘于绿原酸的结构、存在形式间的差异,因绿原酸为次生代谢产物,其异构体众多,且在提取过程中可能存在一些同类物质或其他杂质如京尼平甙,当每日每公斤体重摄入量达50 mg则表现出中毒现象[26],加之,绿原酸本身不稳定,在提取、纯化、储存过程中易发生变化,等等,均可能影响绿原酸效用的发挥。总之,杜仲绿原酸通过提高血液的抗氧化防御功能(包括抗氧化力、抗氧化酶活性)、调节血脂水平、改变血液流变学参数等,降低血液粘度、红细胞刚性和聚集,增强变形能力,使细胞膜的流动性增高,最终发挥抗AS的作用,对高脂血症、动脉粥样硬化、脑血栓等心血管性疾病将具有较好的预防和治疗作用,但是尚需进一步开展临床研究与验证。
1 Yu SY(于守洋),Cu HB(崔洪斌).Advances in the Healthy Foods of China(中国保健食品的进展).Beijing: People’s Medical Publishing House,2001.87-89.
2 Wang JH(王建辉),He JH(贺建华),Yi X(易宣),et al.Effect of Eucommia ulmoides extract on growth performance,carcass characteristics,meat qualities and muscular amino acid contents in growing pig.Chin J Anim Nutri(动物营养学报),2007,3:269-276.
3 Wang JH(王建辉),He JH(贺建华),Yi X(易宣),et al.Effect of Eucommia ulmoicles oliv extract on performance and serum parameters in growing pig.Feed Res(饲料研究),2007,2:1-4.
4 Lv WX(吕武兴),Wang JH(王建辉),He JH(贺建华),et al.Studies on the application of Eucommia ulmoides extract in performance and carcass qualities of broilers.J Hunan Agric Univ(Nat Sci)(湖南农业大学学报),2005,31:640-643.
5 Kwon SH,Lee HK,Kim JA,et al.Neuroprotective effects of chlorogenic acid on scopolamine-induced amnesia via antiacetylcholinesterase and anti-oxidative activities in mice.Eur J Pharmacol,2010,649:210-217.
6 Sato Y,Itagaki S,Kurokawa T,et al.In vitro and in vivo antioxidant properties of chlorogenic acid and caffeic acid.Int J Pharm,2011,403:136-138.
7 Pari L,Karthikesan K,Menon VP.Comparative and combined effect of chlorogenic acid and tetrahydro-curcumin on antioxidant disparities in chemical induced experimental diabetes.Mol Cell Biochem,2010,341:109-117.
8 Park HJ,Davis SR,Liang HY,et al.Chlorogenic acid differentially alters hepatic and small intestinal thiol redox status without protecting against azoxy-methane-induced colon carcinogenesis in mice.Nutr Cancer,2010,62:362-370.
9 Shimoda H,Seki E,Aitani M.2006.Inhibitory effect of green coffee bean extract on fat accumulation and body weight gain in mice.BMC Complement Altern Med,17(6):9.
10 Rodriguez DS,Hadley M.Chlorogenic acid modifies plasma and liver concentrations of cholesterol,triacylglycerol,and minerals in(fa/fa)Zucker rats.J Nutr Biochem,2002,13: 717-726.
11 Zou H(左航),Huang W(黄文),Li TH(李天宏),et al.2009.Optimization of extracting chlorogenic acid from Eucommia ulmoides leaf and the effect of the extract on hyperlipemia in mice.Sci Silv Sin(林业科学),2009,45:158-160.
12 He TP(何天培),Guo YM(呙于明),Zhou LP(周毓平).Effect and mechanism of taurine on lipid metabolism.Acta Nutri Sin(营养学报),1999,2:233.
13 Ma XF(马小凤),Shan F(陕方),Liu S(刘森),et al.Effect of puffed oat bran blood lipid levels and its nutritional quality in rat.Acta Nutr Sin(营养学报),1999,21:196-199.
14 Chen Q(陈奇).Methodology on Chinese Medicine Pharmacology Research(中药药理研究方法学).Beijing:People’s Medical Publishing House,1994.520.
15 Knouff C,Briand O,Lestavel S,et al.Defective VLDL metabolism and severe atherosclerosis in mice expressing human apolipo-protein E isoforms but lacking the LDL receptor.Biochim Biophys Acta,2004,1684(1-3):8.
16 Engler MB.Familial hyper cholesterollemia:genetic predisposition to atherosclerosis.Medsurg Nurs,2004,13:252.
17 Kullo IJ,Bailey KR,McConnell JP,et al.Low-density lipoprotein particle size and coronary atherosclerosis in subjects belonging to hypertensive sibships.Am J Hypertens,2004,17: 845-851.
18 Yarnell JW,Baker IA,Sweetnam PM,et al.Fibrinogen,viscosity,and white blood cell count are major risk factors for ischemic heart disease.The Caerphilly and Speedwell collaborative heart disease studies.Circulation,1991,83:836-844.
19 Yang XD(杨学东),Zhang XY(张新勇),Zhao HB(赵怀兵),et al.Effects of anisodamine on oxidative stress of rat alveolar macrophages induced by lipopolysaccharide.Chin J Crit Care Med(中国急救医学),2006,26:600-601.
20 Zhang XM(张雪梅),Xing GQ(邢国庆),Qiao XF(乔现福),et al.Effect of estradiol on the SOD activity and the MDA content of cerebral tissue after ischemia reperfusion in gerbils undergone ovariectomy.J Taishan Med Coll(泰山医学院学报),2006,127:99-101.
21 Huang YS(黄彦生),Wang SR(王树人),Zhi YF(智艳芳),et al.The relationship between oxidized form glutathione,coenzymeⅡ and carotid artery atherosclerosis.Chin J Cardiol(中华心血管病杂志),2006,34:515-518.
22 Yuan SY(袁淑云).Effect of nattokinase on reducing serum lipid in experimental hyperlipemia rats.Mod Hosp(现代医院),2005,5(5):10-12.
23 Freedman SO,Krupey J,Schon AH,et al.Chlorogenic acid: an allergen in green coffen bean.Nature,1961,192:241.
24 Freedman SO,Siddiqi AI,Krupey J,et al.Identification of a simple chemical compound(Chlorogenic aicd)as an allergen in plant materials causing human atopic disease.Am J Med Sci,1962,244:548.
25 Layton LL,Panzani R,Corse JW.Nondiffusible allergenic contaminant isolated from samples of chlorogenic acid causing allergic reaction:Pure chlorogenic acid not an allergen.J Allergy,1966,35:268-275.
26 Li Y,Kamo S,Metori K,et al.The promoting effect of eucommiol from Eucommiae Cortex on collagen synthesis.J Biol Pharm Bull,2000,23:54-9.
