具杀螺活性的商陆根际真菌Aspergillus fumigatus SL-30发酵条件优化
2012-12-22郭丹钊杜向萍张春晓
郭丹钊,陈 钧,杜向萍,张春晓,潘 静
1江苏大学食品与生物工程学院;2江苏大学药学院,镇江212013
湖北钉螺(Oncomelania hupensis)是日本血吸虫(Schistosoma japonicum)的唯一中间宿主[1],因此杀灭钉螺是控制血吸虫病流行的重要措施[2]。我国主要采用化学灭螺方法,如五氯酚钠、氯硝柳胺等,化学药物灭螺效果虽好,但都不同程度地存在选择性较弱、持久性差、易造成环境污染等问题[3]。为弥补化学杀螺剂的不足,研究和开发更为安全有效的生物杀螺方法和生物杀螺剂对于控制血吸虫病的传播和保护生态环境,具有重要意义[4,5]。
本实验室自药用植物商陆的根际分离到一株真菌菌株Aspergillus fumigatus SL-30,其胞外发酵液具有显著的杀螺活性,且对非靶生物毒性小,具有良好的开发利用价值[6]。在前期的工作基础上,本研究采用Plackett-Burman(PB)设计法对影响菌株SL-30杀螺活性的主要因素进行筛选,并采用Box-Behnken中心组合设计进行响应面分析,研究了可溶性淀粉,蛋白胨和初始pH三个显著因子的最佳水平,为菌株SL-30及其发酵液中杀螺活性物质的进一步研究和开发提供基础。
1 材料与方法
1.1 材料
菌种:Aspergillus fumigatus SL-30,本实验室分离自商陆根际。
钉螺(Oncomelania hupensis):采集自镇江京口区长江村江滩,去氯水清洗后适应性培养1~2 d,剔除死螺,挑选6-7旋的健康成年钉螺进行杀螺活性测定。
氯硝柳胺(含量98%),江苏省血吸虫病防治研究所惠赠;其余试剂均为国产分析纯。
1.2 试验设计
1.2.1 Plackett-Burman试验
根据菌株SL-30生长所需要的营养要素的基本原则和发酵影响因素的一般规律,结合前期试验,选用试验次数N=12的Plackett-Burman试验设计,对可溶性淀粉用量(X1)、蛋白胨用量(X2)、磷酸二氢钾用量(X3)、硫酸镁用量(X4)、接种量(X5)、装液量(X6)、初始pH值(X7)、培养温度(X8)8个因素作为影响因素进行全面考察,每个因素取两个水平,响应值为杀螺率Y(%),试验设计和各因素水平编码见表1和表2。运用Design-Expert 7.0.0软件对各因素效应进行t检验,选择置信度95%以上的因素作为重要因素进行后续响应面试验。
1.2.2 响应面试验设计(Response surface methodology,RSM)
响应面分析法是一种寻找多因素系统中最佳条件的数学统计方法[7]。在PB试验的基础上,将得到的三个主要影响因子可溶性淀粉用量(A)、蛋白胨用量(B)和初始pH(C)进一步采用Box-Behnken中心组合设计进行响应面分析,每个因子取低、中、高三个水平:初始pH为1、3、5,可溶性淀粉含量为10、15、20 g/L,蛋白胨含量为2.5、3.75、5 g/L,响应值为杀螺率Y(%)。数据进行二次回归拟合,得到带交互项和平方项的二次方程,通过对回归方程的方差分析,可以评价每个因子及其交互作用对响应值的影响程度。并用响应面图和等高图直观的描绘结果,同时求出响应值最大时各因子的水平。
1.2.3 杀螺率测定
将发酵液过滤得发酵滤液,并稀释至1.6%,采用WHO推荐的浸杀法测定滤液的杀螺活性,并统计各组杀螺率。
1.2.4 模型验证
将优化试验所得的数据与响应面模型进行拟合,确定其极值点以及取得极值时相应的自变量取值,进行六批次验证试验及可靠性分析。
2 结果与分析
2.1 Plackett-Burman结果分析
根据试验设计进行发酵试验,结果列于表1,经Design-Expert 7.0.0分析和整理,各因素的效应分析结果见表2,可溶性淀粉用量(X1),蛋白胨用量(X2)和初始pH(X7)作为重要因子的可信度大于95%,对菌株SL-30发酵滤液的杀螺活性影响显著,并以此作为主要因素进行后续的响应面优化试验。

表1 Plackett-Burman试验设计与结果Table 1 Experimental design and result of Plackett-Burman
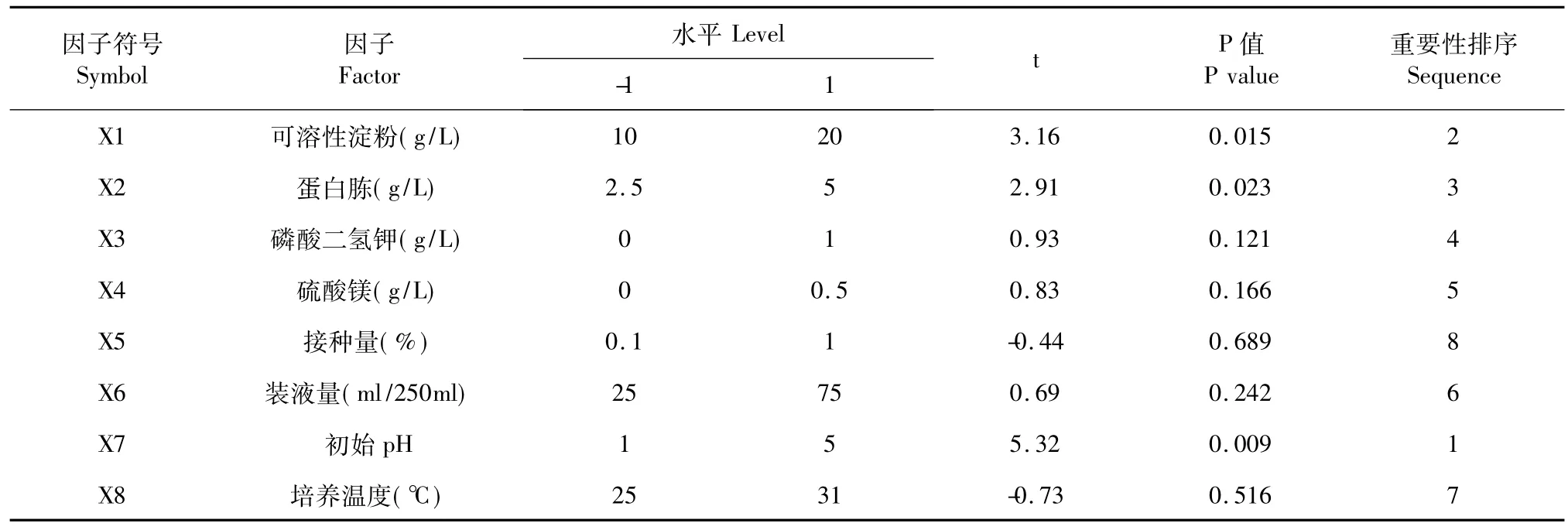
表2 各因素影响及重要性评价Table 2 Levels and effects of variables
2.2 Box-Behnken响应面优化结果
2.2.1 回归模型的建立
对影响发酵滤液杀螺活性的三个关键因素可溶性淀粉,蛋白胨和初始pH值进行优化试验,分别以可溶性淀粉15 g/L,蛋白胨3.75 g/L和初始pH 3为中心点实施响应面试验,发酵滤液杀螺率为响应值,结果列于表3。

表3 Box-Behnken试验设计与结果Table 3 Process variables and levels in response surface Box-Behnken design and reponse value
运用Design-Expert 7.0.0软件对表3中试验数据进行多元回归拟合,得到响应面二次多元回归模型:

对该方程式进行方差分析,结果列于表4。回归模型的F值为12.31,其P=0.0065<0.01,说明该模型高度显著,失拟项的P=0.0732>0.05,表明失拟项对于绝对误差不显著,残差由随机误差引起,回归模型无失拟因素存在,回归模型有效[8]。精密度(Adeq precision)是有效信号与噪音的比值,大于4.0视为合理,本试验精密度达到10.406,因此精密度较好;方程模型的相关系数R2=0.9568,表明该方程模型可解释95.68%的发酵滤液杀螺活性变化,因此该模型可用于菌株SL-30发酵滤液的杀螺活性分析与预测。
由表4还可以看到,因素A和B对发酵滤液杀螺活性的线性效应显著(其P值均小于0.05),C不显著,AB的交互影响显著,而AC和BC不显著,二次项效应均显著,表明可溶性淀粉、蛋白胨和初始pH对发酵滤液杀螺活性的影响不是简单的线性关系。
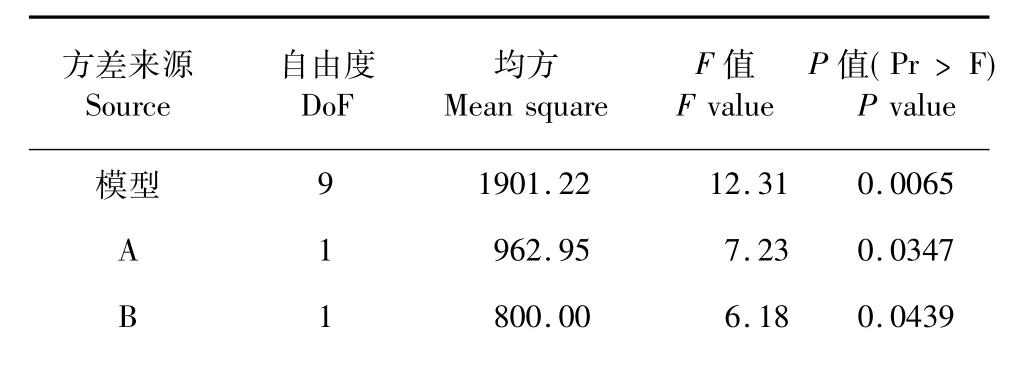
表4 回归模型方差分析Table 4 ANOVA of quadratic polynomial model
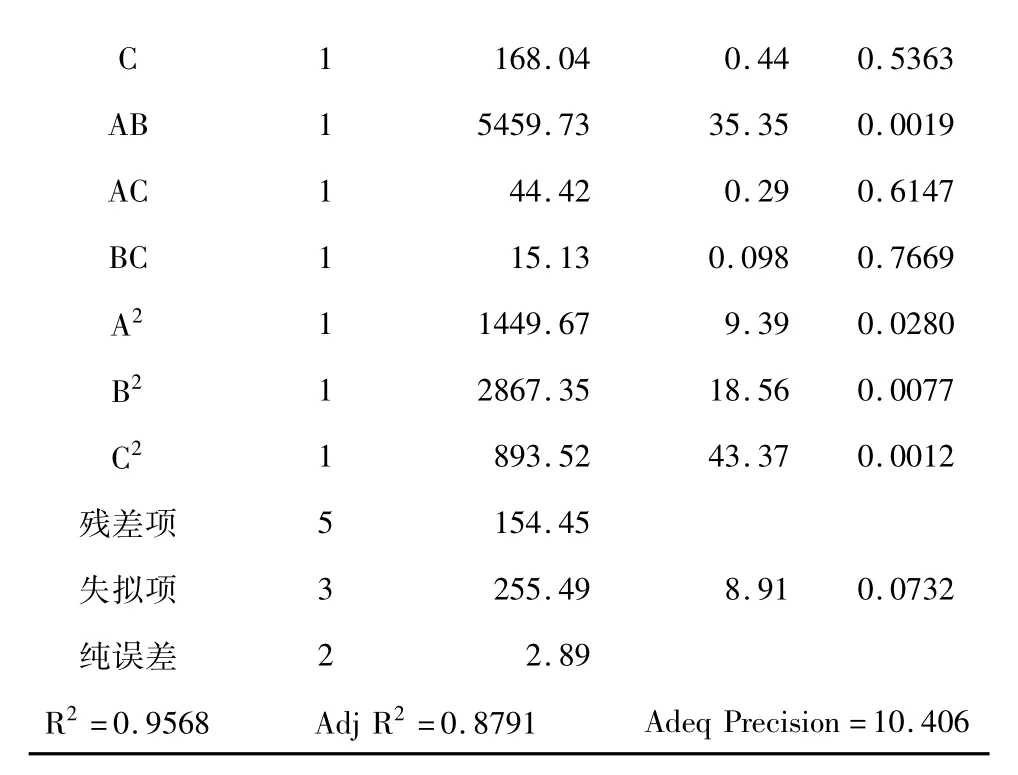
168.04 0.44 0.5363 AB 1 5459.73 35.35 0.0019 AC 1 44.42 0.29 0.6147 BC 1 15.13 0.098 0.7669 A2 1 1449.67 9.39 0.0280 B2 1 2867.35 18.56 0.0077 C2 1 893.52 43.37 0.0012残差项 5 154.45失拟项 3 255.49 8.91 0.0732纯误差 2 2.89 R2=0.9568 Adj R2=0.8791 C 1 Adeq Precision=10.406
2.2.2 响应面分析
三维响应面图是回归方程的图形表表述,反应出各因素的交互作用,每个响应面分别代表着两个独立变量之间的相互作用,此时第三个变量保持在零水平[9],通过响应面图可以直观、高效地找到最佳参数和各参数之间的相互作用及最大相应值;等高线图的形状表示交互作用的强弱,形状为圆形交互作用弱,椭圆形则表示交互作用强[10]。在回归模型方差分析结果的基础上,利用软件作可溶性淀粉、蛋白胨和初始pH对发酵滤液杀螺活性影响的响应面和等高线图(图1、2和3)。由此,可对任何两个因素的交互作用进行分析与评价[11]。
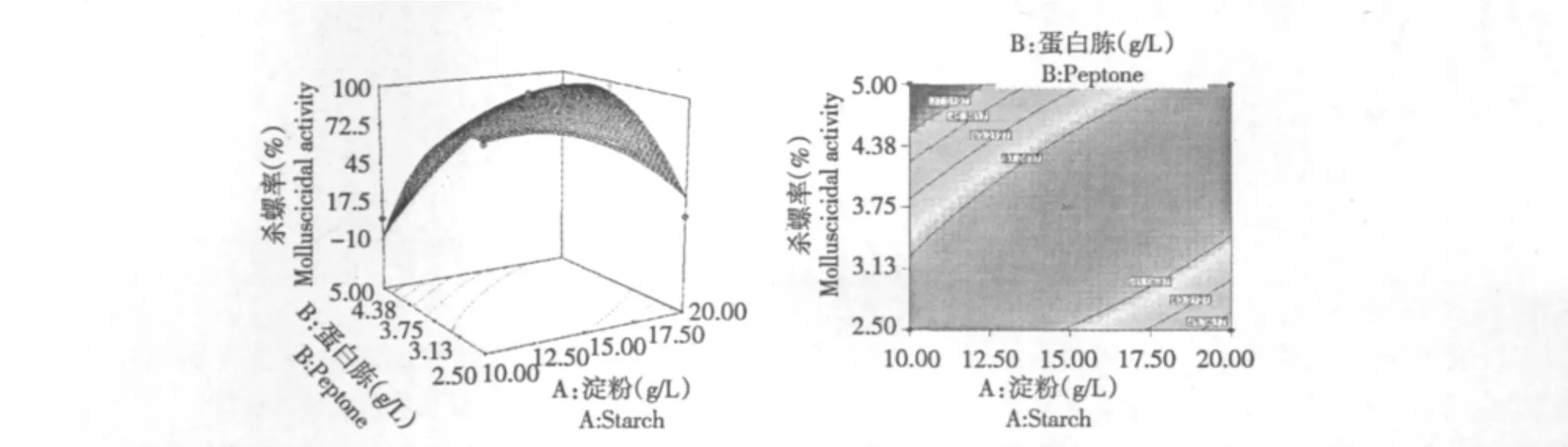
图1 可溶性淀粉与蛋白胨用量对杀螺活性交互作用的响应面与等高线图Fig.1 Response surface plot and contour plot for the cross action of soluble starch content and peptone content on molluscicidal activity
图1显示,当初始pH为3时,可溶性淀粉与蛋白胨含量对发酵滤液杀螺率的交互影响。由图可以看出,当可溶性淀粉的用量固定,蛋白胨的用量必须在一定的范围内才可使发酵滤液的杀螺活性达到最大,也就是说,碳氮比要有一个合适的范围,若超出该范围则会降低发酵滤液的杀螺活性,说明过高或过低的碳氮比不利于菌丝的生长繁殖,进而影响杀螺活性成分在发酵液中的合成和积累。

图2 可溶性淀粉用量与初始pH对杀螺活性交互作用的响应面与等高线图Fig.2 Response surface plot and contour plot for the cross action of soluble starch content and initial pH on molluscicidal activity
蛋白胨用量为3.75 g/L条件下,初始pH和可溶性淀粉用量对发酵滤液杀螺活性的影响如图2所示。由图可以看到,当可溶性淀粉用量为12.5 g/L左右时,随着初始pH的逐渐增大,发酵滤液的杀螺率呈现先升高后降低的过程,当初始pH调整为2左右时,随着可溶性淀粉用量的增加也呈现相同的变化,这表明初始pH和可溶性淀粉用量过高或过低都不利于菌丝的生长和杀螺活性成分的合成。可溶性淀粉在12.5~20 g/L范围内,初始pH控制在2~4,发酵滤液可呈现最大的杀螺活性。
图3显示当可溶性淀粉用量为15 g/L时,蛋白胨含量与初始pH对发酵滤液杀螺率的交互影响。由图可以看到,当蛋白胨用量大约为2.66 g/L左右时,随着初始pH的逐渐增大,发酵滤液的杀螺率先升高后降低,当初始pH调整为2左右时,随着蛋白胨用量的增加也呈现相同的变化,这表明初始pH和蛋白胨用量过高或过低都不利于菌丝的生长和杀螺活性成分的合成。可溶性淀粉在2.66~4.38 g/L范围内,初始pH控制在2~4,发酵滤液的杀螺活性最强。
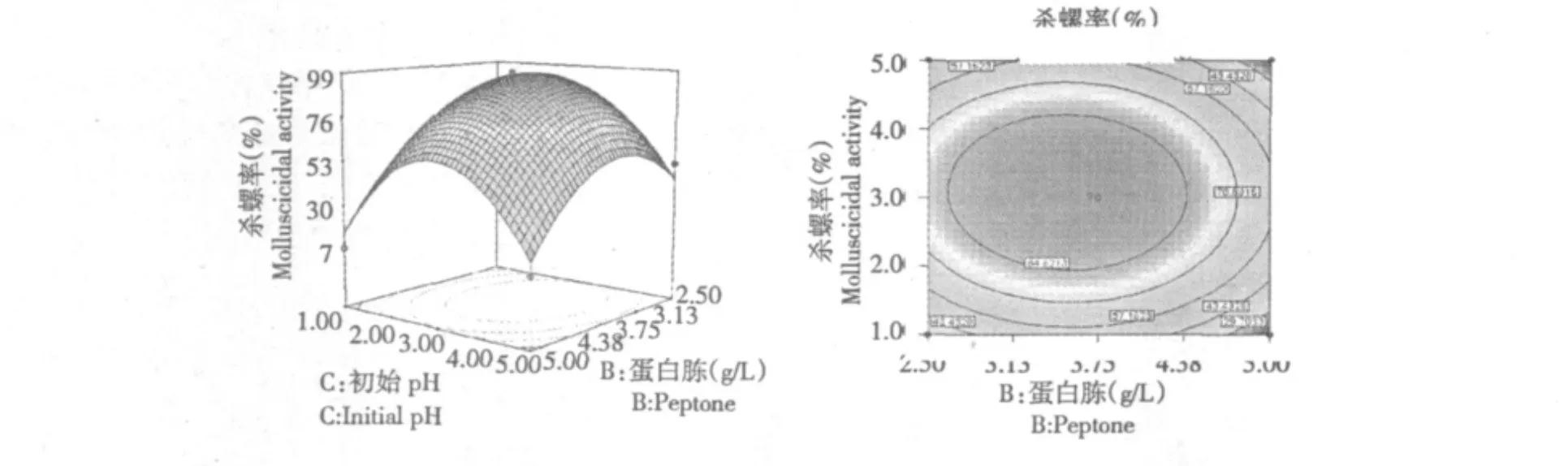
图3 蛋白胨用量与初始pH对杀螺活性交互作用的响应面与等高线图Fig.3 Response surface plot and contour plot for the cross action of peptone content and initial pH on molluscicidal activity
以发酵滤液杀螺活性最高为优化目标,以可溶性淀粉用量、蛋白胨用量和初始pH为优化对象,利用Design-Expert7.0.0软件对上述模型进行了优化处理,确定最优发酵条件为可溶性淀粉16.40 g/L,蛋白胨3.76 g/L,初始pH 3(为方便操作,将软件计算得到的pH 3.05在操作中改为pH 3),该模型理论预测的最大响应值为98.949%。
2.3 模型验证
结合以上的优化条件,其他影响不显著的因子取中间值,得到菌株SL-30的发酵培养条件为:可溶性淀粉16.40 g/L,蛋白胨3.76 g/L,磷酸二氢钾0.5 g/L,硫酸镁0.25 g/L,接种量0.5%,装液量50 ml/250 ml,初始pH 3,培养温度28℃。
为检验模型预测的可靠性,利用以上优化培养条件分6批次进行发酵,每批三个重复,测定发酵滤液的杀螺活性均在98%左右(表5),接近预测值,6批次之间相对标准偏差为1.96%,二者的良好拟合性证实了模型的有效性。因此,基于响应面法所得的菌株SL-30发酵条件参数准确可靠,具有实用价值。
3 讨论
植物根际有益微生物是土壤微生物的一部分,它们可在根际定殖并代谢产生种类丰富的次级代谢物[12],其中存在具有抑菌杀虫等生物活性的成分[13-15],具有进一步研究开发的价值。从生态学角度来看,设法将可产生杀螺活性物质的微生物定殖于植物根际环境,构建微生物-植物生态灭螺抑螺系统,可长效控制钉螺的繁殖和危害,在一定程度上缓解化学灭螺药物带来的弊端。
分离自商陆根际的真菌菌株SL-30,其发酵液具有显著的杀螺活性,对光照稳定,且对非靶生物毒性低,具有较好的开发前景。其发酵液中的杀螺活性物质有待进一步分离和鉴定,以及菌株在植物根际的定殖也有待进一步研究和探索。
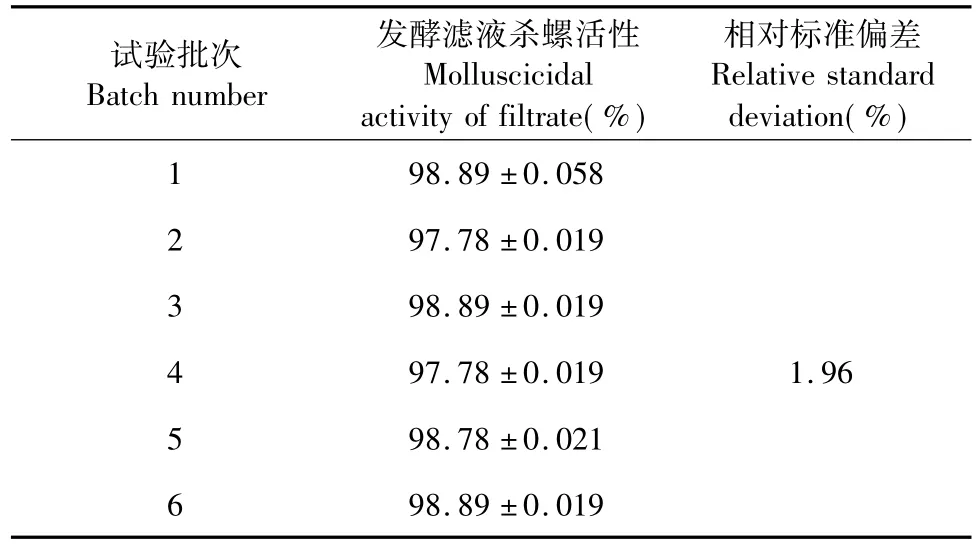
表5 优化发酵条件的验证Table 5 Verification of optimum fermentation conditions
1 Zhou XN,Wang LY,Chen MG,et al.The public health significance and control of Schistosomiasis in China-then and now.Acta Trop,2005,96(2-3):97-105.
2 dos Santos AF,de Azevedo DP,dos Santos Mata Rda C,et al.The lethality of Euphorbia conspicuato adults of Biomphalaria glabrata,cercaria of Schistosoma mansoni and larvae of Artemia salina.Bioresour Technol,2007,98:135-139.
3 Andrews P,Thyssen J,Lorke D.The biology and toxicology of molluscicide,Bayluscide.Pharmacol Ther,1982,19:245-295.
4 Mao ZH(毛佐华),Yu PZ(俞培忠),Sun K(孙锴),et al.Preparation of five ginkgolic acid monomers and their molluscicidal effects against Oncomelania hupensis.Chin J Parasitol Parasit Dis(中国寄生虫学与寄生虫病杂志),2007,25: 274-278.
5 Yang JM(杨建明),Xiao RF(肖瑞芬),Zhou Y(周艳).Studies on killing snail of microorganism.J Hubei Univ,Nat Sci(湖北大学学报,自科版),2003,25:337-341.
6 Guo DZ,Chen J,Du XP,et al.Screening of molluscicidal strain against Oncomelania hupensis from rhizosphere of medicinal plant Phytolacca acinosa Roxb.Phcog Mag,2010,6: 159-165.
7 Wang WL(王维乐),Mu ZM(牟志美),Zhang SJ(张淑君),et al.Optimization of Fermentation Conditions of Paraconiothyrium variabile GHJ-4 for Laccase Production by Response Surface Methodology.Chin J Appl Environ Biol(应用与环境生物学报),2011,17:321-325.
8 Singh R,Kuma R,Bishnoi K,et al.Optimization of synergistic parameters for themostable cellulase activity of Aspergillus heteromorphus using response surface methodology.Biochem Eng J,2009,48:28-35.
9 Shentu XP(申屠旭萍),Shi YJ(石一珺),Yu XP(俞晓平).Optimization of Conditions for Production of Trichodermin by Trichoderma harzianum.Chin J Biolog Cont(中国生物防治),2009,25:348-354.
10 Chen Y(陈燕),Wang WP(王文平),Qiu SY(邱树毅),et al.Optimization of Ultrasonic-assisted Extraction of Coix lacryma-jobi Seed Ester Using Response Surface Methodology.Food Sci(食品科学),2010,31(8):46-50.
11 Ge JP(葛菁萍),Liu GM(刘国明),Sun HB(孙红兵),et al.Response Surface Methodology to Optimize the Hydrolysis Condition of Corncob Hemicellulose.Chin Agric Sci Bull(中国农学通报),2011,27(18):64-64.
12 He H(何欢),Wang ZW(王占武),Hu D(胡栋),et al.Progress on Interactions between Root Exudates and RhizosphereM icroorganisms.J Hebei Agric Sci(河北农业科学),2011,15(3):69-73.
13 Zhou GY(周国英),Gou ZH(苟志辉),Hao Y(郝艳),et al.Screening antagonistic silicate bacteria from Camellia oleifera rhizosphere against Fusarium proliferatum and stability of bacteria.J Cent South Univ For Tech(中南林业科技大学学报),2010,30:118-122.
14 He RF(何仁发),Li MY(李明月),Wang J(王娟),et al.Aspergillus sp.F5 from the rhizospheric soil of Bruguiera gymnorrhiza and its antibacterial metabolites.Mycosystema (菌物学报),2010,29:732-738.
15 Xiao TJ(肖同建),Chen F(陈芳),Zhu Z(朱震),et al.Effect of different rhizobacteria on suppression root-knot nematode(Meloidogyne incognita)of tomato.J Nanjing Agric Univ(南京农业大学学报),2011,34(4):59-64.
