伊乐藻-固定化氮循环菌技术入湖河道修复研究
2012-12-20王易超李正魁范念文冯露露南京大学环境学院污染控制与资源化研究国家重点实验室江苏南京210046
王易超,李正魁,周 莉,范念文,冯露露 (南京大学环境学院,污染控制与资源化研究国家重点实验室,江苏 南京 210046)
伊乐藻-固定化氮循环菌技术入湖河道修复研究
王易超,李正魁*,周 莉,范念文,冯露露 (南京大学环境学院,污染控制与资源化研究国家重点实验室,江苏 南京 210046)
从太湖金墅湾水体筛选出包括土著氨化、亚硝化、硝化和反硝化细菌的氮循环菌,固定于多孔性载体内,对伊乐藻-固定化氮循环菌联用技术在秋冬季太湖金墅湾水源地入湖河道水体生态修复效果进行了研究.经室内生态修复模拟与原位围隔实验表明,伊乐藻-固定化氮循环菌联用对水质改善效果要优于单独使用伊乐藻或固定化氮循环菌,该技术对原位入湖河道有效去除率为:总氮 5.9%~61.2%,氨氮12.4~70.3%,硝氮6.1%~68.0%,COD 4.2%~78.5%;通过氮循环菌释放可明显提高水体氮循环菌数量,MPN值比对照水体高出3~4个数量级;相关性分析表明,差异性显著(P<0.01).经5个月原位围隔试验表明,伊乐藻-氮循环菌联用技术可有效降低秋冬季入湖河道营养盐负荷,有助于控制湖泊水源地富营养化.
富营养化;入湖河道;伊乐藻-固定化氮循环菌联用;生态修复;MPN
太湖金墅湾水源地位于太湖东北部贡湖地区,是苏州市与高新区自来水供应最重要的水源地之一.近年来,由于流域内人类活动的影响及不合理开发利用,贡湖水生态系统遭到破坏,氮磷引起的水体富营养化程度加剧,蓝藻频发,直接威胁到水源地饮水安全,严重制约流域经济建设和社会发展.
金墅湾水源地周边河网密布,主要入湖河道有位于取水口北侧的金墅港、田鸡港,以及位于南侧的龙塘港等.水源地入湖河道流域污染源主要包括外部河道来水污染、保护区大气干湿沉降,保护区内工农业污染、居民生活污水排放、畜禽及水产养殖废水等[1].因此,控制金墅湾水源地入湖河道污染,改善河道水体水质,对于水源地水质保护具有重要意义.
各国学者对利用沉水植物吸收水体氮磷,控制水体富营养化进行了广泛的研究[2-3],目前对于湖泊生态修复的研究热点主要集中在水生植物对营养盐控制方面[4-5].另外,单独利用固定化氮循环菌技术(INCB)进行土著脱氮微生物分离、筛选及去除湖泊过量氮素的应用研究已有相关报道[6-7],单独使用沉水植物改善富营养化水体水质也已有较多研究[8-11],而利用两者联合作用控制入湖河道富营养化的研究尚不多见.常规水生植物净化水质方法对秋冬季水质净化效果往往表现不佳,本研究针对太湖金墅湾水源地主要入湖河道在秋冬季节氮磷污染较严重、河道水体风浪小、一般水生植物逐渐死亡的特点,选择秋冬季生长良好的伊乐藻种(Elodea nuttallii),采用伊乐藻-固定化氮循环菌联用技术,在室内生态修复模拟实验的基础上,搭建河道原位围隔,进行入湖河道水体生态修复应用研究,通过释放土著氮循环细菌提高水体氮素转化效率,结合伊乐藻吸收水体营养盐,控制入湖河道水体富营养化.同时分析了伊乐藻-固定化氮循环菌联用与河道水体水质改善之间的关系,初步探讨了各因素对水体脱氮的影响机理,以期为水源地入湖河道水体富营养化治理提供有效方案.
1 材料与方法
1.1 研究区域概况
研究区域位于太湖东北部金墅湾水源地主要入湖河道田鸡港与金墅港之间的支流南泾河内(图1),河流污染主要来自沿岸居民生活用水排放、农业及水产养殖废水排放等,受污染水体最终流入贡湖,给区域内水源地水质保护造成较大威胁.2009年11月~2010年3月监测资料显示,南泾河TN 1.24~8.13mg/L、NO3-0.19~5.49mg/L、NH4+0.043~1.76mg/L、NO2-0.016~0.13mg/L、TP 0.081~0.38mg/L、PO43-0.022~0.27mg/L、COD 4.49~51.21mg/L,水体透明度 0.6~1.3m.南泾河秋冬季水质变化较大,并受气象、人类活动等因素综合影响,富营养化趋势明显.
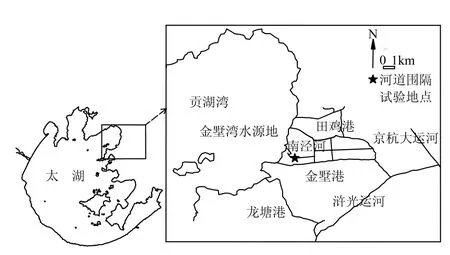
图1 太湖金墅湾水源地入湖河道试验地点Fig.1 Location of inflow river experiment site in Jinshu bay, Taihu Lake
1.2 脱氮菌种采集、分离与筛选
采集太湖金墅湾水源地水样、沉水植物及底泥中微生物样品,接种至选择性培养基上,富集筛选出纯化的太湖金墅湾土著氨化、硝化、亚硝化以及反硝化细菌.
1.3 载体制备及氮循环菌固定化
将亲水性玻璃态单体甲基丙烯酸-β-羟乙酯(HEMA)、丙烯酸羟乙酯(HEA)与蒸馏水按特定体积比均匀混合,并用氮气饱和,采用60Co-γ射线(辐射剂量1×104Gy),在-78℃温度条件下辐照制备形成生物相容性固定化聚合物载体[6].将辐射聚合后载体切成 5mm立方小块,用蒸馏水浸泡至充分膨胀,然后加入4种氮循环菌培养基培养.培养基充分进入膨胀后载体内部之后,投加经活化后进入对数生长期的氨化、硝化、亚硝化和反硝化细菌各 200mL,利用曝气设备在28℃下按照16h曝气搅动,8h静置的模式连续培养,使氮循环菌在有氧和厌氧的交替条件下吸附于固定化载体表面,并通过增殖进入多孔载体内部实现固定化.
1.4 室内-原位实验设计
1.4.1 室内实验 共设4组试验柱,进行模拟生态修复对比:A柱为裸泥对照样,B柱为固定化氮循环菌,C柱为伊乐藻,D柱为伊乐藻-固定化氮循环菌联用.
2009年8月中旬在南泾河用有机玻璃柱状采样器(内径9cm,长60cm)采集4根未扰动柱样,柱样泥深15cm左右,柱内保留部分上覆水,两端用橡皮塞密封后,尽量保证垂直无扰动,同步采集50L上覆水及一定量伊乐藻,一起运回实验室,小心将泥柱分别移入相同尺寸的有机玻璃生态修复模拟柱内. 对 4根柱样分别进行不同处理:A柱作为对照样不做任何处理,B柱利用柔性网孔材料包覆的方法添加固定化氮循环菌,C柱采用扦插法种植5株10cm长的长势茁壮的伊乐藻,D柱采用相同方法同时添加固定化氮循环菌及种植伊乐藻.处理完之后,采用虹吸法将采集的原位河道水注满各试验柱,进行预培养,试验柱内氮循环菌载体与水每周更换 1次.14d以后试验柱生态系统趋于稳定,再次更换载体,并用新采集的河道上覆水替换柱内水,稳定24h后,测定水体各理化指标,分别考察固定化氮循环菌、伊乐藻、伊乐藻-固定化氮循环菌联用对水源地入湖河道水质改善效果.
1.4.2 原位河道实验 采用围隔,围隔主体采用防水布料,尺寸为 3m×2m.顶部用高强度泡沫材料制成浮体,底部采用沙袋作为配重物,各结合处用扁铁、螺丝、加强带连接.
原位围隔在南泾河道进行安装.通过桩绳牵引固定确保围隔隔离效果,减少外来水流风浪等因素对围隔内部实验效果的影响.搭建完成后,在围隔内种植伊乐藻,同时利用网兜包覆固定化载体的方式投加氮循环菌,新鲜固定化载体湿重为(50±1)g/包,每周更换1次.对河道围隔内外水质参数进行监测,考察伊乐藻-固定化氮循环菌联用技术对水源地入湖河道水质净化效果.
1.5 反硝化菌数量
围隔内外水体中反硝化菌数量测定采用MPN法[12-13],采用 Giltay培养基培养.调节培养基pH值为7.0~7.2,灭菌处理后加入试管中,采用三管法进行反硝化菌计数.以无菌操作法,对每个水样做 10倍系列稀释,每支试管中接种水样 1 mL.在25℃恒温培养箱内培养14d后,培养基变蓝的试管视作阳性管[14],对照MPN表读数[15].
1.6 水质测定仪器设备
日本岛津 UV-2450紫外可见分光光度计,便携式 YSI pH计 pH100,便携式 YSI溶氧仪550A,温度计.
1.7 水质指标及测定方法
正磷酸盐:钼锑抗分光光度法;氨氮:纳氏试剂分光光度法;硝态氮:麝香-草酚分光光度法;亚硝酸盐氮:N-(1-萘基)-乙二胺分光光度法;总氮:过硫酸钾氧化、紫外分光光度法;pH:便携式 pH计;DO:便携式溶氧仪;CODcr:重铬酸钾法.
1.8 数据分析
本研究中数据归纳和图表分析采用Excel或Origin7.5进行,数据统计分析采用SPSS13.0.
2 结果与讨论
2.1 室内试验柱模拟生态修复效果对比
2.1.1 氮素营养盐水平变化 室内试验在2009年 9月进行,试验容器采用生态修复模拟柱,7:00~17:00每隔2h取试验柱水样,分别测定4个试验柱内总氮、氨氮、硝氮、亚硝氮、DO、ORP及pH值等参数(图2~图7).结果表明,与其他试验柱相比,当伊乐藻-固定化氮循环菌联用时,水体总氮和硝氮的去除率分别达到最高的65.2%与78.3%,说明伊乐藻-INCB联用对水体氮素的脱除效果最好,硝氮变化规律与总氮一致(r=0.991, P<0.01).而氨氮去除率为5.3%,添加氮循环菌的B柱与D柱中,氨氮浓度呈先增后减之趋势,未添加氮循环菌的试验柱则未见该现象(图 6),这可能是由于投放氮循环菌后,水体氨氮浓度先由氨化细菌的矿化作用而增高,随后又经硝化细菌转化而降低造成的.从图5看到,投放固定化氮循环菌的柱体内亚硝氮浓度明显高于未投放的柱体(ANOVA,P<0.001),说明作为水体微生物脱氮过程的中间体之一,亚硝氮浓度由于氮循环菌作用呈暂时性累积.
2.1.2 pH值与DO变化 从图6可见看出,试验过程中4个试验柱水体的pH值均有不同程度升高,添加伊乐藻的C、D两柱的pH值分别高达9.26和9.92,而未添加植物的柱体pH值均在8.5以下.有研究指出沉水植物会分泌有机酸而导致水体pH值下降[16],但另一方面,沉水植物在昼间光照条件下,会因其强烈的光合作用消耗水中的CO2,导致水体 pH值的增加.结果表明,本试验伊乐藻提高水体 pH值的作用占据主导.添加伊乐藻的C、D试验柱DO均达到11mg/L以上,证实水体在沉水植物的强烈光合作用下,溶解氧往往呈明显过饱和现象,与Cheng等[17]的研究结果相同;裸泥柱样DO无明显变化,而仅投放INCB的试验柱由于氮循环菌生命代谢耗氧,10h内水体DO从初始值8.86mg/L缓慢减至8.21mg/L.通过Pearson相关性分析发现,含伊乐藻的试验柱内总氮浓度与DO呈负相关(P<0.01, r=-0.897).随着水体DO的升高,水体硝化速率可能会进一步增大,从而有更多来自上覆水中的硝氮进入底泥中反硝化区,促进非耦合反硝化作用.
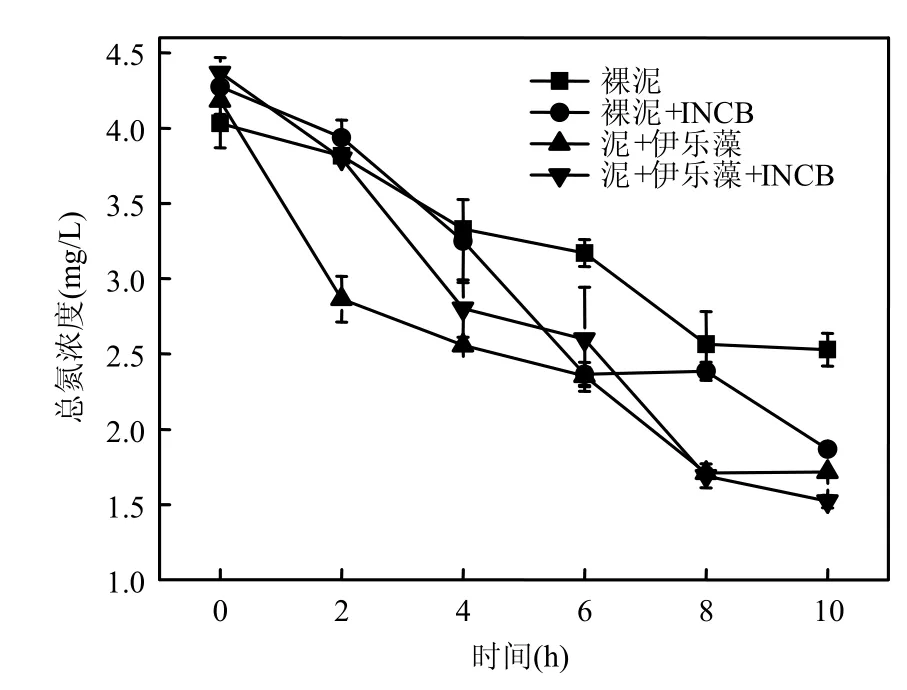
图2 试验柱总氮变化趋势Fig.2 Variation of TN concentration in the experiment tubes
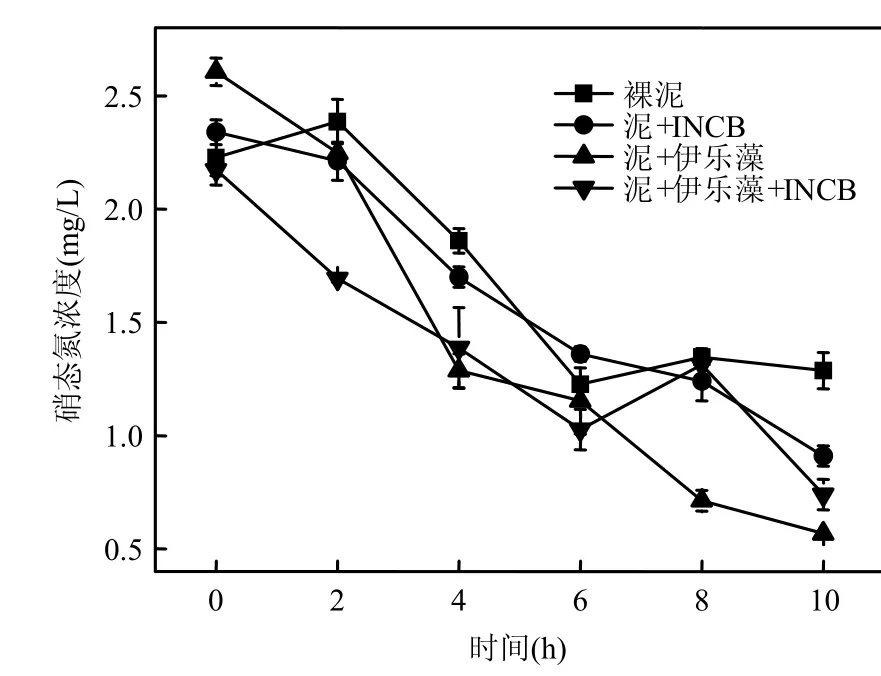
图3 试验柱硝态氮变化趋势Fig.3 Variation of NO3- concentration in the experiment tubs

图4 试验柱亚硝氮变化趋势Fig.4 Variation of NO2- concentration in the experiment tubes
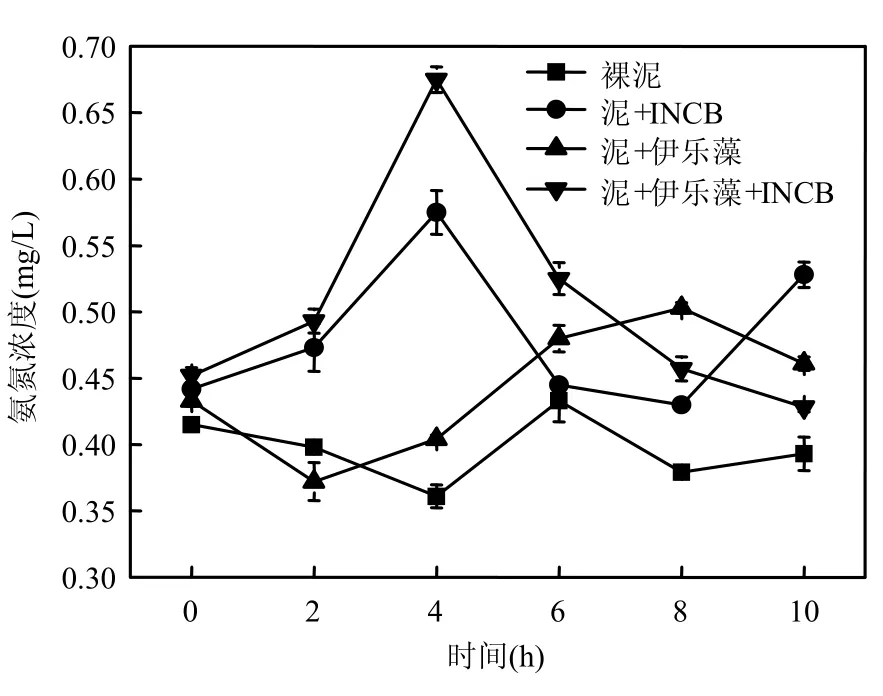
图5 试验柱氨氮变化趋势Fig.5 Variation of NH4+ concentration in the experiment tubes

图6 试验柱pH值变化趋势Fig.6 Variation of pH in the experiment tubes
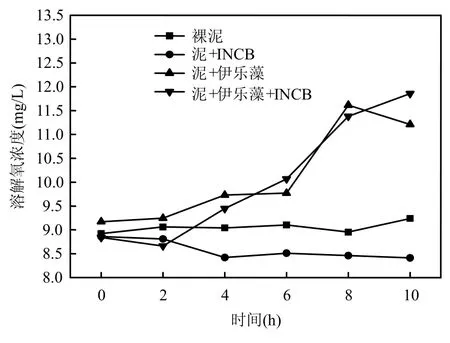
图7 试验柱溶解氧变化趋势Fig.7 Variation of DO in the experiment tubes
2.2 入湖河道原位围隔实验
2.2.1 围隔内外水质生态修复效果对比 在室内实验基础上,原位实验于 2009年 11月~2010年3月连续进行,分别监测围隔内伊乐藻-固定化氮循环菌联用与围隔外河道水体的氮、磷、反硝化菌数量、COD等数据.结果表明,围隔内伊乐藻、固定化氮循环菌联用时,对总氮有效去除率为 5.9%~61.2%、硝态氮 6.1%~68.0%,氨氮12.4%~70.3%,总磷 9.3%~71.1%, COD 4.2%~78.5% (图8~图12).实验期间硝态氮变化趋势与总氮基本一致(r=0.671, P<0.01),河道水体硝态氮含量占总氮含量为 40.2%~92.7%,平均值为61.8%.由于总氮主要以硝酸盐氮形式存在,因此水体硝氮去除率的高低直接关系到水体营养盐净化总体效果,本实验利用固定化载体负载氮循环细菌,一方面由于载体具有良好的微孔结构,为氮循环菌提供了好氧-厌氧的微生态环境[18],有利于发生耦合硝化-反硝化脱氮作用,提高水体总氮去除能力;另一方面负载的反硝化细菌扩散至水体与伊乐藻根部,参与反硝化过程,减少硝酸盐氮积累;再一方面伊乐藻除了为底泥中微生物提供有机质外,还可通过匍匐茎向底泥释氧,在植物根区土壤形成好氧-厌氧环境,扩大氮循环菌分布空间,促进底泥脱氮细菌反硝化作用[19-20].
与室内实验相比,围隔实验水质净化效果有所降低,而且随着时间变化,围隔水质与去除率波动剧烈,这主要是由于实验室与原位实验条件存在较大差异所造成的,入湖河道流域流量变化、风浪作用、污染物排放以及沉水植物和微生物活性随气温的变化等因素都会给围隔试验的稳定性带来不同程度的影响.
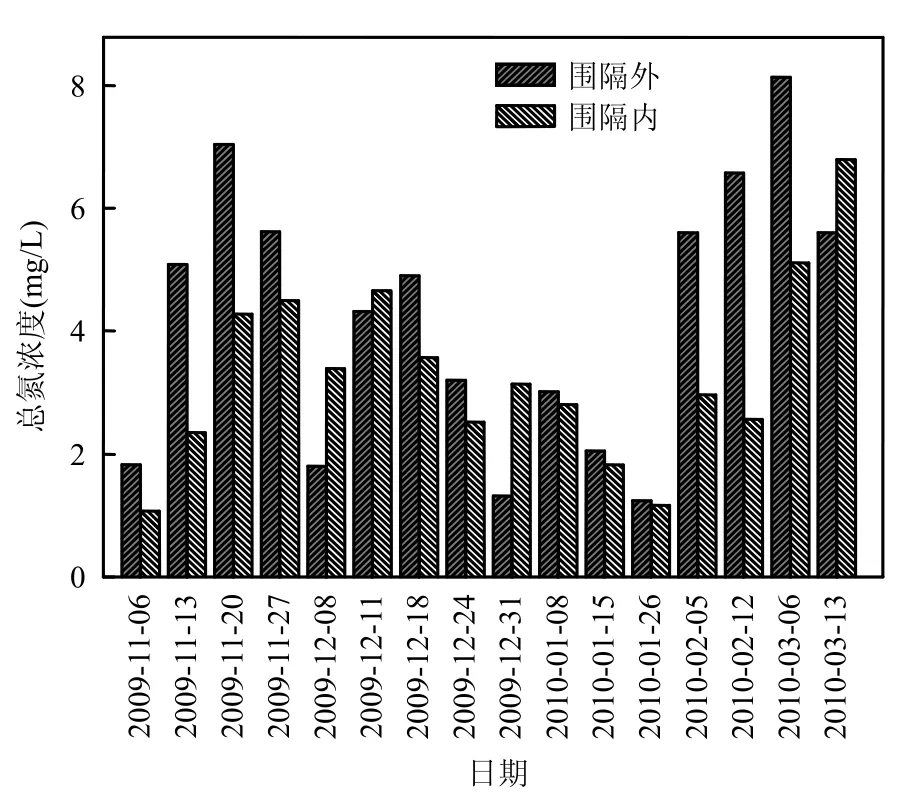
图8 河道围隔内外总氮对比Fig.8 Variation of TN concentration in the enclosure and surrounding river water
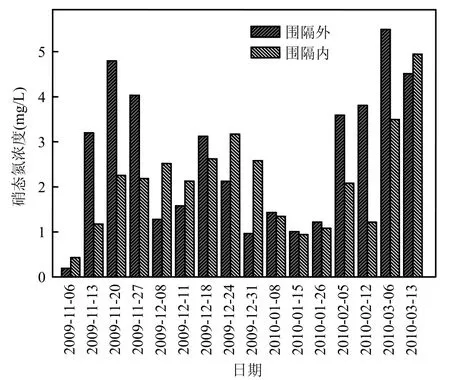
图9 河道围隔内外硝态氮对比Fig.9 Variation of NO3-concentration in the enclosure and surrounding river water
2.2.2 围隔内外反硝化细菌数量 固定化氮循环细菌技术采用的多孔性载体具有良好生物相容性,载体内部富集的四种菌可对氮素进行形态转化,同时可向围隔水体释放,维持较高微生物数量,强化水体氮素营养盐的脱除能力.

图10 河道围隔内外氨氮对比Fig.10 Variation of NH4+concentration in the enclosure and surrounding river water
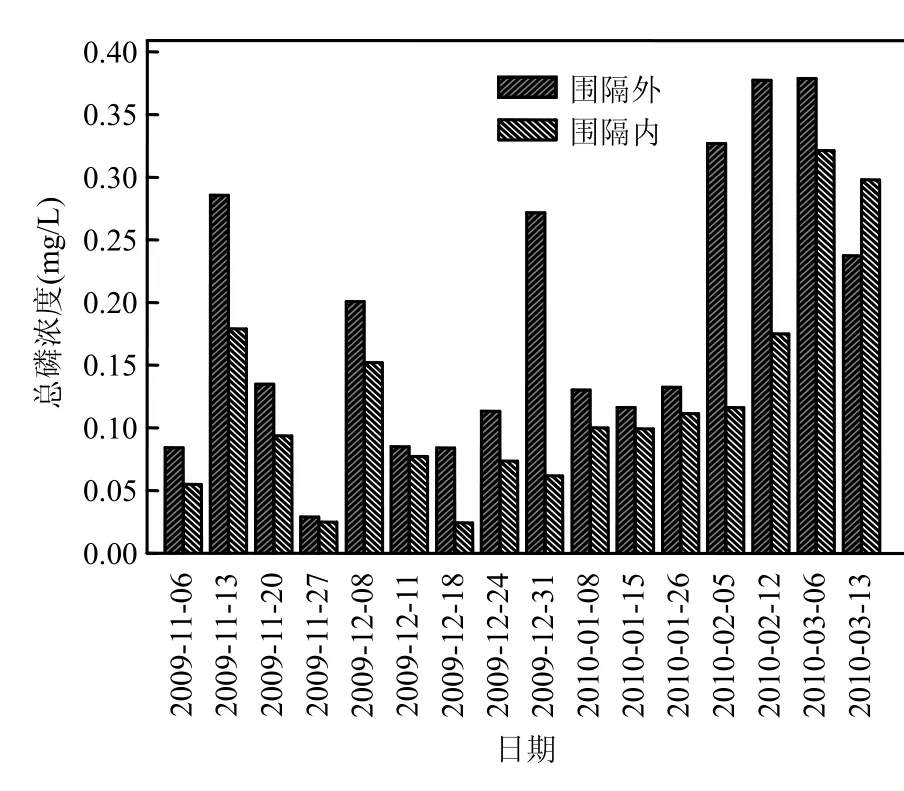
图11 河道围隔内外总磷对比Fig.11 Variation of TP concentration in the enclosure and surrounding river water
围隔实验开始后1周,采用MPN法对水体中的反硝化菌数量进行定期检测,取样期间水温变化范围2.9~10.6℃.结果表明,围隔内投放载体后,水体中反硝化细菌迅速增加,其数量在第2周达到最大值1.1×107cells/L.整个试验过程中,围隔内伊乐藻-氮循环菌联用时,水体反硝化菌数量比围隔外部对照水体提高 3~4个数量级(ANOVA P<0.01).由于季节原因,试验后期围隔内反硝化菌数量呈减少趋势,但仍高于对照水体.在温度较低的环境中,微生物活性受到一定抑制,反硝化速率减缓,客观上对水体脱氮效果不利,而沉水植物的存在又为微生物提供了适宜的生存环境,从而使围隔内微生物量维持在相对高的水平.围隔内外水体硝态氮的去除率和对应的反硝化菌数量并不显著相关(P>0.05),说明除固定化氮循环菌之外,还有沉水植物吸收、温度、水量水质变化等其他因素制约着水体氮素营养盐的脱除.

图12 河道围隔内外COD对比Fig.12 Variation of COD concentration in the enclosure and surrounding river water

表1 围隔内外反硝化菌释放效果对比Table 1 The comparison of denitrifying bacteria quantities in enclosure and surrounding river water during INCB releasing experiment
结果表明,采用固定化氮循环细菌技术在围隔内能较好释放反硝化细菌,并在实验周期内保持较高微生物数量,有助于提高河道水体反硝化能力.另外,由于秋冬季一般沉水植物水质净化能力有限,本实验结合固定化氮循环菌和秋冬季生长的伊乐藻共同作用,着重发挥植物-脱氮微生物互利共生优势,有助于改善秋冬季富营养化入湖河道水质.
3 结论
3.1 长达5个月的贡湖金墅湾水源地入湖河道围隔实验表明,河道营养盐水平随季节变化较大,平均水体硝态氮含量占到总氮含量的 61.8%,而秋冬季采用伊乐藻-固定化氮循环菌联用技术可有效净化水源地入湖河道水质,控制水体富营养化,该技术对原位入湖河道总氮去除率为 5.9%~61.2%,氨氮去除率 12.4%~70.3%,硝氮去除率6.1%~68.0%, COD去除率4.2%~78.5%.由于河道原位环境条件变化的影响,河道围隔实验水质改善效果低于室内生态修复模拟实验.
3.2 本研究采用固定化氮循环菌(INCB)技术,在河道围隔内人工释放氮循环菌,使围隔内水体反硝化菌数量比围隔外河道水体高出 3~4个数量级,在秋冬季 2.9~10.6℃温度条件下仍然能维持较高微生物量,强化水体反硝化脱氮能力.
3.3 室内模拟、原位河道生态修复实验表明,伊乐藻-固定化氮循环菌联用对水体氮素去除能力要优于单独使用沉水植物或微生物的手段,为控制水源地水体富营养化和水域生态修复提供了一种有效方法.
[1] 姚 垚,王晓龙,丁士明,等.太湖金墅湾水源保护区陆域水质特征 [J]. 环境科学与管理, 2010,35(5):39-42.
[2] 蒋 跃,童 琰,由文辉,等.3种浮床植物生长特性及氮、磷吸收的优化配置研究 [J]. 中国环境科学, 2011,31(5):774-780.
[3] 罗固源,卜发平,许晓毅,等.温度对生态浮床系统的影响 [J]. 中国环境科学, 2010,30(4):499-503.
[4] Risgaard-Petersen N, Meyer R L, Rersbech N P. Denitrification and anaerobic ammonium oxidation in sediments-effects of microphytobenthos and NO3-[J]. Aquatic Microbial Ecology, 2005,40(1):67-76.
[5] Chen K N, Bao C H, Zhou W P. Ecological restoration in eutrophic Lake Wuli: A large enclosure experiment [J]. Ecological Engineering, 2009,35:1646-1655.
[6] Li Z K, Pu P M, Hu W P, et al. Improvement of Taihu water quality by the technology of immobilized nitrogen cycle bacteria [J]. Nuclear Science and Techniques, 2002,13(2):115-118.
[7] 李正魁,石鲁娜,杨竹攸,等.纯种氨氧化细菌Comamonas aquatic LNL3的固定化及短程硝化性能研究 [J]. 环境科学, 2009, 30(10):2952-2957.
[8] 黄 亮,吴乃成,唐 涛,等.水生植物对富营养化水系统中氮、磷的富集与转移 [J]. 中国环境科学, 2010,30(Suppl.):1-6
[9] 朱增银,王 珺,尹大强,等.不同比例硝态氮和尿素氮对苦草的生理影响 [J]. 南京大学学报(自然科学), 2005,18(6):51-57.
[10] 宋 睿,姜锦林,耿金菊,等.不同浓度铵态氮对苦草的生理影响[J]. 中国环境科学, 2011,31(3):448-453.
[11] Bakker E S, Van Donk E,Declerck S A J, et al. Effect of macrophyte community composition and nutrient enrichment on plant biomass and algal blooms [J]. Basic and Applied Ecology, 2010,11(5):432-439.
[12] 中国科学院南京土壤研究所微生物室.土壤微生物研究方法[M]. 北京:科学出版社, 1985.
[13] 李阜棣,喻子牛,何绍江.农业微生物学实验技术 [M]. 北京:中国农业出版社, 1996.
[14] 张玉芹,刘开启,王 革,等.反硝化细菌的筛选及培养条件的研究 [J]. 农业环境科学学报, 2005,24(1):165-168.
[15] 国家环保局《水生生物监测手册》编委会.水生生物监测手册[M]. 南京:东南大学出版社, 1993.
[16] Yasushi K, Yasunori, Kyoji S, et al. Acute toxicity of fatty acids to the freshwater. Green alga selenasrum capricornutum [J]. Physiol. Plantarum, 2002,114:422-428.
[17] Cheng S P,Wu Z B, Xia Y Z. Review on gas exchange and transportation in macrophyte [J]. Acts Hydrobiologica Sinica, 2003,27:413-417.
[18] 李正魁,濮培民.预辐射聚合固定化增殖氮循环细菌 SBR法净化富营养化湖泊水体 [J]. 核技术, 2001,24(8):674-679.
[19] Soonmo An,Samantha B. Enhancement of coupled nitrificationdenitrification by benthic photosynthesis in shallow estuarine sediments [J]. Limnol. Oceanogr, 2001,46(1):62-74.
[20] Christensen P B, Revsbech N P, Sand-Jensen K. Microsensor analysis of oxygen in the rhizosphere of the aquatic macrophyte Littorella unifloru (L.) Ascherson [J]. Plant Physiology, 1994,105: 847-852.
Study of Elodea nuttallii-immobilized nitrogen cycling bacteria restoration in an inflow river channel of water source, Taihu Lake.
WANG Yi-chao, LI Zheng-kui*, ZHOU Li, FAN Nian-wen, FENG Lu-lu (State Key Laboratory of Pollutant Control and Resources Reuse, School of Environment, Nanjing University, Nanjing 210046, China). China Environmental Science, 2012,32(3):510~516
Nitrogen cycling bacteria, including ammonifying bacteria, nitrobacteria, nitrosobacteria and denitrifying bacteria were screened and immobilized to the porous carries from nature water of Jinshu Bay, Taihu Lake. The restoration effect of Elodea nuttallii-Immobilized Nitrogen Cycling Bacteria (INCB) assemblage technology applied in one of the inflow river channels of Jinshu bay water source, Taihu Lake was studied in autumn and winter. Lab ecological restoration simulation and in situ enclosure experiment demonstrated that Elodea nuttallii-INCB assemblage technology has better water quality improvement ability than either use INCB or Elodea nuttallii separately. We applied this technology in the inflow river channel water restoration and TN concentration reduced 5.9%~61.2%, NO3-concentration reduced 6.1%~68.0% and COD concentration reduced 4.2%~78.5% during the experiment process. The result also showed nitrogen bacteria quantities increased significantly after releasing INCB, and the MPN values of denitrifying bacteria in the enclosure was 3~4 order of magnitudes higher than the comparison water. There is significant difference between them (P<0.01). In situ enclosure experiment lasted for five months showed Elodea nuttallii-INCB assemblage technique can efficiently decrease inflow river nutrient loading and is helpful in water source eutrophication control in autumn and winter.
eutrophication;inflow river;Elodea nuttallii-INCB assemblage;restoration;MPN
X703.5
A
1000-6923(2012)03-0516-07
2011-07-04
江苏省自然科学基金资助项目(BK2010056);国家水体污染控制与治理科技重大专项(2008ZX07101-012,2008 ZX07101-004)
* 责任作者, 教授, zhkuili@nju.edu.cn
王易超(1982-),男,江苏无锡人,南京大学环境学院硕士研究生,主要从事水污染控制研究.
