混凝过程中微絮体形貌的AFM液池成像观测与表征
2012-12-20葛小鹏中国科学院生态环境研究中心环境水质学国家重点实验室北京100085
郑 蓓,葛小鹏 (中国科学院生态环境研究中心,环境水质学国家重点实验室,北京 100085)
混凝过程中微絮体形貌的AFM液池成像观测与表征
郑 蓓,葛小鹏*(中国科学院生态环境研究中心,环境水质学国家重点实验室,北京 100085)
采用扫描探针显微镜液池成像技术,对混凝过程中絮体的微观形貌进行了观测与表征.结果表明,原子力显微镜液池成像技术可以对混凝过程中的微絮体进行形貌表征和数字描述,并证实在实际印染工业尾水的微絮凝过滤试验处理过程中,微絮凝时间为2min,搅拌强度为100s-1时可以达到优化的处理效果.这也说明液池成像技术能够较好的反映混凝过程中微絮体的形貌变化特征,从而实现对环境微观界面过程的原位观测与表征.
原子力显微镜;混凝;液池成像;环境微界面
原子力显微镜自1986年首次发明并投入商业应用以来,因其具有独特的高分辨成像能力(可在原子、分子水平及亚微观即介观水平上进行观测),观察样品不受样品导电性限制,并可在大气、真空等环境条件下进行成像观察等优点,在生物医学、高分子材料、纳米材料及表面科学(如半导体材料、催化剂等)以及原子、分子操纵和纳米加工等领域得到了广泛应用[1-13].
原子力显微镜常见的工作环境一般是大气环境条件下进行成像,但在一些特定的场合,需要将样品放置在液体中进行扫描观察,如研究蛋白质分子等生物体试样时,必须在液态环境下才能保持其生物活性;对于表面亲水性的物质,样品表面吸附的水膜产生的表面张力会影响测量结果,甚至造成探针及观测样品表面的损坏,将针尖和样品浸在液体中进行成像观测可以消除表面张力的影响;还有一些在空气中极易被氧化的物质,若暴露在大气中测量,则测出的是那层氧化膜的形貌而不是物质的真实表面形貌;此外,在研究许多化学反应或电化学反应时,同样需要将样品放置于液体中进行扫描以进行原位实时成像观测[14].目前扫描探针技术在环境领域主要用于大气环境中对某一时间点下的颗粒物形貌表征,对液相条件下水体颗粒物形貌表征及其环境微观界面过程观测方面则涉及较少.
混凝是工业废水和生活污水处理工艺过程中最基本也是极为重要的操作单元[15-16].混凝剂与水体颗粒物等作用所形成的絮体是混凝工艺过程的产物,其微观结构特征对混凝工艺的操作性能具有重要的影响.但是,由于絮体中含有大量水分,在干燥过程中往往会由于水分的流失导致其形貌结构发生变化,形成枯枝状而严重失真,从而给混凝微观作用机理和工艺评价研究带来困扰.常规成像观测手段,例如扫描电镜和透射电镜等其制样技术一般都需要先进行样品的干燥处理,去除其水分,有时甚至还要抽真空,并进行喷金或碳的表面修饰处理以增加样品的导电性才能进行高分辨成像观测.上述样品制备技术对混凝过程絮体形貌结构研究与表征存在较大缺陷.即便是采用原子力显微镜观测,传统的手段也是将样品干燥后在大气环境中进行扫描成像,而目前国内外用原子力显微镜进行溶液环境条件下样品观测时,普遍采用的方法是将液滴直接滴至云母片或其它基底上,然后在大气环境下将探针伸入液滴内扫描成像.由于探针及其检测光路极易受液滴表面张力的影响,同时液滴表面形状不断变化而影响反射光路,成像条件往往不能保持稳定一致,导致观测结果存在一定的随意性,这种操作方法本身的严谨性较差[14].
本研究采用原子力显微镜液池成像技术对混凝过程中形成的微絮体形貌和环境微观过程进行观测实验研究,以探讨原子力显微镜在环境微观领域中应用的可行性及推广应用前景.
1 材料与方法
1.1 试剂与材料
选取某印染企业尾水进行实验研究,絮凝剂采用聚合氯化铝(PAC),其 Al2O3含量为 10%,盐基度73.69%.尾水水质特征:COD为105mg/L;浊度为35NTU;色度为60倍;总磷为2.068mg/L.
1.2 仪器条件与实验流程
实验仪器使用 Nanoscope IIIa Multimode SPM 型原子力显微镜(Digital Instrument, Co.),采用接触模式扫描成像,Si3N4探针长度 200µm,力常数0.12N/m.图1为Si3N4探针及试验所用成像液池的俯视图.
实验装置流程如图2所示.混凝试验采用工业上常用的条件:250 r/min搅拌 1min;加药,200 r/min搅拌反应不同时间,快速混凝结束后将水样经硅胶管直接流入样品液池,并通过阀门控制调节液池流量,进行不同混凝条件下的微絮体形貌结构观测.首先选取混凝(快搅)时间为1min时的絮体进行溶液条件下和大气环境下形貌观测对比,之后分别在混凝过程中3个时间点1,2,3min和3种不同搅拌强度40,100,170s-1下进行液池成像观测.

图1 Si3N4探针与成像液池的俯视图Fig.1 The top view of Si3N4 probe and the fluid cell
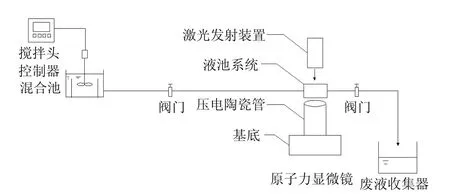
图2 混凝过程中絮体微观形貌的AFM液池成像观测实验装置示意Fig.2 Diagram of the setup for AFM fluid imaging of microflocs in the coagulation process
2 结果与讨论
2.1 原子力显微镜在溶液以及大气环境条件下对絮体形貌观测结果的对照
为了在溶液条件下真正地做到对环境样品的稳定成像观测,在原子力显微镜系统中引入了液池(图1).液池选用具有耐酸、耐碱、不易腐蚀的有机玻璃材质制成,以满足其盛放不同性质液体环境介质条件之需要.液池呈长、宽为3cm见方,厚度为5mm的长方体,通体透明可视.液池安装在一个可二维移动调节的位移样品台上,其上表面为透明的有机玻璃,用于激光光源及检测光路系统的光学通路.液池下表面中心区域有一环形凹槽,用于安放O型密封圈,其内部围成的圆形区域设有一微型金属弹簧夹,用于固定扫描探针.液池下端的 O型圈与样品台表面围成一个密闭的空间,用于存放成像时的液体环境介质.液池侧面一侧有两个孔洞及管路与液池的密闭液层相通,并通过两根硅胶管及止回阀与外界相连,样品从一端进入密闭体系,当充满整个体系空间后,由另一端流出.扫描成像时,液池的样品表面处于一个完全密闭的液体环境中,以防止空气进入.这样就使得光路不经过气-液界面折射,而是经由气-固和固-液界面进入反馈系统,因此即使液面抖动,也不会影响到检测光路的稳定性.同时,使液体表面张力作用于有机玻璃质周边,减少了对探针的干扰.使用液池进行形貌测量时,进样过程中特别是在通入液体样品的初始阶段往往会有气泡夹杂其中,依附在样品表面影响成像观测的进行.为此,我们通过大量实验摸索出“快速进样”的方法,利用液体的快速流动来带走样品表面粘附的气泡,从而有效防止气泡对测试过程的不利影响,提高了成像观察的效率.
图 3表示的是大气环境条件下絮凝时间为1min时的絮体形貌观测结果,此时的絮体严格意义上讲,并不是真正的絮体,只是生长的初级阶段,因此也称为微絮体.由于受制样条件的制约絮体经过干燥,只剩下残片,无法观测到其真实形貌.
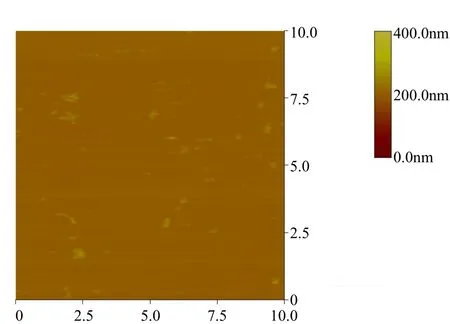
图3 气相条件下絮凝时间为1 min时的微絮体形貌Fig.3 Image of microflocs at 1 min of the flocculation time under the atmosphere conditions
图 4表示的是溶液环境条件下絮凝时间为1min时的絮体形貌观测结果.在混凝的过程中取1min快搅时间点的水样快速流入液池,并关闭液池管道两端的阀门后立即进行扫描成像观测.通过仪器厂家提供的截面分析处理的图像后处理软件可以测量出絮体的粒径大约在 150~550nm之间,均匀分布在溶液中.这为进一步深入研究不同混凝剂与颗粒物或有机物作用机理提供了直观的表征手段.
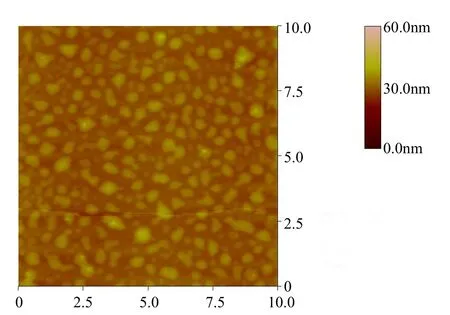
图4 液相条件下絮凝时间为1min时的微絮体形貌Fig.4 Image of microflocs at 1min of the flocculation time under fluid imaging conditions
2.2 原子力显微镜在溶液环境下对不同时间点絮体的形貌表征
关于絮体成长方面的研究,比较常用的方法是利用激光粒度分析仪对其粒径分布进行在线监测[17],根据激光光束在絮体颗粒表面散射信号的强弱进行粒径大小及其分布的描述.它可以反映出絮体从最初生长开始直至生长结束时的全过程,但所得到只是絮体粒径大小及其分布的数值描述.而应用原子力显微镜液池成像技术则可以实现对絮体形貌及粒径大小的直观观测.
图 5给出了液体环境中不同絮凝时间下微絮体的生长情况.由图可以看出,絮体最初形成期粒径在150~550nm(微絮凝时间1min)之间.随着混凝的进行,微絮体的平均粒径增至 200~800nm(微絮凝时间 2min),此时样品分布已不均匀,开始出现部分小的团聚.当混凝时间延长至3min时,微絮体的平均粒径已增至900nm~1.8μm,此时大部分微絮体发生团聚而形成絮体,整个微絮体的生长过程用形貌和粒径大小完整的展现了出来.

图5 液池成像条件下不同微絮凝时间絮体的微观形貌观测结果对比Fig.5 Comparison between the morphological images of microflocs by AFM fluid imaging at the different flocculation times of 1 min, 2 min and 3 min, respectively
2.3 原子力显微镜对不同搅拌强度下絮体破碎情况的观测.
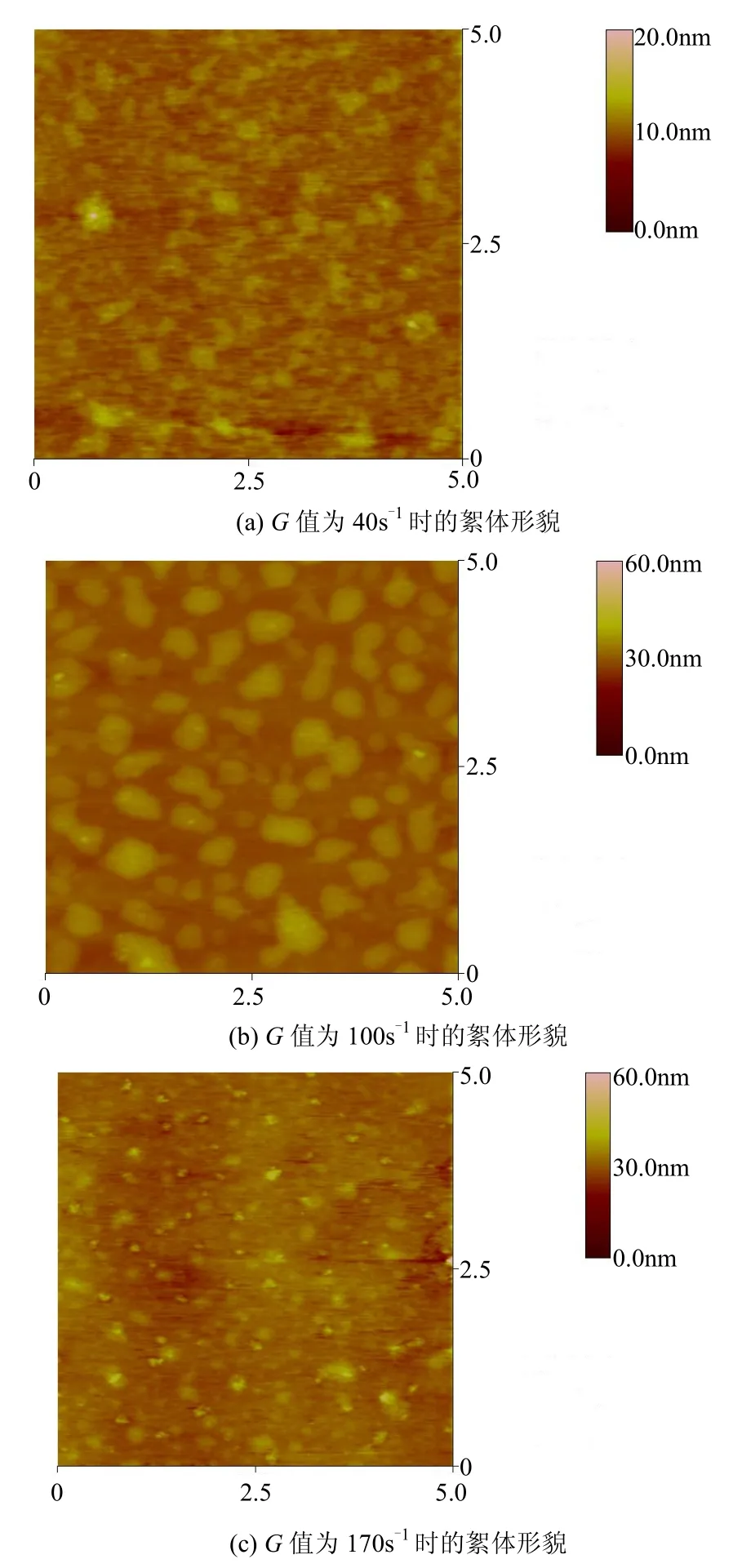
图6 液池成像条件下,不同G值时絮体的微观形貌观测结果Fig.6 Comparison between the morphological images of microflocs by AFM fluid imaging at the different G values of 40, 100 and 170s-1, respectively
速度梯度(G值)对微絮体生长过程有重要影响.合适的G值可以使絮凝剂的作用得以充分发挥,从而大幅提高絮凝效果[18].例如,PAC之类的无机高分子絮凝剂在絮凝过程中主要以架桥和表面吸附作用为主,当其进入水体后的瞬间需要强烈搅拌,使之迅速而均匀地分散于水体中,促使微絮体快速形成.而在絮凝体形成之后,搅拌速度过快,则会将形成的絮凝体打碎形成细小的颗粒物而不易被滤料截留,从而降低絮凝效果[18].为此,对不同G值条件下形成的絮体使用原子力显微镜进行了液相观测,混凝时间控制在1min.图6给出了不同G值条件下絮体形貌的观测结果.可以看出,G值较小如40s-1时絮体尚未形成,此时观察到的只是絮体生长初期的形貌;当G值过大如170s-1时,形成的絮体则被打碎成了细小的絮体颗粒;而G值为100s-1时絮体生长较好, 粒径最大.通过对不同G值条件下絮体粒径大小的测量,可以得到:在此实验条件下絮体未发生破碎时,其粒径可达 200~800nm,发生絮体破碎情况下粒径则降为60~250nm.
3 结论
3.1 对混凝过程中絮体的微观结构形貌的AFM 液池成像观测与表征结果表明, 在液体环境条件下进行扫描成像能够较好的反映出絮体样品本身的形貌结构特征.
3.2 利用液池成像技术对混凝过程中絮体的成长以及搅拌强度G值的增加导致絮体破碎等情况进行直接观测,可以对混凝工艺条件的优化提供很好的基础数据,因而具有广阔的应用前景.
[1] Yang Jie, Shao Zhifeng. Recent advances in biological atomic force microscopy [J]. Micron., 1995,26(1):35-49.
[2] Ikai A. STM and AFM of bio/organic molecules and structures [J]. Surface Science Reports, 1996,26:261-332.
[3] Li M Q. Scanning probe microscopy (STM/AFM) and applications in biology [J]. Appl. Phys., 1999,A68:255-258.
[4] Yip C M. Atomic force microscopy of macromolecular interactions [J]. Current Opinion in Structural Biology, 2001,11(5): 567-572.
[5] 鲍幸峰,方积年.原子力显微镜在生物大分子结构中的应用进展[J]. 分析化学, 2000,28(10):1300-1307.
[6] 张亦奕,牟建勋,劭志峰.原子力显微镜在结构生物学中的应用[J]. 电子显微学报, 1996,15(2-4):314-328.
[7] 屈小中,史焱,金熹高.原子力显微镜在高分子领域的应用 [J].功能高分子学报, 1999,12(2):218-224.
[8] Muster J, Duesberg G S, Roth S, et al. Application of scanning force microscopy in nanotube science [J]. Appl. Phys., 1999, A69:261-267.
[9] 白春礼,林 璋.扫描探针显微学在材料表面纳米级结构研究中的新进展 [J]. 物理, 1999,28(1):27-30.
[10] Oesterschulze Egbert. The potential of the scanning probe microscopy for thin film characterization [J]. Surface and Coatings Technology, 1997,97(1-3):694-706.
[11] Gaigneaux E M. Application of scanning probe microscopies to oxide catalysts [J]. Current Opinion in Solid State and Materials Science, 1998,3(4):343-353.
[12] 谢敬伟,暴宁钟,陆小华.扫描探针显微技术在 TiO2表面研究中的应用 [J]. 化学通报, 2002,(7):445-451.
[13] 张 益,陈圣福,欧阳振乾,等.单个DNA分子的拉直操纵和成像[J]. 科学通报, 2000,45(5):490-493.
[14] 张 虎.液相型原子力显微镜的研制及其应用研究 [D]. 杭洲:浙江大学, 2004:3-4,66-67.
[15] Holmström K E, Järnberg U, Bignert A. Temporal trends of PFOS and PFOA in guillemot eggs from the Baltic Sea, 1968–2003 [J]. Environ. Sci. Technol., 2005,39(1):80-84.
[16] Moody C A, Martin J W, Kwan W C, et al. Monitoring perfluorinated surfactants in biota and surface water samples following an accidental release of fire-fighting foam into Etobicoke Creek [J]. Environ. Sci. Technol., 2003,36(4):545-551.
[17] Yu Jianfeng, Wang Dongsheng, Ge Xiaopeng, et al. Flocculation of kaolin particles by two typical polyelectrolytes: A comparative study on the kinetics and floc structures [J]. Colloids and Surfaces A, 2006,290(1-3):288-294.
[18] 郑 蓓,葛小鹏,桑燕鸿,等.微絮凝直接过滤用于印染尾水回用的可行性研究 [J]. 给水排水, 2011,37(11):143-148.
Characterization of microflocs for the coagulation optimization by AFM fluid imaging.
ZHENG Bei, GE Xiao-peng*(State Key Laboratory of Environmental Aquatic Chemistry, Research Center for Eco-Environmental Sciences, the Chinese Academy of Sciences, Beijing 100085, China). China Environmental Science, 2012,32(3):473~477
Atomic force microscopy (AFM) was applied to characterize the morphological changes of microflocs in the coagulation process. By the use of AFM fluid imaging technique, optimized operational conditions for 2 min of mirco-flocculation time and 100 s-1of the agitation intensity (G value) were obtained in the Micro-Flocculation Filtration of dye-printing industrial tailing wastewater with good performance. It was demonstrated that AFM fluid imaging can be exploited as a useful tool in the in-situ observation and measurement in micro-interfacial processes of the environmental concern.
atomic force microscope;coagulation;fluid cell imaging;environmental micro-interface
X703.5
A
1000-6923(2012)03-0473-05
2011-06-10
国家自然科学基金项目(20677073)
* 责任作者, 副研究员, xpge@rcees.ac.cn
郑 蓓(1981-),男,河北石家庄人,助理工程师, 硕士,主要从事水处理吸附絮凝工艺的研究.发表论文8篇.
