MTT法检测没食子酸对两种细胞的体外毒性
2012-12-17严晓莺陈巨鹏王明艳
严晓莺,陈巨鹏,王明艳
(1.南京中医药大学,江苏 南京 210046,2.江苏省中医院,江苏 南京 210029)
没食子酸(gallic acid,GA)又名五倍子酸,化学名3,4,5-三羟基苯甲酸,是一种多酚类化合物,广泛存在于中草药山茱萸、五倍子、芍药[1]及植物葡萄、石榴的果皮中。GA可以抑制多种肿瘤细胞增殖并诱导其凋亡[2-3],但是对正常细胞的毒性研究报道并不多见。本实验选用MTT实验检测GA对体外生长的人正常肝细胞株LO2和人肝癌细胞株SMMC-7721增殖的影响,为其开发为新药提供理论依据。
1 材料
1.1 药品
没食子酸(GA,分子量170,中国药品生物制品检定所,批号110831-200803);顺铂(DDP,齐鲁制药有限公司,批号0070332DC)。
1.2 细胞株
人正常肝细胞株 LO2、人肝癌细胞株 SMMC-7721均由本实验室提供。
1.3 试剂
RPMI-1640培养液、胎牛血清(FBS)、小牛血清(NBS)(GIBCO公司);乙二胺四乙酸(EDTA)(SOLARBIO公司);磷酸缓冲盐(PBS)(博士德公司);溴化二甲噻唑二苯四氮唑(MTT)、二甲基亚砜(DMSO)(AMRESCO公司)。
1.4 仪器
图像获取系统(OlympusDP71);倒置显微镜(MoticAE31);全自动酶标仪(Bio-Rad680723);超低温冰箱(MDF-382ECM);CO2恒温培养箱(日本SANYO);超净工作台(苏州净化设备有限公司);电热恒温水浴箱(上海精宏实验设备有限公司);电子分析天平(AY220,日本岛津)。
2 实验方法
2.1 药液的配制
精确精密称取没食子酸17mg,生理盐水定容至10ml充分溶解,配成浓度为10mmol/L的储存液,0.22um滤器过滤除菌,-20℃避光保存,临用前用培养液稀释至实验所需的终浓度。
2.2 细胞培养
复苏冻存的细胞,离心去除冻存液,加入含10%血清的RPMI-1640培养液(pH值7.2),于37℃饱和湿度、5%CO2孵箱中静置培养。细胞生长到80%后,加入 1ml消化液(含 0.02%EDTA,0.25%胰酶)消化,待细胞变圆,间隙增大时,弃消化液,加入2ml培养液终止消化,轻轻吹打制成单细胞悬液,LO2按1/4比例传代,SMMC-7721按1/8比例传代,每3~4天传1次。
2.3 MTT 检测[4]
分别取对数生长期的LO2细胞和SMMC-7721细胞制成密度为5×104个/ml的细胞悬液,每孔100μl接种于96孔板中培养。分为阴性对照组、不同剂量加药组和阳性对照组,每组设5个平行孔,细胞贴壁以后,弃去旧的培养液,更换新的培养液,加药组培养液含有 GA,终浓度分别为 6.25、12.5、25、50、100μmol/L,阳性对照组培养液含有顺铂,终浓度为5μg/ml。药物作用细胞后 24h、48h、72h,取出培养板,每孔加入 5mg/ml的 MTT 10μl,混匀,继续培养 4h,弃去上清液,每孔加入100μl DMSO,震荡10min使结晶充分溶解,酶标仪测每孔吸光度,波长490nm。抑制率(%)=1-用药组OD值/阴性对照组OD值×100%。
2.4 统计学处理
使用SPSS 13.0进行单因素方差分析(One way ANOVA),实验数据以均数±标准差(±s)表示,P<0.05为差异具有统计学意义。
3 结果
不同剂量的GA作用24h、48h、72h对体外培养的LO2和SMMC-7721细胞均有一定的抑制作用。
3.1 GA对LO2细胞的生长的影响
6.25 、12.5、25、50、100μmol/L 剂量组与阴性对照组相比有显著性差异(P<0.05),对LO2细胞有增殖抑制作用,且呈剂量依赖关系,25、50、100μmol/L浓度组对LO2细胞的抑制随作用时间的延长而升高,呈现时间依赖关系(见表1)。
表1 没食子酸作用24、48、72h对LO2细胞增殖的影响(±s)
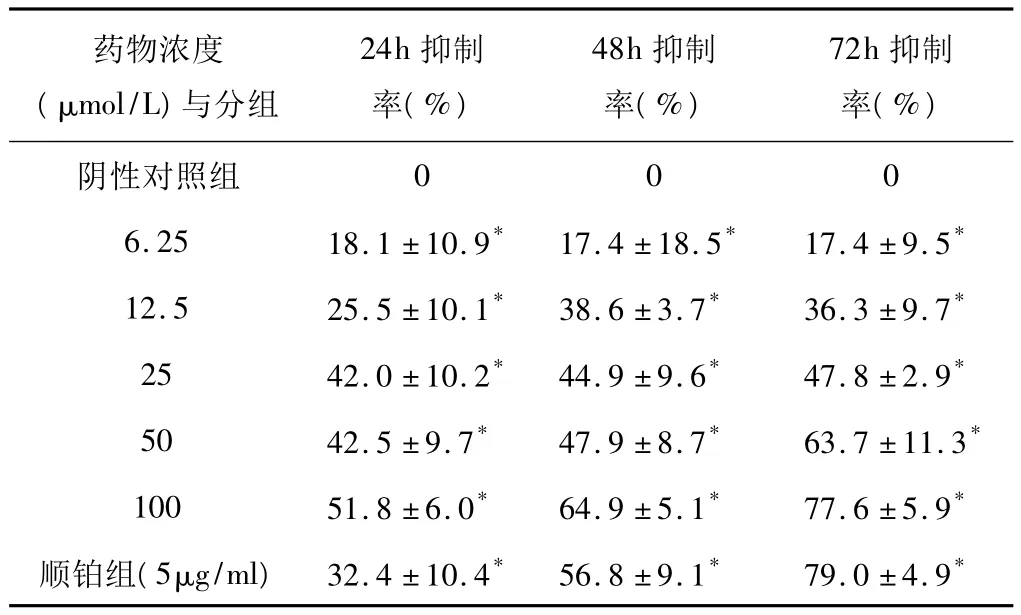
表1 没食子酸作用24、48、72h对LO2细胞增殖的影响(±s)
注:与阴性对照组比较,*P <0.05。
药物浓度(μmol/L)与分组24h抑制率(%)48h抑制率(%)72h抑制率(%)阴性对照组0006.25 18.1 ±10.9* 17.4 ±18.5* 17.4 ±9.5*12.5 25.5 ±10.1* 38.6 ±3.7* 36.3 ±9.7*25 42.0 ±10.2* 44.9 ±9.6* 47.8 ±2.9*50 42.5 ±9.7* 47.9 ±8.7* 63.7 ±11.3*100 51.8 ±6.0* 64.9 ±5.1* 77.6 ±5.9*顺铂组(5μg/ml)32.4 ±10.4* 56.8 ±9.1* 79.0 ±4.9*
3.2 GA对SMMC-7721细胞的生长的影响
6.25 、12.5、25、50、100μmol/L 剂量组与阴性对照组相比有显著性差异(P<0.05),对SMMC-7721细胞有增殖抑制作用,且呈剂量依赖关系,各浓度组对细胞的抑制率随时间延长而增高,呈现时间依赖关系(见表2)。
表2 没食子酸作用24、48、72h对MMC-7721细胞增殖的影响(±s)
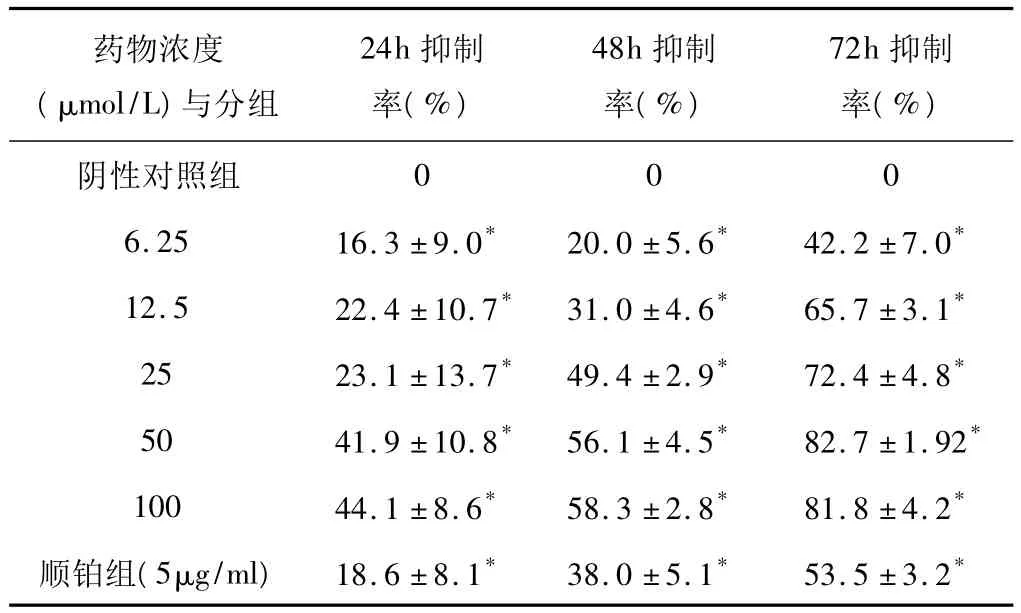
表2 没食子酸作用24、48、72h对MMC-7721细胞增殖的影响(±s)
注:与阴性对照组比较,*P <0.05。
药物浓度(μmol/L)与分组24h抑制率(%)48h抑制率(%)72h抑制率(%)阴性对照组0006.25 16.3 ±9.0* 20.0 ±5.6* 42.2 ±7.0*12.5 22.4 ±10.7* 31.0 ±4.6* 65.7 ±3.1*25 23.1 ±13.7* 49.4 ±2.9* 72.4 ±4.8*50 41.9 ±10.8* 56.1 ±4.5* 82.7 ±1.92*100 44.1 ±8.6* 58.3 ±2.8* 81.8 ±4.2*顺铂组(5μg/ml)18.6 ±8.1* 38.0 ±5.1* 53.5 ±3.2*
3.3 GA对LO2和SMMC-7721细胞影响的比较
由图1-3可以看出,没食子酸对LO2和SMMC-7721 都有增殖抑制作用;作用 24h 时,6.25、12.5、25、100μmol/L剂量组对LO2细胞的抑制高于SMMC-7721,50μmol/L剂量组对两种细胞的抑制相仿;作用48h后,25、50μmol/L剂量组对 SMMC-7721细胞抑制率开始高于对LO2细胞的抑制;作用72h后,6.25、12.5、25、50μmol/L 剂量组对 SMMC-7721 细胞的抑制率明显高于对LO2细胞的抑制,对二者抑制率的差距增大,但100μmol/L剂量组对LO2细胞的抑制还是与对SMMC-7721的抑制接近。
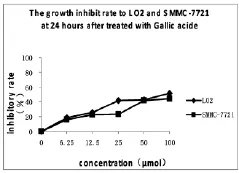
图1 没食子酸作用24h对两种细胞增殖抑制

图2 没食子酸作用48h对两种细胞增殖抑制
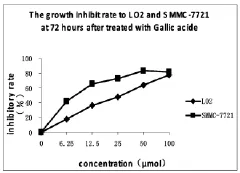
图3 没食子酸作用72h对两种细胞增殖抑制
综上可知,GA对LO2细胞和AMMC-7721细胞均有抑制作用;50μmol/L剂量组的GA对LO2的抑制较小,而对SMMC-7721的抑制较大。
4 讨论
原发性肝癌(简称肝癌)为常见的恶性肿瘤之一,其发病率和死亡率呈逐年上升的趋势,严重威胁着人类健康和生命。该病发病早期无特异性表现,大部分患者就诊时已处于中晚期阶段,现行的常规的治疗手段效果不甚理想。中医药治疗肝癌在稳定病灶、延长生存时间、改善生存质量等方面发挥了显著的疗效,不仅单用有效,而且可与手术、放疗、化疗联合运用提高临床疗效和减少毒副反应。
GA作为天然植物中提取的多酚类化合物具有抗氧化、抗自由基作用。然而在金属离子存在的情况下GA表现为强氧化剂的作用[5],促进细胞 DNA的损伤,诱导其凋亡,而这种损伤是可以被过氧化氢酶阻止[6]。有研究表明,细胞内过氧化氢酶在细胞中的含量高低决定了对GA的敏感性不同[7],近年来GA的抗肿瘤作用越来越受到人们的重视。
鉴于绝大多数的化疗药物对正常细胞杀伤作用也很大,我们采用MTT实验检测GA对正常肝细胞和肝癌细胞的增殖抑制作用,期望能为寻找有效的减毒增效拮抗剂提供线索。结果表明,抗肿瘤单体GA对LO2和SMMC-7721细胞均有一定的毒性,表现为增殖抑制作用,作用早期(24h)对LO2的抑制大于对SMMC-7721的抑制,连续作用后(48h、72h),对SMMC-7721细胞的损伤明显超过对LO2的抑制。综上所述,在充分发挥GA抗肿瘤作用的情况下,如何降低其对正常细胞的影响,需要进一步研究。
[1] 李玉东,刁勇,王立强.芍药及其有效成分抗肿瘤作用的研究进展[J].海峡药学,2009,21(12):27-32.
[2] Lo C,Lai TY,Yang JS,et al.Gallic acid inhibits the migration and invasion of A375.S2 human melanoma cells through the inhibition of matrix metalloproteinase-2 and Ras[J].Melanoma Res,2011,21(4):267-273.
[3] You BR,Kim SZ,Kim SH,Gallic acid-induced lung cancer cell death is accompanied by ROS increase and glutathione depletion[J].Mol Cell Biochem,2011,357(1-2):295-303.
[4] 梁颖,张晓莉,陶冀,等.红花多糖对人肝癌SMMC-7721细胞增殖的抑制作用[J].中医药学报,2011,39(5):32-35.
[5] Inoue M,Suzuki R,Sakaguchi N,et al.Selective induction of cell death in cancer cells by gallic acid[J].Biol Pharm Bull,1995,18(11):1526-1530.
[6] Yoshino M,Haneda M,Naruse M,et al.Prooxidant action of gallic acid compounds:copper-dependent strand breaks and the formation of 8-hydroxy-2'-deoxyguanosine in DNA[J].Toxicol In Vitro,2002,16(6):705-709.
[7] Isuzugawa k,Inoue M,Ogihara Y.Catalase contents in cells determine sensitivity to the apoptosis inducer gallic acid[J].Biol Pharm Bull,2001,24(9):1022-1026.
