906株大肠埃希菌产超广谱β-内酰胺酶状况及耐药性分析
2012-12-09李南洋李健平张伟嫦
陈 捷,李南洋,李健平,张伟嫦
(肇庆市第一人民医院,广东 肇庆 526021)
·检验与临床·
906株大肠埃希菌产超广谱β-内酰胺酶状况及耐药性分析
陈 捷,李南洋,李健平,张伟嫦
(肇庆市第一人民医院,广东 肇庆 526021)
目的 了解大肠埃希菌产超广谱β-内酰胺酶(ESBLs)及其对常用抗菌药物的耐药情况,为临床抗感染治疗提供用药依据。方法 采用头孢他啶与头孢他啶/克拉维酸、头孢噻肟与头孢噻肟/克拉维酸的双纸片确证试验检测ESBLs,采用纸片扩散法(K-B法)检测大肠埃希菌对常用抗菌药物的耐药性。结果 2007年、2008年、2009年、2010年产ESBLs大肠埃希菌的检出率分别为38.65%、42.86%、43.28%和48.84%。大肠埃希菌对常用抗菌药物的耐药率以头孢哌酮/舒巴坦、亚胺培南、哌拉西林/他唑巴坦、阿莫西林/克拉维酸、头孢西丁、阿米卡星较低,其余抗菌药物的耐药率大多在50%以上,对氨苄西林和哌拉西林的耐药率甚至超过80%。结论 大肠埃希菌的耐药形势严峻,应加强其耐药性监测,合理使用抗菌药物,严格控制耐药菌的产生和医院感染暴发流行。
大肠埃希菌;超广谱β-内酰胺酶;抗菌药物;耐药性
大肠埃希菌是引起临床感染常见的革兰阴性杆菌,也是造成医院感染的主要致病菌,其对抗菌药物的耐药性日趋严重,尤其是超广谱β-内酰胺酶(ESBLs)引起产酶菌株对第三代头孢菌素和氨曲南耐药,这已经成为全球性难题[1]。因病原菌在不同地域、不同医院、不同时期对抗菌药物的耐药性有着不同的特点和明显的差异[2],为了解和掌握本院大肠埃希菌的耐药特性和产ESBLs菌株的发生率,为临床合理使用抗菌药物提供科学依据,并制定有效对策控制其传播和流行。本文对2007-2010年临床分离的906株大肠埃希菌的耐药性进行动态观察与分析,现报道如下:
1 资料与方法
1.1 标本来源 本院2007年1月至2010年12月从临床标本中分离出的大肠埃希菌906株。标本来源于本院住院病房、门诊送检的痰液、尿液、分泌物、血液及各种体液等。
1.2 菌株分离与鉴定 送检标本按《全国临床检验操作规程》第3版进行,菌株鉴定采用法国生物梅里埃产品ATB Expression及配套鉴定卡进行。
1.3 药敏试验方法 采用纸片扩散(K-B)法,药敏结果判读按美国临床实验室标准化协会(CLSI)2009年标准进行。质控菌株为大肠埃希菌ATCC25922和ATCC35218。
1.4 ESBLs的检测 采用双纸片法,在MH药敏平板上贴头孢他啶(30μg)、头孢他啶/克拉维酸(30μg/10μg)和头孢噻肟(30μg)、头孢噻肟/克拉维酸(30μg/10μg)。两种组合中任何一组加克拉维酸比不加克拉维酸的药敏纸片抑菌环直径相差≥5mm即为产ESBLs大肠埃希菌。
2 结果
2.1 产ESBLs大肠埃希菌的检出率 906株大肠埃希菌中检出396株产ESBLs菌株,平均检出率为43.71%;四年产ESBLs大肠埃希菌的检出率分别为38.65%、42.86%、43.28%和48.84%,经多个样本率的χ2检验,差异无统计学意义(χ2=4.991,P=0.172>0.05),见表1。
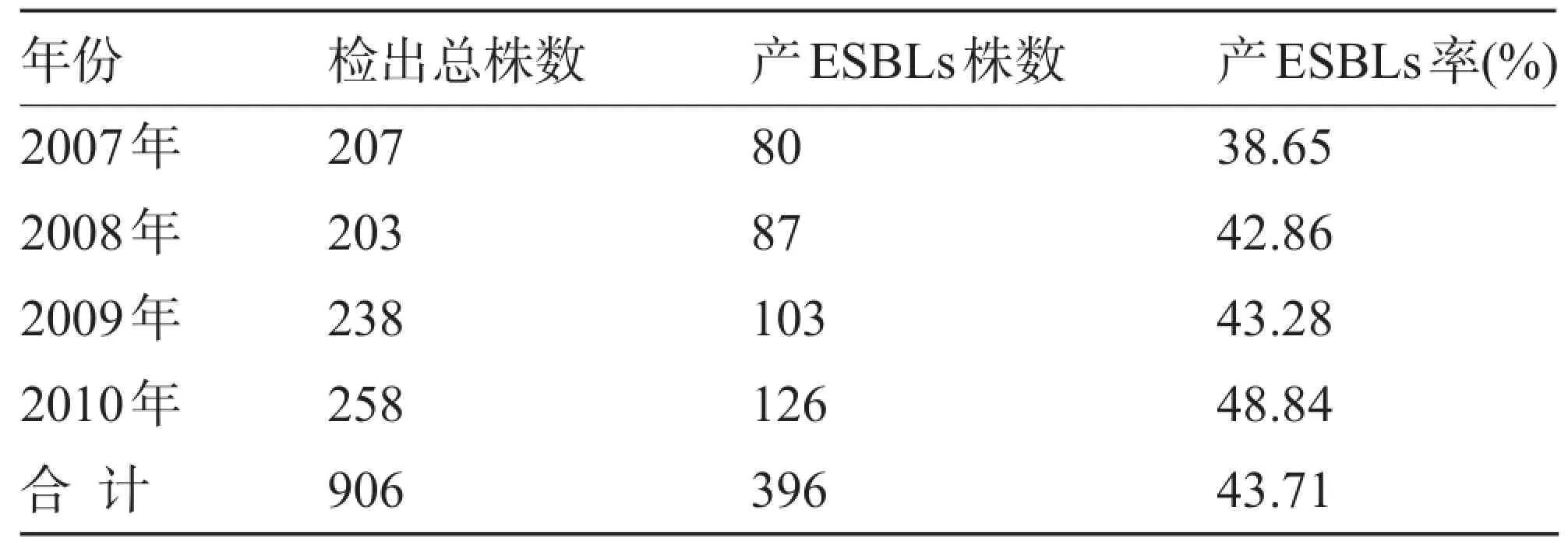
表1 大肠埃希菌产ESBLs情况(株)
2.2 标本来源分布情况 四年共检出大肠埃希菌906株,标本主要以痰、尿(含尿道拭子)和创面分泌物为主,构成比分别为38.85%、35.76%和11.48%,见表2。
2.3 大肠埃希菌的耐药情况 大肠埃希菌对常用19种抗菌药物的耐药率大多在50%以上,对氨苄西林和哌拉西林的耐药率甚至超过80%,仅对头孢哌酮/舒巴坦、亚胺培南、哌拉西林/他唑巴坦、阿莫西林/克拉维酸、头孢西丁、阿米卡星的耐药率较低,结果见表3。经χ2检验,除阿莫西林/克拉维酸(χ2=24.28,P<0.01)、头孢哌酮/舒巴坦(χ2=8.32,P<0.05)、头孢西丁(χ2=9.56,P<0.05)、氨曲南(χ2=8.57,P<0.05)和庆大霉素(χ2=11.64,P<0.01)这5种抗菌药物4年的耐药率差异有统计学意义外,其余14种抗菌药物4年的耐药率差异无统计学意义。
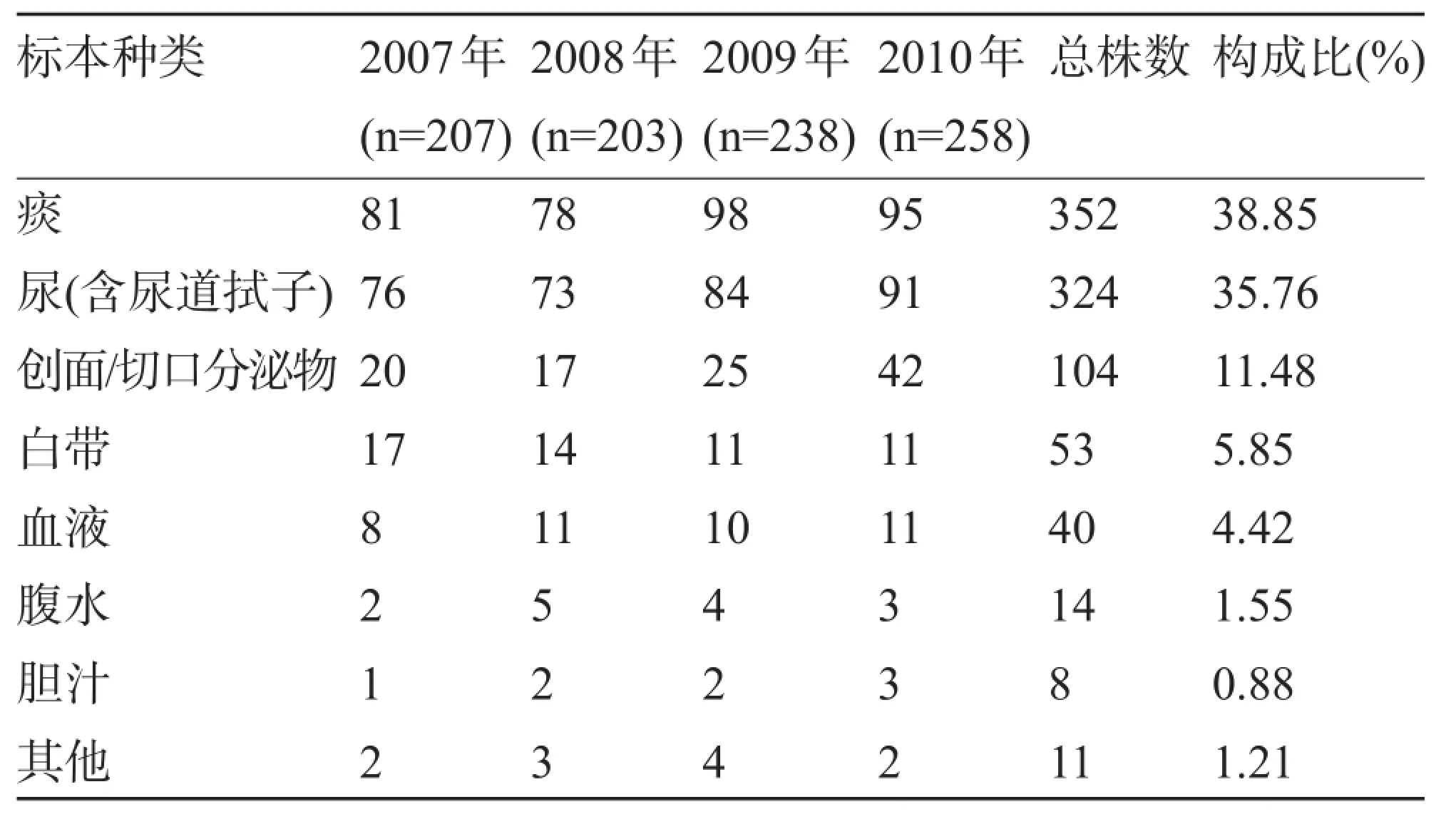
表2 906株大肠埃希菌标本来源分布情况(株,n=906)
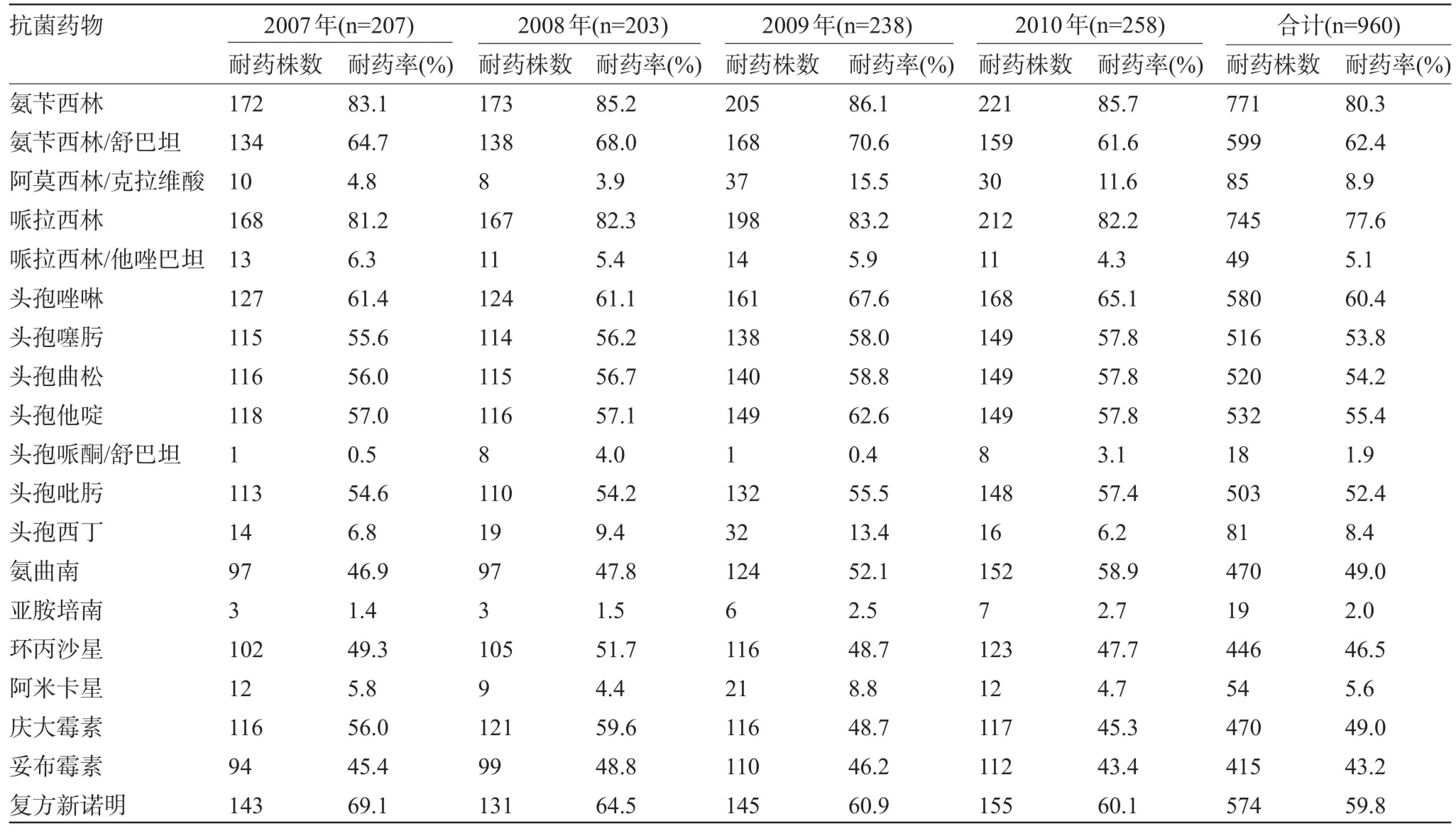
表3 大肠埃希菌对常用19种抗菌药物四年药敏试验监测结果
3 讨论
大肠埃希菌广泛分布于自然界,是人和动物肠道正常菌群的重要组成部分,是常见的医院感染病原菌。在人体抵抗力下降,或由于各种原因引起的肠道缺血、机体防御机制遭到破坏时,大肠埃希菌可发生易位,突破解剖或生理屏障而侵入肠道外的组织或器官,造成内源性感染。此外,在医院内还可通过患者之间、医务人员与患者之间的接触、呼吸道气溶胶吸入或各种侵入性诊疗操作如尿道插管、静脉导管而引起外源性感染[3]。本院大肠埃希菌主要来源于痰、尿(含尿道拭子)和创面分泌物,三者占总标本的86.09%,表明该菌主要引起呼吸道、泌尿道、创面和手术切口感染,与文献报道一致[4]。也与我院送检标本主要以痰、尿、分泌物为主,其余标本送检量较少有关,提示我们应继续加强培训,增强临床医生对感染患者相关标本的送检意识。
超产谱β-内酰胺酶(ESBLs)是肠杆菌科细菌对β-内酰胺类抗菌药物产生耐药的主要机制之一,其预防与治疗已成为临床医生需要面对的重要问题[5]。ESBLs是由质粒介导,能赋予细菌对多种β-内酰胺类抗菌药物耐药的一类酶,是引起医院感染的一个不可忽视的因素[6]。由于ESBLs编码质粒携带氨基糖苷类、喹诺酮类等抗菌药物的耐药基因,因此产ESBLs的菌株对其他多数抗菌药物(包括第4代头孢菌素)亦可能耐药,具有多重耐药性。《2006-2007Mohnarin细菌耐药监测报告》报道:全国大肠埃希菌产超产谱β-内酰胺酶为35.3%,中南地区最高达到55.2%,华北地区最低为23.6%,广东省划入中南地区进行监测,产超产谱β-内酰胺酶接近45%,明显高于国外10%~20%的水平。我院连续四年的产ESBLs大肠埃希菌检出率经多个样本率的χ2检验,差异无统计学意义,四年平均检出率为43.71%,与上述监测数据基本一致。
本组资料显示,大肠埃希菌对大多数被监测药物(β-内酰胺类、一代、二代、三代及四代头孢菌素)的耐药率在50%以上,甚至对碳青酶烯类也有耐药,属于高度耐药菌种。大肠埃希菌对含酶抑制剂的复方制剂的耐药率明显低于单独制剂,对氨苄西林、哌拉西林的平均耐药率为80.3%、77.6%,加入酶抑制剂后耐药率分别下降至62.4%和5.1%,对头孢哌酮/舒巴坦、阿莫西林/克拉维酸的平均耐药率为8.9%、1.9%,提示后三种β-内酰胺类/β-内酰胺酶抑制剂复方制剂对大肠埃希菌的抗菌作用较强,此类药物可首选用于产ESBLs大肠埃希菌所致的轻度至中度感染。大肠埃希菌对头孢西丁的平均耐药率为8.4%,头霉素类易诱导细菌产生诱导酶(AmpC酶),从而出现耐药;体外研究显示,头霉素类抗菌药物对产ESBLs细菌具有良好的抗菌作用,可以作为产ESBLs细菌的次选药物,也可以与氨基糖苷类抗菌药物等联合使用[7]。碳青酶烯类长期以来被临床作为抗感染治疗的最后一道防线,但也未避免细菌对其耐药,本资料显示大肠埃希菌对亚胺培南也表现出耐药,平均耐药率为2.0%,提示要切实加强对此类抗菌药物临床应用的管理和对大肠埃希菌的耐药性监测。大肠埃希菌对阿莫西林/克拉维酸、头孢哌酮/舒巴坦、头孢西丁、氨曲南和庆大霉素这5种抗菌药物4年的耐药率差异有统计学意义,有的呈现下降趋势,有的呈现上升趋势,其原因值得我们进一步的深入研究。
综上所述,我院大肠埃希菌的耐药形势严峻,抗菌药物的选择具有明显压力。有证据表明,不适当的抗菌治疗是产ESBLs细菌的独立预测因素,第三代头孢菌素经验性用药可导致更多产ESBLs细菌出现,从而引起产ESBLs细菌的流行[7]。细菌耐药性监测是临床了解细菌分布和耐药动态变化的重要途径,因此,要加强对产ESBLs大肠埃希菌的检测与耐药性监测,建立抗菌药物临床应用预警机制,强制执行抗菌药物控制策略与干预措施,严格落实临床各项消毒隔离制度,增强医务人员手卫生意识,严格无菌操作,减少侵袭性操作及加强医疗器械的消毒灭菌,从而有效控制产ESBLs大肠埃希菌的产生、播散与流行。
[1]熊自忠,朱德妹,汪 复,等.产超广谱β内酰胺酶大肠埃希菌中SHV型β内酰胺酶的分子生物学研究[J].中国抗感染化疗杂志,2003,3(4):194-198.
[2]胡小春.中医院大肠埃希菌的耐药性变迁[J].中华医院感染学杂志,2009,19(2):214-216.
[3]徐秀华.临床医院感染学[M].长沙:湖南科学技术出版社,1998:304.
[4]李晓云,梁立全.557株大肠埃希菌耐药性分析[J].中国药房,2011,22(26):2458-2460.
[5]Song KH,Leon JH,Park WB,et al.Clinical outcomes of spontaneous bacterialperitonitis due to extended-spectrum beta-lacta-mase-producing Escherichia coli and Klebsiella species:a retrospective matched case-control study[J].BMC Infect Dis,2009,9:41.
[6]胡冬梅,陈世平.超广谱β-内酰胺酶与医院感染的关系[J].中华医院感染学杂志,2000,10(3):238-240.
[7]产超广谱β-内酰胺酶细菌感染防治专家委员会.产超广谱β-内酰胺酶细菌感染防治专家共识[J/CD].中华实验和临床感染病杂志(电子版),2010,4(2):207-214.
Analysis on the production of extended-spectrum β-Lactamases and drug-resistance of 906strains of Escherichia coli.
CHEN Jie,LI Nan-yang,LI Jian-ping,ZHANG Wei-chang.The First People’s Hospital of ZhaoqingCity,Zhaoqing 526021,Guangdong,CHINA
Objective To explore the production of extended spectrumβ-lactamases(ESBLs)byEscherichia coli(E.coli)and the drug resistance ofE.colito commonly used antibiotics,and to provide reference for clinical anti-infective drug therapy.Methods Ceftazidime and ceftazidime plus clavulanic acid,cefotaxime and cefotaxime plus clavulanic acid in the double disk confirmatory test were adopted to detect ESBLs.K-B disk diffusion assay was used to determine antibiotic resistance ofE.coli.Results The detection rates ofE.coliESBLs were 38.65%,42.86%,43.28%and 48.84%from 2007to 2010,respectively.Antibiotic resistance rate ofE.coliwas low to ceforerazone/sulbactam,imipenem,piperacillin/tazobactam,amoxicillin/clavulanic acid,cefoxitin and amikacin,and the resistance rates to other antibiotics tested were mostly more than 50%.Conclusion The drug resistance status ofE.coliis severe.We should strengthen the drug-resistance monitoring ofE.coliand the management of antibiotics use to control the spread and prevalence of the drug-resistant bacteria.
Escherichia coli;Extended spectrumβ-lactamases(ESBLs);Antibiotics;Drug resistance
R446.5
A
1003—6350(2012)16—117—03
10.3969/j.issn.1003-6350.2012.16.050
陈 捷(1973—),女,广东省罗定市人,主管检验技师,学士。
2012-04-07)
