红曲霉液态发酵多糖工艺条件的优化
2012-12-07伍健萍王昌禄陈勉华王玉荣李风娟
伍健萍, 王昌禄, 陈勉华, 王玉荣, 李风娟
(天津科技大学食品营养与安全教育部重点实验室/食品工程与生物技术学院,天津 300457)
红曲霉液态发酵多糖工艺条件的优化
伍健萍, 王昌禄, 陈勉华, 王玉荣, 李风娟
(天津科技大学食品营养与安全教育部重点实验室/食品工程与生物技术学院,天津 300457)
研究了红曲霉产多糖的液态发酵条件,得出优化后的培养基组成为:蔗糖45 g/L,酵母粉4.5 g/L,KH2PO4·3H2O 3.5 g/L,MgSO4·7H2O 0.85 g/L.通过单因素实验和正交试验,得到红曲霉N产多糖的优化发酵工艺条件为:种龄30 h,接种量7.5%,发酵培养基初始pH 5.75,装液量162.5 mL/1 000 mL三角瓶,发酵时间84 h.在此条件下,红曲霉液态发酵的多糖质量浓度达999.8 mg/L,比优化前的684.2 mg/L提高46.1%.
红曲霉;多糖;液态发酵;条件优化
红曲霉(Monascus sp.)是我国传统发酵产品——红曲的生产菌种.红曲霉接种于米饭培养基经发酵后的产物称为红曲,也称为神曲或丹曲,在我国有上千年的应用历史,主要用作食品发酵剂、着色剂、防腐剂、增香剂及中药配伍.
多糖是一类由醛糖或酮糖通过糖苷键连接而成的天然高分子多聚物,通常是细胞表面信号识别、抗原抗体反应、细胞间信息传递和感受的关键因子[1],具有免疫调节、抗肿瘤、抗癌、抗氧化、抗病毒、降血糖、降血脂等药理作用[2-10].红曲霉能产Monacolin K、GABA等多种生物活性物质,Tian Jun等[11]于1998年发现了红曲的另一种生物活性成分——红曲多糖,对其化学结构进行了初步研究,结果表明,红曲多糖具有抗肿瘤、提高免疫力等多种功效[12-14].目前,国内外关于红曲霉产多糖的研究较少,目前尚未实现工业化生产.针对红曲多糖液态发酵产量不高的现状,本文利用已筛选的1株高产红曲多糖菌种,对红曲霉摇瓶发酵产多糖进行了条件优化研究,以期为红曲多糖的工业化生产提供一定的基础.
1 材料与方法
1.1 实验菌种
红曲霉N(Monascus sp.N),由天津科技大学食品生物技术研究室保存.
1.2 材料与仪器
1.2.1 主要试剂
葡萄糖、蔗糖、蛋白胨、酵母粉、琼脂粉、NaNO3、MgSO4·7H2O、KH2PO4·3H2O、钼 酸 铵、NH4Cl、NH4NO3、(NH4)2SO4,均为分析纯,天津市北方天医化学试剂厂;麦芽糖、木糖、糊精,均为分析纯,北京奥博星生物技术有限责任公司;浓硫酸(分析纯),天津市化学试剂三厂;苯酚(分析纯),天津市永大化学试剂有限公司;甘油(分析纯),天津市化学试剂一厂.
1.2.2 主要仪器
T1000型电子天平,常熟双杰测试仪器厂;LSB50L型立式压力蒸气灭菌锅,上海华线医用核子仪器有限公司;VS-840-2型洁净工作台,上海博迅实业有限公司;HH.BII.600型电热恒温培养箱,天津试验仪器厂;MP-220型酸度计,梅特勒托利多仪器公司;ZHWY-100C型恒温培养振荡器,上海保兴生物设备工程有限公司;TDL-5-A型离心机,上海安亭科学仪器厂;DK-S26型电热恒温水浴锅,上海森信实验仪器有限公司;Aglient 8453型紫外可见分光光度计,Aglient公司.
1.3 培养基
斜面培养基:麦芽汁(10°Bé),琼脂 2%,pH 自然,121℃灭菌20 min,制备斜面.
种子培养基:葡萄糖7%,蛋白胨3%,NaNO30.2%,MgSO4·7H2O 0.1%,pH 自然,121 ℃ 灭菌 20 min.
发酵基础培养基:蔗糖4%,蛋白胨0.4%,KH2PO4·3H2O 0.3%,MgSO4·7H2O 0.08%,pH 5.0,121 ℃灭菌20 min.
发酵培养基:在发酵基础培养基中,分别添加40 g/L的葡萄糖、蔗糖、麦芽糖、木糖、甘油和糊精为碳源,作为碳源种类筛选培养基;对优化后的蔗糖为碳源,以质量浓度 20,25,30,35,40,45,50,55,60 g/L的培养基作为碳源质量浓度优化培养基.在发酵基础培养基中,分别添加4 g/L的NaNO3、NH4Cl、蛋白胨、酵母粉、NH4NO3和(NH4)2SO4为氮源,作为氮源种类筛选培养基;对优化后的酵母粉为氮源,以质量浓度 2,2.5,3,3.5,4,4.5,5,5.5,6 g/L 的培养基作为氮源优化培养基.
1.4 发酵方法
孢子悬浮液的制备:在红曲霉N试管斜面中加入15 mL无菌水,用无菌小勺轻刮长满菌丝体的培养基斜面,得到孢子悬浮液.
种子的培养:取红曲霉N孢子悬浮液10 mL,接种到种子培养基中,1 000 mL三角瓶中装200 mL种子培养基,在32℃往复式摇床中130 r/min培养24 h.
发酵条件优化:按体积分数为8%接种量,将红曲霉N种子液接入到发酵基础培养基中(1 000 mL瓶中装200 mL发酵培养基),180 r/min,33℃培养84 h.测定不同培养基组成及不同发酵条件下红曲多糖的产量.
1)不同碳源发酵培养基的优化:在发酵基础培养基中,分别添加40 g/L的葡萄糖、蔗糖、麦芽糖、木糖、甘油和糊精,考察碳源对红曲霉N多糖产量的影响.
2)不同蔗糖浓度发酵培养基的优化:在前期优化的培养基基础上,分别添加 20,25,30,35,40,45,50,55,60 g/L质量浓度的蔗糖,考察碳源质量浓度对红曲霉N多糖产量的影响.
3)不同氮源发酵培养基的优化:在前期优化的培养基基础上,分别添加4 g/L的NaNO3、NH4Cl、蛋白胨、酵母粉、NH4NO3和(NH4)2SO4,考察氮源对红曲霉N多糖产量的影响.
4)不同酵母粉浓度发酵培养基的优化:在前期优化的培养基基础上,分别添加 2,2.5,3,3.5,4,4.5,5,5.5,6 g/L质量浓度的酵母粉,考察氮源质量浓度对红曲霉N多糖产量的影响.
5)不同碳氮摩尔比的优化:培养基中蔗糖质量浓度为45 g/L,含碳浓度为1.578 9 mol/L;酵母粉(ω(N)=9.0%)为4.5 g/L,含氮浓度为0.0289 mol/L,则每升培养基中n(C)∶n(N)为54.6∶1.在前期优化的培养基基础上,分别选取 34.7∶1,43.7∶1,54.6∶1,68.3∶1,85.8∶1的碳氮摩尔比,考察碳氮摩尔比对红曲霉N多糖产量的影响.
6)不同矿质元素的优化:在前期优化的培养基基础上,KH2PO4·3H2O的质量浓度分别选用1.0,1.5,2.0,2.5,3.0,3.5,4.0,4.5,5.0 g/L,MgSO4·7H2O的质量浓度分别选用 0.60,0.65,0.70,0.75,0.80,0.85,0.90,0,95,1.00 g/L,考察矿质元素对红曲霉N多糖产量的影响.
1.5 测定方法
1.5.1 葡萄糖标准曲线的绘制
采用苯酚-浓硫酸分光光度法[15-17].吸取0.1 mg/mL 的葡萄糖标准溶液 0,0.2,0.4,0.6,0.8,1.0,1.2,1.4 mL,分别置于 25 mL 比色管中,补蒸馏水至2.0 mL,各加入6%苯酚溶液1.0 mL,摇匀后加入浓硫酸5 mL,立即摇匀,置沸水浴中煮沸15 min,冷却,以试剂空白溶液为参比,1 cm比色皿,用分光光度计在490 nm波长处测定吸光值.以OD490为横坐标、葡萄糖浓度为纵坐标绘制葡萄糖标准曲线,线性回归求得总糖的曲线方程.将待测液的OD490对照标准曲线方程,计算红曲霉发酵液的多糖含量.
1.5.2 样品的测定
红曲霉发酵液中总糖浓度的测定:苯酚-浓硫酸分光光度法.
红曲霉发酵液中残余蔗糖的测定:钼蓝光度法[18].
具体测定过程:每12 h从摇床中取出一瓶红曲霉N发酵液,取10 mL发酵液进行抽滤.滤液加蒸馏水定容至10 mL,转至容积为50 mL的离心管,加
4倍体积95%的工业酒精,摇匀后放冰箱中静置12 h.4 000 r/min离心10 min,弃上清液后加10 mL蒸馏水溶解沉淀,加0.2 g活性炭,摇匀后静置6 h去色素.4 000 r/min离心10 min,弃活性炭后得上清液,取0.1~0.5 mL上清液于比色管中(使最终稀释液吸光值落在0.1~0.9),以蒸馏水定容至2 mL,加入1 mL 6%的苯酚溶液摇匀后延管壁缓慢注入浓硫酸5 mL,立即摇匀,置于沸水浴中保温15 min,冷却至室温后于490 nm测OD值,以标准曲线计算总糖含量.样品中总糖含量计算公式为:
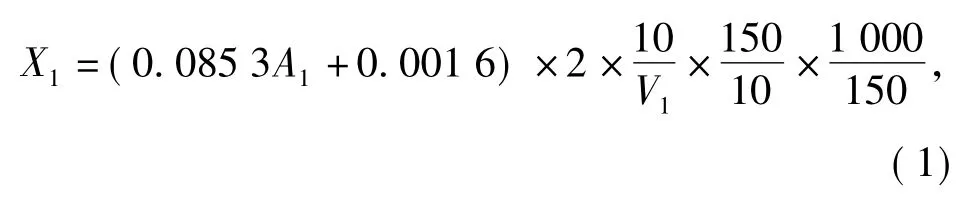
式(1)中:X1为发酵液中总糖含量,单位为mg/L;A1为苯酚-硫酸法测样品所得OD值;V1为吸取去色素后的上清液的体积,单位为mL.
钼蓝光度法所测残余蔗糖浓度为X0.
红曲霉发酵液中积累多糖的浓度计算公式为:

红曲霉液态发酵菌体量的测定:将测多糖时剩余的发酵液抽滤,得菌体,合并测多糖时抽滤所得菌体,置60℃恒温烘箱里直至重量不再变化,称重.
2 结果与分析
2.1 苯酚-硫酸法测总糖标准曲线
回归得到测总糖的曲线方程(见图1)为:y=0.0856x+0.0013,R2=0.999 2.说明方程在糖质量浓度为0.01~0.07 g/mL之间的线性关系良好,可根据该公式计算得到红曲霉N发酵液中的总糖含量.
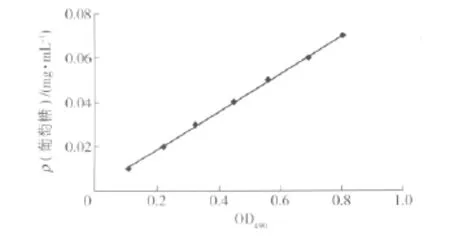
图1 葡萄糖标准曲线Fig.1 Standard curve of glucose solution
2.2 红曲霉产多糖的液态发酵培养基优化
2.2.1 碳源对红曲霉N多糖产量的影响
红曲霉能够利用单糖、双糖、多糖等多种碳源进行生长代谢.按1.4(1)方法,考察不同碳源对总糖及红曲霉N多糖产量的影响,考虑到不同碳源定量测定的复杂性,以总糖量作为碳源筛选的指标,结果见图2.

图2 碳源对红曲霉N总糖产量的影响Fig.2 Effects of carbon sources on total sugar yield of Monascus sp.N
由图2可知,以蔗糖为碳源时,红曲霉N的总糖产量最高,达830.6 mg/L,同时蔗糖来源广泛,且价格便宜,可作为较理想的生产用碳源.以下实验选用蔗糖为分批发酵时的最佳碳源.
碳源质量浓度对产物的产量也有较大的影响.按1.4(2)方法,考察蔗糖不同质量浓度对红曲霉N多糖产量的影响,分批发酵实验结果见图3.

图3 蔗糖的质量浓度对红曲霉N多糖产量的影响Fig.3 Effects of the concentration of sucrose on polysaccharide yield of Monascus sp.N
由图3可知,蔗糖质量浓度的不同对红曲多糖产量有较大影响,蔗糖质量浓度低于45 g/L时,红曲多糖产量随蔗糖质量浓度的增加而增加,最高可达718.4 mg/L,而蔗糖质量浓度高于45 g/L时,不利于红曲多糖的生产.以下实验选用45 g/L的蔗糖为分批发酵时的较佳碳源质量浓度.
2.2.2 氮源对红曲霉N多糖产量的影响
氮源是影响红曲霉生长代谢的一个重要因素,按1.4(3)方法,考察不同氮源对红曲霉N多糖产量的影响,结果见图4.
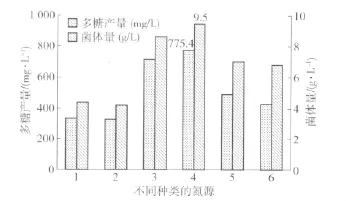
图4 氮源对红曲霉N多糖产量的影响Fig.4 Effects of nitrogen sources on polysaccharide yield of Monascus sp.N
由图4可知,在上述6种氮源中,酵母粉利于红曲多糖的产生.因为合适的氮源浓度既可保证菌体的生长代谢,又可避免菌体量过大或过小从而影响多糖的合成,因此有必要考察不同氮源质量浓度对红曲霉N多糖产量的影响,按1.4(4)方法,实验结果见图5.

图5 酵母粉的质量浓度对红曲霉N多糖产量的影响Fig.5 Effects of concentration of yeast extract powder on polysaccharide yield of Monascus sp.N
由图5可知,随酵母粉质量浓度的增加,红曲多糖产量逐步上升,当酵母粉质量浓度为4.5 g/L时,红曲多糖产量达最高为793.6 mg/L.当酵母粉浓度继续增高,利于菌体的生长但多糖产量却下降.以下实验选用4.5 g/L的酵母粉为分批发酵时的较佳氮源质量浓度.
2.2.3 碳氮摩尔比对红曲霉N多糖产量的影响
碳氮摩尔比对微生物的生长和产物形成常有很大的影响,碳氮摩尔比不当会妨碍菌丝对营养物质的吸收.碳氮摩尔比偏小,会导致菌体生长旺盛,造成菌体提前衰老自溶;碳氮摩尔比偏大,菌体则会生长缓慢,产率下降.不同的真菌对碳源和氮源的要求不同,本实验在原有碳氮摩尔比基础上研究碳氮的摩尔比对红曲多糖发酵的影响.
按1.4(5)方法,考察不同碳氮摩尔比对红曲霉N多糖产量的影响,结果见表1.
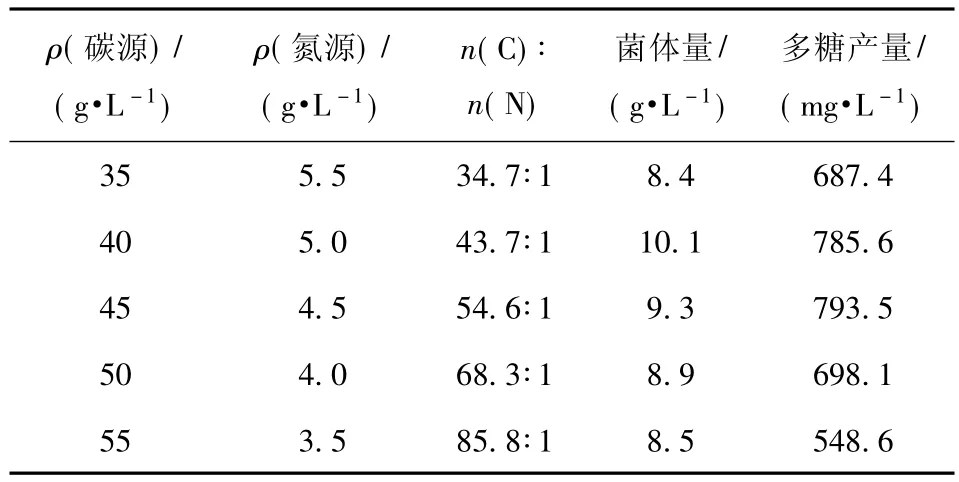
表1 碳氮摩尔比对红曲霉N多糖产量的影响Tab.1 Effects of ratio of n(C)∶n(N)on polysaccharide yield of Monascus sp.N
由表1 可知,n(C)∶n(N)为 54.6∶1时,红曲多糖的产量最高达793.5 mg/L.以下实验选用54.6∶1为分批发酵时的较佳碳氮物质的量比.
2.2.4 矿质元素对红曲霉N多糖产量的影响
菌体在生长代谢时需一定量的矿质元素,其中P、S、K、Mg 4种矿质元素必须通过外界添加才可达到菌体生长所需浓度.对于这几种元素来源,首选KH2PO4·3H2O 和 MgSO4·7H2O,它们可以同时提供这4种元素.因此,有必要通过实验确定KH2PO4·3H2O和MgSO4·7H2O的最宜添加量,按1.4(6)方法,实验结果见图6和图7.
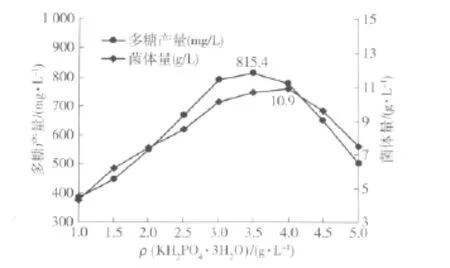
图6 KH2PO4·3H2O的质量浓度对红曲霉N多糖产量的影响Fig.6 Effects of concentration of KH2PO4·3H2O on polysaccharide yield of Monascus sp.N
由图6可知,当KH2PO4·3H2O为3.5 g/L时,红曲多糖产量达到最高,为 815.4mg/L.MgSO4·7H2O的优化选用3.5 g/L为分批发酵时KH2PO4·3H2O的较佳质量浓度.
由图7可知,当MgSO4·7H2O为0.85 g/L时,红曲多糖产量达到最高为829.6 mg/L.以下实验选用0.85 g/L为分批发酵时MgSO4·7H2O的较佳质量浓度.

图7 MgSO4·7H2O的质量浓度对红曲霉N多糖产量的影响Fig.7 Effects of concentration of MgSO4·7H2O on polysaccharide yield of Monascus sp.N
2.3 红曲霉产多糖的液态发酵工艺条件优化
采用正交试验方法.以上述优化的培养基成分为基础,进行了发酵工艺条件的单因素实验,基于单因素实验结果,以种龄、接种量、培养基初始pH和装液量进行L9(34)正交试验设计.
正交试验因素与水平设计见表2.

表2 正交试验设计表Tab.2 Factors and levels of orthogonal design
正交试验结果与分析见表3.
由表3可知,较优水平为5号组合,即A2B2C3D1;按照极差R的大小确定各因素的主次顺序,为A>C>B>D,即种龄>培养基初始pH>接种量>装液量,种龄对红曲多糖的产量影响最大,然后是培养基初始pH,其次是接种量,最后是装液量;根据k值分析得出的较佳组合为A2B2C3D3,未出现在9组试验中.经验证,A2B2C3D1组合更优于 A2B2C3D3组合.因此红曲霉N液态发酵产多糖的优选工艺条件为:种龄30 h,接种量7.5%,发酵培养基初始 pH 5.75,1 000 mL三角瓶装液量162.5 mL,发酵时间84 h.在此条件下,红曲霉N摇瓶液态发酵的多糖质量浓度达999.8 mg/L,比优化前的684.2 mg/L高46.1%.
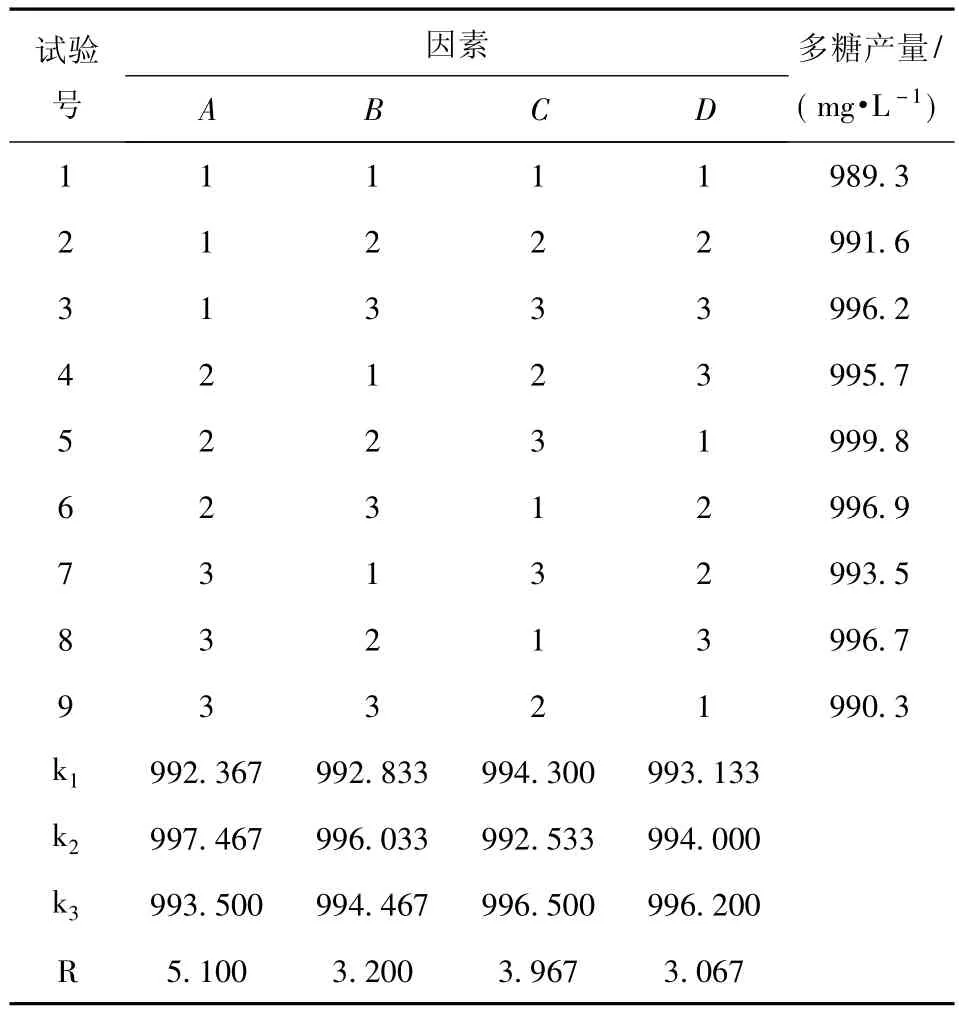
表3 正交试验结果分析Tab.3 Experiment arranged by orthogonal design and results
3 结论
根据实验得出红曲霉N优化后的发酵培养基为:蔗糖 45 g/L、酵母粉 4.5 g/L、KH2PO4·3H2O 3.5 g/L、MgSO4·7H2O 0.85 g/L.优化后的发酵工艺条件为:种龄30 h,接种量7.5%,发酵培养基初始pH 5.75,1 000 mL三角瓶装液量162.5 mL,发酵时间84 h.在此条件下,红曲霉摇瓶液态发酵的多糖质量浓度达999.8 mg/L,比优化前的 684.2 mg/L高46.1%.
[1]Bohn J A,BeMiller J N.(1→3)-β-D-Glucans as biological response modifiers[J].CarbohydPolymers,1995,28(1):3-8.
[2]Roser B.Trehalose,a new approach to premium dried foods[J].Trends in Food Science & Technology,1991(2):166-169.
[3]冯婷,何聪芬,赵华,等.植物多糖研究概况[J].北京工商大学学报:自然科学版,2004,22(5):1-4.
[4]Chen Zhen,Guo Qinglong,Gao Xiangdong,et al.Tumor inhibitory effect of YCP(a marine fugal polysaccharide)(I)[J].Chin J Nat Med,2005,3(6):396-400.
[5]张燕,杜连祥,陈锦英.肺炎克雷伯氏菌荚膜多糖的免疫活性研究[J].天津科技大学学报,2005,20(4):25-28.
[6]宋微,刘安军,王稳航,等.不同分子质量软骨多糖对K562细胞的增殖抑制作用[J].天津科技大学学报,2006,21(3):20-22.
[7]刘莹,戴玉杰,张黎明.穿山龙多糖分离纯化工艺的研究[J].天津科技大学学报,2007,22(4):27-30.
[8]杨庆伟,鲁梅芳,金玉妍.灰树花菌丝体多糖的硫酸酯化及其降血脂作用[J].天津科技大学学报,2009,24(4):25-28.
[9]王尉,徐春明,曹学丽.响应面法优化微波辅助提取桑叶多糖的工艺研究[J].北京工商大学学报:自然科学版,2009,27(4):6-9.
[10]谢建华,庞杰,李志明,等.微波辅助提取双袍蘑菇柄中多糖的工艺研究[J].北京工商大学学报:自然科学版,2011,29(5):30-35.
[11]Tian Jun,Li Zhaolan,Shen Xiaoyun,et al.Chemical structure of monascus polysaccharide[J].Journal of Nanjing University of Traditional Chinese Medicine:Natural Science Edition,1998,14(4):217-218.
[12]丁红梅.红曲多糖抑瘤作用初步研究[J].菌物研究,2007,5(3):171-173.
[13]张建峰,昌友权,陈光,等.红曲多糖的免疫活性研究[J].食品科学,2008,29(2):391-393.
[14]周芳美,朱晓松,潘佩蕾,等.红曲霉菌胞外多糖的抗肿瘤活性研究[J].中华中医药学刊,2011,29(1):123-124.
[15]徐光域,颜军,郭晓强,等.硫酸-苯酚定糖法的改进与初步应用[J].食品科学,2005,26(8):342-346.
[16]孙芸,刘杰,刘佳佳,等.苯酚-硫酸法测定菊苣根中总糖的含量[J].中国民族民间医药,2008(4):12-13.
[17]金凤慈,闵莉静.苯酚-硫酸法测定百合多糖中糖含量[J].科技信息,2011,10:127-128.
[18]李利军,孔红星,赖学寨.钼蓝光度法测定蔗糖的研究[J].理化检验-化学分册,2005,41(11):757-758.
[19]Mikal E S,Jrand M F.Inhibition of ethylene synthesis and action in ripening tomato fruit by ethanol vapors[J].J Amer Soc Hort Sci,1988,113(4):572-576.
[20]Ingle M.Physiology and control of superficial scald of apples:A review[J].Hortscience,1989,24:28-31.
(责任编辑:檀彩莲)
Optimization of Liquid Fermentation Conditions of Polysaccharide by Monascus sp.
WU Jian-ping, WANG Chang-lu, CHEN Mian-hua, WANG Yu-rong, LI Feng-juan
(Key Laboratory of Food Nutrition and Safety,Ministry of Education/College of Food and Biology Engineering,Tianjin University of Science& Technology,Tianjin 300457,China)
The liquid state fermentation conditions of polysaccharide by Monascus sp.were investigated.The optimized culture medium was as follows,sucrose 45 g/L,yeast extract powder 4.5 g/L,KH2PO4·3H2O 3.5 g/L,MgSO4·7H2O 0.85 g/L.The fermentation conditions were optimized by single factor experiment and orthogonal test.The optimal fermentation conditions were as follows,seed culture age of 30 h,inoculation volume of 7.5%,initial pH of 5.75,liquid medium volume of 162.5 mL in 1 000 mL conical flask,and the fermentation lasted for 84 h.The highest yield of polysaccharide could be up to 999.8 mg/L,which was 46.1%higher than that of original yield of 684.2 mg/L.
Monascus sp.;polysaccharide;liquid state fermentation;conditional optimization
TS201.2;Q815
A
1671-1513(2012)06-0057-06
2012-02-27
国家自然科学基金资助项目(31171729).
伍健萍,男,硕士研究生,研究方向为食品生物技术;
王昌禄,男,教授,博士生导师,主要从事食品生物技术方面的研究.通讯作者.
