杜氏盐藻S腺苷高半胱氨酸水解酶酵母双杂交诱饵载体的构建及自激活和毒性检测*
2012-12-07柴丹丹李庆华阎赟梦毛丽红朱立强薛乐勋
柴丹丹,李庆华,阎赟梦,毛丽红,李 靓,朱立强,薛乐勋#
1)郑州大学生物工程系细胞生物学研究室郑州 450001 2)郑州大学第二附属医院检验科郑州 450014
#通讯作者,男,1944年2月生,教授,博士研究生导师,研究方向:肿瘤标志物与基因工程,E-mail:xuelx@zzu.edu.cn
杜氏盐藻S腺苷高半胱氨酸水解酶酵母双杂交诱饵载体的构建及自激活和毒性检测*
柴丹丹1),李庆华1),阎赟梦1),毛丽红1),李 靓1),朱立强2),薛乐勋1)#
1)郑州大学生物工程系细胞生物学研究室郑州 450001 2)郑州大学第二附属医院检验科郑州 450014
#通讯作者,男,1944年2月生,教授,博士研究生导师,研究方向:肿瘤标志物与基因工程,E-mail:xuelx@zzu.edu.cn
S腺苷高半胱氨酸水解酶;酵母双杂交;诱饵载体;自激活;杜氏盐藻
目的:构建杜氏盐藻S腺苷高半胱氨酸水解酶(SAHH)的酵母双杂交诱饵载体pGBKT7-SAHH,并检测其对酵母细胞的毒性和自激活作用。方法:应用RT-PCR扩增杜氏盐藻的SAHH cDNA,测序分析后与酵母双杂交诱饵载体pGBKT7连接,构建诱饵载体pGBKT7-SAHH。用PEG/LiAc法将诱饵载体转入AH109和Y187酵母中,通过表型筛选检测诱饵蛋白对酵母有无毒性和自激活作用。结果:成功构建了诱饵载体pGBKT7-SAHH并成功转化到酵母细胞AH109和Y187中,表达的融合蛋白对宿主酵母细胞无毒性。在AH109和Y187酵母细胞中诱饵载体均未激活报告基因HIS3和ADE2,但是激活了报告基因MEL1。结论:诱饵载体pGBKT7-SAHH可用酵母双杂交方法筛选与SAHH相互作用的蛋白。
*国家自然科学基金资助项目 30700014;科技部国际科技合作基金资助项目 2007DFA01240
在真核生物中,S腺苷甲硫氨酸(S-adenosyl methionine,SAM)依赖性甲基转移酶催化的甲基化反应是最重要的甲基化通路,反应生成S腺苷高半胱氨酸(S-adenosyhomocystine,SAH)。S腺苷高半胱氨酸水解酶(SAH hydrolase,SAHH)催化SAH可逆水解生成腺苷和高半胱氨酸(HCys)[1],此水解过程是SAH水解的惟一途径。而HCys可抑制SAH依赖性甲基转移酶的活性,因此SAHH成为SAM依赖性甲基化通路的反馈调控酶[2]。此外,甲基转移酶可以从启动子的甲基化、帽子结构的形成、mRNA的稳定性以及翻译的起始等各个水平上影响基因表达的效率[3-5],所以SAHH作为潜在的抗寄生虫[6]、抗肿瘤[7]和抗艾滋病[8]的药物靶点而引起广泛关注。SAHH还参与其他类型的甲基转移反应和含硫氨基酸的代谢过程[9],但是目前对SAHH介导的甲基化具体作用机制以及参与的调控信号通路还不尽了解。该实验拟通过构建盐藻SAHH酵母双杂交诱饵载体pGBKT7-SAHH,转化酵母菌株,检测其对酵母菌株有无毒性作用并进行自激活检测,为下一步采用酵母双杂交方法[10]筛选与SAHH相互作用的蛋白提供依据。
1 材料与方法
1.1 主要试剂 杜氏盐藻UTEX LB-1644购自美国得克萨斯州大学,大肠杆菌DH5α由郑州大学医学实验中心细胞生物学室保存;Trizol试剂购自美国Invitrogen公司;AMV cDNA第一链合成试剂盒购于上海生工生物工程有限公司;限制性内切酶、pMD18-T载体、T4 DNA连接酶、DNA Marker均购于大连TaKa-Ra公司;DNA胶回收试剂盒和质粒提取试剂盒购于Axygen公司;YPD液体和固体培养基以及DO Supplement系列均购于上海睿星基因技术有限公司;X-gal、X-α-gal、DMSO均购于上海生工生物工程有限公司;酵母菌株、pGBKT7载体购于Clontech公司。
1.2 SAHH cDNA的获得 根据pGBKT7载体上的多克隆位点和杜氏盐藻SAHH cDNA序列设计引物[11],并加入EcoRⅠ和BamHⅠ酶切位点。上游引物 S1:5’-CCGGAATTCATGAGTTGACCATCGATG-3’;下游引物 S2:5’-GCGGATCCTTAGTACCTG TAGTGGGCA-3’。杜氏盐藻总RNA提取方法根据Trizol试剂说明书进行,然后根据cDNA第一链合成试剂盒说明书将RNA反转录成cDNA。以cDNA为模板,94℃预变性3 min,然后94℃变性40 s,63℃退火30 s,72℃延伸90 s,30个循环之后72℃延伸10 min;4℃终止反应。产物经10 g/L琼脂糖凝胶电泳检测其特异性并进行胶回收。
1.3 重组质粒pMD18-T-SAHH的构建及鉴定
将PCR产物胶回收的目的片段与pMD18-T载体于16℃连接仪中连接24 h。将连接产物转化大肠杆菌DH5α感受态细胞,涂布在含有氨苄青霉素并涂有IPTG和X-gal的LB固体培养基上,37℃过夜培养。经过蓝白斑筛选后挑取阳性克隆于液体培养基中30℃培养6~8 h,提取质粒,用EcoRⅠ和BamHⅠ进行过夜酶切,鉴定正确后回收目的片段(SAHH片段),同时将菌液送至测序公司测序。
1.4 酵母双杂交诱饵载体pGBKT7-SAHH的构建及鉴定 将诱饵载体pGBKT7质粒同样用EcoRⅠ和BamHⅠ进行过夜酶切,回收载体片段后与SAHH片段用T4连接酶连接,16℃连接24 h。将连接产物转化至大肠杆菌DH5α感受态细胞中,涂布含有卡那霉素的LB固体培养基上,过夜培养后挑取阳性克隆,提取质粒,经双酶切鉴定正确后送公司测序。
1.5pGBKT7-SAHH的转化
1.5.1 酵母感受态细胞的制备 采用Clontech说明书上的醋酸锂法分别制备酵母Y187和AH109的感受态细胞。将酵母细胞在YPDA平板上划线培养至长出2 mm克隆后,挑取单克隆至3 mL YPDA液体培养基中,30℃摇床涡旋(250 r/min)培养8 h后,取5 μL加入到50 mL YPDA培养基中再培养16~20 h,至A(600 nm)值达0.15~0.30,室温下2 700 r/min离心5 min弃上清,加60 mL去离子水重悬细胞,2 700 r/min离心5 min弃上清,用3 mL 1.1×TE/LiAc溶液重悬细胞,分装到EP管中,每管1.5 mL,最高转速离心15 s弃上清,用 600 μL 1.1×TE/LiAc溶液重悬,即为酵母感受态细胞。
1.5.2 转化及鉴定 在1.5 mL离心管中依次加入500 μL PEG/LiAc溶液、0.5 μL构建好的诱饵载体pGBKT-SAHH(500 μg/L)、50 μL酵母感受态细胞和5 μL鲑鱼精DNA,涡旋混匀,30℃水浴锅中培养30 min(每10 min涡旋混匀1次),每个离心管中加入20 μL DMSO涡旋混匀,42℃水浴15 min(每5 min涡旋混匀1次),15 000 r/min离心15 s弃上清,加1 mL YPDA液体培养基重悬细胞,30℃温育90 min后,15 000 r/min离心15 s,弃上清,用1 mL NaCl溶液轻轻吹打重悬细胞,将酵母细胞悬液涂布SD/-Trp培养基,30℃培养2~4 d至出现白色菌落。挑取直径大于2 mm的克隆,划线SD/-Trp培养基至长出克隆,保存于4℃冰箱以备酵母双杂交用。挑取SD/-Trp培养基上的菌落,用引物S1和S2对酵母细胞进行菌落PCR,检测诱饵载体是否成功转入酵母细胞中。
1.6 毒性鉴定 将 pGBKT7-SAHH分别转入AH109和Y187酵母细胞中,涂布SD/-Trp固体培养基,挑取单克隆接种SD/-Trp液体培养基中30℃过夜培养,测其A(600 nm)值。
1.7 自激活检测 将诱饵载体pGBKT7-SAHH分别转化到酵母细胞AH109和Y187中,涂布SD/-Trp板,长出白色菌落后,挑取直径大于2 mm的单克隆,分别划线于SD/-Trp、SD/-Trp/X-α-gal、SD/-Trp-His/X-α-gal培养基上,30℃培养3~5 d后观察酵母细胞的生长情况。
2 结果
2.1 杜氏盐藻SAHH cDNA的扩增 用引物S1和S2以盐藻cDNA为模板进行PCR扩增,得约1 500 bp的片段,与预期大小一致,见图1。
2.2 诱饵载体pGBKT7-SAHH的鉴定 pMD18-TSAHH双酶切鉴定结果见图2,测序结果表明产物为SAHH,且与已知序列比对未发生突变。诱饵载体pGBKT7-SAHH酶切鉴定结果见图3,测序结果表明SAHH片段已按正确的读码框插入到pGBKT7载体的多克隆位点中,且序列正确,没有发生有义突变。
2.3 诱饵载体pGBKT7-SAHH的转化 用菌落PCR扩增SAHH基因,琼脂糖凝胶电泳显示pGBKT7-SAHH已经成功转入酵母细胞中,见图4。

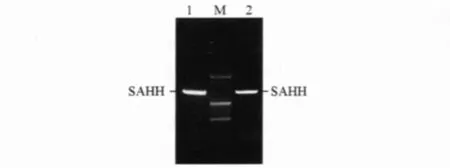
图4 pGBKT7-SAHH转化的酵母细胞的菌落PCR
2.4 毒性及自激活检测结果 转化诱饵载体的酵母细胞AH109和Y187的A值均大于0.8。转化了诱饵载体pGBKT7-SAHH的AH109和Y187酵母细胞在 SD/-Trp/X-α-gal培养基上均能生长且变蓝(图5A、5B);在 SD/-Trp-His/X-α-gal培养基上,Y187不能生长而AH109能生长且变蓝(图5C);在SD/-Trp-His/3-AT/X-α-gal培养基上 AH109和Y187都不能生长(图5D)。
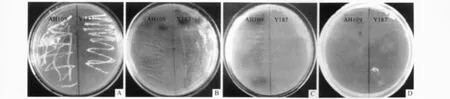
图5 转化了pGBKT7-SAHH的AH109和Y187酵母细胞自激活检测结果
3 讨论
酵母双杂交技术作为一种研究蛋白质相互作用的有效手段而被普遍应用,为研究蛋白质之间的相互作用以及研究功能未知蛋白质提供了一个成熟的技术平台[12]。在酵母双杂交系统中,酵母细胞作为真核细胞为两个相互作用的蛋白质提供了更接近于天然构象和功能的蛋白,但是它还有一个明显的缺陷就是假阳性问题,如果诱饵本身就可以激活下游的报告基因,就不能作为诱饵来筛选文库中与之相互作用的蛋白,所以自激活实验是验证诱饵蛋白能否用于酵母双杂交的必需步骤。
在酵母双杂交系统中共有3个报告基因。该实验结果显示转化诱饵载体的酵母细胞AH109和Y187的A值均大于0.8,说明pGBKT7-SAHH对2种酵母细胞均无毒性[11]。以上2种酵母细胞在SD/-Trp/X-α-gal培养基上均变蓝;在SD/-Trp-His/ X-α-gal培养基上AH109能生长且变蓝,Y187不能生长,说明了 Y187不能激活报告基因 His3,而AH109能激活报告基因His3;当在培养基中加入组氨酸竞争性抑制剂3-AT后AH109不能生长,说明在Y187和AH109酵母细胞中pGBKT7-SAHH表达的融合蛋白没有激活His3和ADE2,但是激活了报告基因MEL1。结果表明,构建的pGBKT7-SAHH对报告基因ADE2和His3没有自激活作用,排除了诱饵载体的假阳性,为进一步利用酵母双杂交从盐藻基因的AH109酵母文库筛选与诱饵蛋白相互作用的蛋白质奠定了基础。在后续的酵母双杂交实验中可以使用ADE2和His3报告基因来筛选阳性结果,但这样可能导致假阳性出现,因此在实验中还需要采用免疫共沉淀或Pull-down等蛋白质相互作用的方法进一步验证。
[1]Haba GD,Cantoni GL.The enzymatic synthesis of S-adelosyl-L-homoeysteine from adenosine and homoeysteine[J].J Biol Chem,1959,234(3):603
[2]Chiang PK.Biological effects of inhibitors of S-adenosylhomocysteine hydrolase[J].Pharmacol Ther,1998,77(2): 115
[3]Pritchard PH,Chiang PK,Cantoni GL,et al.Inhibition of phosphatidylethanolamine N-methylation by 3-deazaadenosine stimulates synthesis the of phosphatidylcholine via the CDP-eholine pathway[J].J Biol Chem,1982,257 (11):6362
[4]Boissier F,Bardou F,Guillet V,et al.Further insight into S-adenosylmethionine-dependent methyltransferases[J].J Biol Chem,2006,281(7):4434
[5]Wang C,Leffler S,Thompson DH,et al.A general flurescence-based coupled assay for S-adenosylmethionine-dependent methyltransferases[J].Biochem Biophys Res Co mmun,2005,331(1):351
[6]Cai SM,Li QS,Fang JW,et al.The rationale for targeting the NAD/NADH cofactor binding site of parasitic S-adenosyl-L-homocysteine hydrolase for the design of antiparasitic drugs[J].NucleosidesNucleotides Nucleic Acids,2009,28(5):485
[7]Castro R,Rivera I,Struys EA,et al.Increased homocysteine and S-adenosylhomocysteine concentrations and DNA hypomethylation in vascular disease[J].Clin Chem,2003,49 (8):1292
[8]Hermes M,Osswald H,Kloor D.Role of S-adenosylhomocysteine hydrolase in adenosine-induced apoptosis in HepG2 cell[J].Exp Cell Res,2007,313(2):264
[9]Malanovic N,Streith I,Wolinski H,et al.S-adenosyl-L-homocysteine hydrolase,key enzyme of methylation metabolism,regulates phosphatidylcholine synthesis and triacylglycerol homeostasis in yeast:implications for homocysteine as a risk factor of atherosclerosis[J].J Biol Chem,2008,283(35):23989
[10]Fields S,Song O.A novel genetic system to detect proteinprotein interactions[J].Nature,1989,340(6230):245
[11]马生秀,邓璐霞,罗林,等.防御素HNP-3成熟肽素酵母双杂交诱饵质粒的构建及自激活和毒性检测[J].航天医学与医学工程,2007,20(2):151
[12]阎赟梦,李庆华,李杰,等.杜氏盐藻S腺苷高半胱氨酸水解酶基因的克隆及功能分析[J].郑州大学学报:医学版,2011,46(4):517
Construction of a bait vector for SAHH of Dunaliella salina and evaluation of its self-activation in yeast two-hybrid system
CHAI Dandan1),LI Qinghua1),YAN Yunmeng1),MAO Lihong1),LI Liang1),ZHU Liqiang2),XUE Lexun1)1)Laboratory for Cell Biology,Department of Bioengineering,Zhengzhou University,Zhengzhou 4500012)Clinical Laboratory,the Second Affiliated Hospital,Zhengzhou University,Zhengzhou 450014
S-adenosyhomocystine hydrolase;yeast two-hybrid;bait vector;self-activation;Dunaliella salina
Aim:To construct a bait vector for S-adenosyhomocystine hydrolase(SAHH)of Dunaliella salina and to evaluate its self-activation activity and toxic effects in yeast two-hybrid system.Methods:The full-length SAHH gene was amplified by RT-PCR and confirmed by sequencing.A fragment of the gene was then subcloned into the vector SAHH of pGBKT7 to construct the bait vector.The constructed bait vector pGBKT7-SAHH was transformed into yeast strains AH109 and Y187 by PEG/LiAc method and its self-activation was tested by the phenotype assay.Results:The constructed bait vector of pGBKT7-SAHH was successfully transformed into yeast strains Y187 and AH109,and the fusion proteins were not toxic to yeast cells;the reporter genes HIS3 and ADE2 were not self-activated,but MEL1 was self-activated.Conclusion: The pGBKT-SAHH could act as a bait to screen interaction proteins of SAHH in yeast two-hybrid system.
Q782
10.3969/j.issn.1671-6825.2012.01.006
(2011-03-30收稿 责任编辑李沛寰)
