重组α2-HS糖蛋白的原核表达、纯化及免疫学活性分析*
2012-12-07任鹏飞代丽萍王凯娟张建营
王 鹏,任鹏飞,代丽萍,王凯娟,张建营#
1)郑州大学公共卫生学院流行病学教研室郑州 450001 2)河南省肿瘤流行病学重点实验室郑州 450052 #通讯作者,男,1962年10月生,博士,教授,研究方向:肿瘤流行病学,E-mail:jianyingzhang@hotmail.com
重组α2-HS糖蛋白的原核表达、纯化及免疫学活性分析*
王 鹏1,2),任鹏飞1),代丽萍1,2),王凯娟1,2),张建营1,2)#
1)郑州大学公共卫生学院流行病学教研室郑州 450001 2)河南省肿瘤流行病学重点实验室郑州 450052 #通讯作者,男,1962年10月生,博士,教授,研究方向:肿瘤流行病学,E-mail:jianyingzhang@hotmail.com
α2-HS糖蛋白;原核表达;蛋白纯化;抗原性
目的:原核表达并纯化具有生物学活性的重组α2-HS糖蛋白(AHSG)。方法:提取人肝癌细胞株HepG2细胞总RNA,逆转录得cDNA,PCR扩增出目的基因,与pMD18-T载体连接后,转化至大肠杆菌DH5α中,大量扩增后提取克隆质粒,连接至原核表达载体pEP-30a(+)中,转化BL21(DE3),经IPTG诱导蛋白表达,通过镍离子亲和层析的方法纯化重组蛋白,采用SDS-PAGE电泳、免疫印迹杂交法对纯化产物进行分析鉴定。结果:成功构建了AHSG原核表达系统BL21(pET30a-AHSG),最佳诱导条件为80 μmol/L IPTG诱导3 h;诱导表达的蛋白相对分子质量约54 600,主要以不溶性的包涵体形式存在,纯化后的重组蛋白质量浓度最高达2.3 g/L,经免疫印迹杂交鉴定有抗原性。结论:成功构建了AHSG原核表达系统,该系统可高效表达重组AHSG蛋白,该蛋白具有良好的抗原性。
α2-HS糖蛋白(alpha2-Heremans-Schmid glycoprotein,AHSG)是一种存在于人体血清中的糖蛋白。目前的研究[1-6]显示,AHSG与多种肿瘤关系密切,在肿瘤患者体内异常表达,是一种肿瘤相关抗原,有可能成为诊断肿瘤的一种血清学标志物。作者尝试应用大肠杆菌原核系统表达AHSG基因并对表达产物进行纯化,以获得大量的AHSG蛋白,为后续的AHSG作为一种血清学标志物在肿瘤早期诊断中的应用研究奠定基础。
1 材料与方法
1.1 主要试剂 凝胶回收试剂盒购自北京百泰克生物技术有限公司;Taq酶购自上海Promega公司; EcoRⅠ、SalⅠ、dNTP及T4 DNA连接酶购自宝生物工程(大连)有限公司;兔源AHSG多克隆抗体、辣根过氧化物酶(HRP)标记的羊抗兔IgG均购自美国Gene Tex公司。
1.2 菌株与质粒 肝癌细胞株HepG2、克隆质粒pMD18-T和表达质粒pET-30a(+)均为该研究室保存;大肠杆菌DH5α购自大连宝生物工程公司;大肠杆菌BL21(DE3)购自天根生化科技有限公司。
1.3 AHSG基因的扩增 根据Genbank中AHSG基因的cDNA序列,设计其PCR引物如下:上游5’-CGGAATTCATGAAGTCCCTCGTCCTGCTC-3’(EcoRⅠ),下游5’-CGGGTCGACCTAGACCTTGAAGTGT CTGAT-3’(SalⅠ),产物大小1 104 bp。按照试剂盒说明提取HepG2总RNA,逆转录得cDNA;以cDNA为模板进行PCR,反应体系50 μL,包括10× Buffer 5 μL,2.5 mmol/L dNTPs 4 μL,MgCl23 μL,上、下游引物各0.75 μL,Taq酶0.5 μL,模版cDNA 3.3 μL,灭菌超纯水32.7 μL。PCR循环条件:94℃预变性3 min;94℃变性30 s,70℃退火30 s,以后每个循环降1.5℃,72℃延伸30 s,共20个循环;94℃变性30 s,55℃退火30 s,72℃延伸70 s,共20个循环;最后72℃延伸10 min。取5 μL PCR扩增产物于8 g/L琼脂糖凝胶电泳,用凝胶成像系统采集图像进行分析。
1.4 克隆质粒AHSG-T的构建及鉴定 按照胶回收试剂盒说明回收AHSG基因的PCR产物,在T4 DNA连接酶作用下,与pMD18-T连接;连接产物转化感受态大肠杆菌DH5α,氨苄青霉素抗性筛选阳性克隆。对阳性克隆进行EcoRⅠ单酶切和EcoRⅠ与SalⅠ双酶切鉴定、特异PCR鉴定,以初步确定克隆质粒AHSG-T构建的正确性。然后对克隆质粒进行测序,阳性克隆采用通用引物M13测序,测序结果采用NCBI网上序列分析软件进行cDNA序列和氨基酸序列同源性分析。
1.5 重组表达质粒pET-30a-AHSG的构建及鉴定克隆质粒AHSG-T与表达载体pET-30a(+)均经EcoRⅠ和SalⅠ双酶切,凝胶回收AHSG DNA片段和pET-30a线性片段,在T4 DNA连接酶作用下连接,构建重组表达质粒pET-30a-AHSG,转化感受态细胞DH5α,酶切及特异PCR扩增鉴定。
1.6 AHSG重组蛋白的诱导表达及纯化 从转化成功的DH5α重组菌中使用质粒提取试剂盒提取重组表达质粒,转化感受态细胞BL21(DE3),以构建原核表达系统BL21(pET-30a-AHSG)。使用不同浓度的IPTG(30、80、300、800和1 200 μmol/L)诱导BL21(pET-30a-AHSG)3 h,以未转染和转染空质粒pET-30a(+)的BL21(DE3)作为空白对照,行SDSPAGE,测定诱导产物中目的蛋白的浓度。以最佳IPTG浓度诱导 BL21(pET-30a-AHSG)不同时间(0.5、1、2、3、4和5 h),行SDS-PAGE,测定诱导产物中目的蛋白的浓度,以确定最佳诱导时间。在优化后的诱导条件下诱导BL21(pET-30a-AHSG),分析目的蛋白在细胞内的定位,即可溶性分析。在优化后的诱导条件下诱导4 L BL21(pET-30a-AHSG),采用镍离子亲和层析的方法纯化带有组氨酸标签的重组蛋白,紫外分析法测定纯化蛋白的质量浓度。
1.7 AHSG重组蛋白的免疫学活性分析 取10 μL质量浓度最高管中的AHSG纯化蛋白行SDSPAGE,卸胶后使用湿转的方法转移目的蛋白到硝酸纤维素(NC)膜上,采用恒流模式,电流强度0.02 A,转膜时间110 min,转膜后丽春红染膜,判断转膜效果。将NC膜浸入封闭液中封闭2 h,与一抗(兔源AHSG多克隆抗体)室温孵育2 h,与二抗(HRP标记的羊抗兔IgG)室温孵育1 h,DAB显色。
2 结果
2.1 AHSG基因的RT-PCR扩增结果 扩增产物中高亮度的DNA片段长度为1 104 bp,与AHSG基因的cDNA长度一致,见图1。

图1 AHSG基因RT-PCR扩增结果
2.2 克隆质粒AHSG-T鉴定结果 见图2。AHSG-T的单酶切和双酶切产物均出现长度约为2 700 bp和1 104 bp的两条片段(与pMD18-T载体和AHSG基因的长度一致),特异PCR扩增产物中存在1 104 bp片段,证实克隆质粒AHSG-T构建成功。

图2 克隆质粒AHSG-T的鉴定
同源性分析结果显示,扩增出的AHSG基因与NCBI网上GENE ID197的基因有7个核苷酸差异,同源性为99%;该基因编码367个氨基酸,与AHSG (NP_001613.2)有4个氨基酸差异,分别为第248位苏氨酸→甲硫氨酸,第256位苏氨酸→丝氨酸,第267位苏氨酸→丙氨酸,第358位酪氨酸→半胱氨酸,同源性为98.9%。
2.3 重组表达质粒pET-30a-AHSG的鉴定结果见图3。pET-30a-AHSG单、双酶切均获得2条分别与pET-30a(+)和AHSG基因长度一致的条带,特异PCR扩增得到约1 100 bp的基因片段,证明成功构建了含有AHSG基因的重组表达质粒。
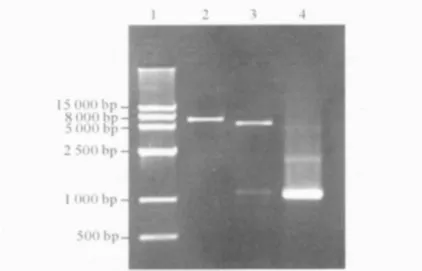
图3 重组表达质粒pET-30a-AHSG的鉴定
2.4 原核表达系统BL21(pET-30a-AHSG)诱导条件优选结果
2.4.1 最佳诱导浓度 不同浓度IPTG均可诱导目的蛋白的表达,目的蛋白的表达量差异不明显,80 μmol/L IPTG诱导产物中的目的蛋白表达量稍大(图4),故选择80 μmmol/L IPTG作为最佳诱导剂浓度。
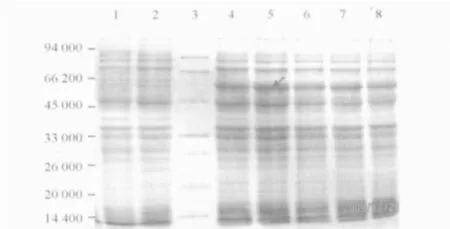
图4 不同浓度IPTG诱导3 h后目的蛋白的表达
2.4.2 最佳诱导时间 诱导1~5 h样品均可观察到目的蛋白条带(图5),但表达量无明显差异。选择3 h作为最佳诱导时间。

图5 80 μmol/L IPTG诱导不同时间后目的蛋白的表达
2.5 重组蛋白AHSG分析
2.5.1 AHSG重组蛋白的可溶性分析 结果见图6。可见目的蛋白在裂解上清中所占的比例很小,主要以不溶性的包涵体形式存在。
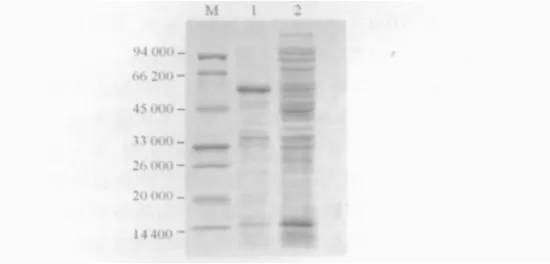
图6 重组蛋白AHSG在细胞内的定位分析
2.5.2 AHSG重组蛋白的纯化结果 SDS-PAGE结果见图7。测得的蛋白质量浓度最大达到2.3 g/L。

图7 AHSG重组蛋白的纯化结果
2.5.3 纯化蛋白的免疫学活性分析 免疫印迹杂交结果见图8。可见,重组蛋白可以与AHSG抗体发生特异性结合,证明重组蛋白具有AHSG抗原性。

图8 纯化蛋白的Western blot鉴定
3 讨论
AHSG是一种存在于健康人体血清中具有高度遗传多态性的糖蛋白,由349个氨基酸残基编码两条多肽链组成,主要由肝脏合成,后储存、富集于骨组织中。其基因染色体定位于3q27,由7个外显子组成,横跨8.2 kb基因组DNA,cDNA长度为1 104 bp,有AHSG1、AHSG2两个等位基因,在等电聚焦中展现其多态性,和PP63属于同源基因。
AHSG具有多种生物功能:①与胎儿大脑皮质的发育有关,在胎儿期脑脊液中高浓度表达[7]。②作为一个全身性的碱性磷酸钙阻止器,参与骨基质的形成和重组[8]。③作为一种天然的胰岛素酪氨酸激酶受体抑制剂,其血清水平与胰岛素抵抗水平有关。④可阻断转化生长因子和细胞表面受体的结合,抑制转化生长因子的信号转导,并可阻止TGF-β诱导的上皮间质细胞的转换,在肿瘤进程中发挥作用。⑤在一些血液系统恶性疾病和实体瘤中含量减少。
目前,对AHSG基因的研究较多侧重于其与糖尿病、子宫内膜癌、神经胶质瘤及骨密度的关系[9],有关AHSG基因与肠道肿瘤、肺癌、乳癌、肝癌等恶性肿瘤的关系的研究也有报道[3-6],提示AHSG可作为恶性肿瘤的一种血清学标志物用于肿瘤的诊断。作者采用基因工程方法,对AHSG进行了克隆、重组表达并纯化,得到了较纯的AHSG融合蛋白,为进一步评价AHSG在常见肿瘤诊断中的价值奠定了基础。
[1]Mathews ST,Deutsch DD,Iyer G,et al.Plasma alpha2-HS glycoprotein concentrations in patients with acute myocardial infarction quantified by a modified ELISA[J].Clin Chim Acta,2002,319(1):27
[2]陈学彬.人脑胶质瘤AHSG的相关性研究进展[D].苏州:苏州大学,2006.
[3]Swallow CJ,Partridge EA,Macmillan JC,et al.α2 HS-glycoprotein,an antagonist of transforming growth factor β in vivo,inhibits intestinal tumor progression[J].Cancer Res,2004,64(18):6402
[4]刘彦.人肺鳞癌相关差异表达基因和基因表达谱的研究[D].北京:中国协和医科大学,2007.
[5]Yi JK,Chang JW,Han W,et al.Autoantibody to tumor antigen,alpha 2-HS glycoprotein:a novel biomarker of breast cancer screening and diagnosis[J].Cancer Epidemiol Biomarkers Prev,2009,18(5):1357
[6]聂轶飞,王凯娟,代丽萍,等.肝癌相关抗原血清学自身抗体反应分析[J].中国公共卫生,2007,123(7):801
[7]Deng HW,Xu FH,Davies KM,et al.Differences in bone mineral density,bone mineral content,and bone areal size in fracturing and non-fracturing women,and their interrelationships at the spine and hip[J].J Bone Miner Metab,2002,20(6):358
[8]Szweras M,Liu D,Partridge EA,et al.Alpha2-HS glycoprotein/fetuin,a transforming growth factor-beta/bone morphogenetic protein antagonist,regulates postnatal bone growth and remodeling[J].J Biol Chem,2002,277(22): 19991
[9]Kalaby L,Cseh K,Pajor A,et al.Correlation of maternal serum fetuim/alpha 2-HS-glycoprotein concentration with maternal insulin resistance and anthropometric parameters of neonates in normal pregnancy and gestational diabetes[J].Eur J Endocrinol,2002,147(2):243
Prokaryotic expression,purification and immunological analysis of recombinant alpha2-Heremans-Schmid glycoprotein
WANG Peng1,2),REN Pengfei1),DAI Liping1,2),WANG Kaijuan1,2),ZHANG Jianying1,2)1)Department of Epidemiology,College of Public Health,Zhengzhou University,Zhengzhou 4500012)Henan Key Laboratory of Tumor Epidemiology,Zhengzhou 450052
alpha2-Heremans-Schmid glycoprotein;prokaryotic expression;protein purification;antigenicity
Aim:To express and purify recombinant alpha2-Heremans-Schmid glycoprotein(AHSG)with biological activity.Methods:The total RNA from HepG2 cells was extracted and cDNA was synthesized.AHSG gene was amplified by RT-PCR method,then cloned on pMD18-T vector.The constructed clone plasmid was transformed into E.coli DH5α,then the fragments of AHSG acquired from that were ligated with pET-30a(+)vector.The recombinant AHSG protein was expressed after the constructed expression plamid was tranformed into E.coli BL21(DE3)and purified by Nickel ion affinity chromatography.The purified products were identified and analyzed by SDS-PAGE and Western blot,and the concentration of purified protein was measured.Results:The prokaryotic expression system BL21(pET30a-AHSG)was constructed successfully.The most appropriate condition for the expression of target protein was 80 μmol/L IPTG for 3 h.A fusion protein approximately 54 600 was yielded,mainly existing in the form of insoluble inclusion bodies.The highest concentration of recombinant protein purified by Nickel ion affinity chromatography was up to 2.3 g/L.The recombinant protein had antigenicity identified by Western blot.Conclusion:The prokaryotic expression system of AHSG and protein purification system have been successfully constructed and the purified AHSG recombinant protein is highly antigenic and immunogenic.
Q789
10.3969/j.issn.1671-6825.2012.01.003
*国家自然科学基金面上项目资助 30872962
(2011-07-03收稿 责任编辑王 曼)
