丝裂原活化蛋白激酶在力达霉素抑制鼠骨髓瘤细胞增殖和诱导凋亡中的作用
2012-12-06甄永占章广玲赵毓芳刘学军吕翠平徐爱军
甄永占,章广玲,赵毓芳,闫 丰,刘学军,吕翠平,徐爱军
(1.河北联合大学基础医学院组织学与胚胎学教研室,河北 唐山063000;2.河北联合大学附属医院肿瘤科,河北 唐山063000)
丝裂原活化蛋白激酶在力达霉素抑制鼠骨髓瘤细胞增殖和诱导凋亡中的作用
甄永占1,章广玲1,赵毓芳1,闫 丰2,刘学军2,吕翠平1,徐爱军1
(1.河北联合大学基础医学院组织学与胚胎学教研室,河北 唐山063000;2.河北联合大学附属医院肿瘤科,河北 唐山063000)
目的:研究力达霉素(LDM)对鼠骨髓瘤细胞丝裂原活化蛋白激酶(MAPKs)信号传导通路的影响及MAPKs在LDM抑制鼠骨髓瘤细胞增殖和诱导凋亡中的作用,为LDM治疗人多发性骨髓瘤的研究提供依据。方法:选取处于对数生长期鼠骨髓瘤细胞株SP2/0,随机分为空白对照组、4种不同浓度LDM组,采用Western blotting方法检测各组细胞48 h后MAPK家族的三个主要成员c-Jun氨基末端激酶(JNK)、细胞外信号调节激酶(ERK)和p38 MAPK的表达水平。选取处于对数生长期SP2/0,随机分为对照组、LDM组、SP600125组(JNK抑制剂)、SB203580组(p38抑制剂)、U0126组(ERK抑制剂)、LDM+SP600125组、LDM+SB203580组和LDM+U0126组,采用MTS法和流式细胞术分别检测各组细胞增殖和凋亡情况。结果:细胞培养48 h后,不同浓度LDM组JNK、ERK和p38 MAPK的表达水平高于空白对照组(P<0.05);各抑制剂组细胞增殖率和细胞凋亡率与空白对照组比较差异无统计学意义(P>0.05),即对细胞的增殖抑制和凋亡诱导作用均不明显;但LDM+SP600125组、LDM+SB203580组LDM对细胞的增殖抑制和凋亡诱导作用均降低(P<0.05),而LDM+U0126组LDM对细胞的增殖抑制和凋亡诱导作用则增强(P<0.05)。结论:LDM能够通过激活JNK、p38 MAPK抑制鼠骨髓瘤细胞SP2/0细胞增殖,诱导其凋亡。
力达霉素;细胞凋亡;骨髓瘤;丝裂原活化蛋白激酶
多发性骨髓瘤是血液系统发病居第2位的常见恶性肿瘤,对化疗存在普遍抵抗性,目前还是一种难以治愈的致死性疾病。标准的化疗方案仅能使40%~60%患者获得暂时缓解,中位生存期一般不超过3年。大剂量化疗联合造血干细胞移植可使缓解率明显提高,但除了极少数患者以外,大部分均难免复发[1-3],因此寻找新的抗多发性骨髓瘤药成为研究热点。力达霉素(lidamycin,LDM)是大分子肽类抗肿瘤抗生素,大量研究[4-7]表明:LDM具有较强的抗肿瘤活性。目前国内正在进行LDM临床Ⅱ期试验研究。本实验研究LDM体内外抗鼠骨髓瘤作用,旨在为今后LDM在多发性骨髓治疗中的应用提供依据。
1 材料与方法
1.1 细胞株及主要试剂 鼠骨髓瘤细胞SP2/0由本室传代保存。用含10%胎牛血清(Hyclone)的高糖DMEM培养液(Gibco公司),于37℃、5%CO2饱和湿度条件下培养,2 d传代1次,取处于对数生长期细胞用于实验。LDM由中国医学科学院医药生物技术研究所甄永苏院士惠赠;蛋白定量试剂盒(BCATMprotein assay kit,Pierce公司);宽范围蛋白预染 Marker(New England Biolabs公司);蛋白质印迹发光液和PVDF膜(Millipore公司);FITC-AnnexinⅤ 凋亡检测试剂盒(北京宝赛生物技术有限公司);Actin抗体sc-1616(Santa Cruz公司);HRP标记的羊抗兔、兔抗羊和羊抗小鼠IgG抗体(北京中杉金桥有限责任公司);丝裂原活化蛋白激酶(MAPK)家族成员抗体试剂盒、磷酸化 MAPK家族成员抗体试剂盒(Cell Signaling Technology 公 司);JNK 抑 制 剂SP600125、p38 MAPK抑制剂SB203580和MEK抑制剂U0126(Merck公司)。
1.2 细胞增殖活性检测 采用3-(4,5-二甲基噻唑-2-磺)-5-(3-羧甲基氧苯基)-2-(4-磺苯基)-2氢四唑内盐(MTS)法测定细胞存活率。原理是MTS在 吩嗪二甲基硫酸酯(phenazinemthosulfate,PMS)存在的情况下可被活细胞内的脱氢酶类还原,转化成液态可溶的产物,而死细胞无该功能。MTS水溶物可用酶标仪在波长490 nm处检测吸光度(A490)值,该值可间接反应活细胞的数量和活性。取对数生长期细胞,轻轻吹打分散成细胞悬液,记数后以每孔1×104个的密度接种细胞于96孔细胞培养板中,2 h后分别加入不同药物处理48 h,每组至少3个平行孔。每孔加入20μL MTS/PMS混合液(按说明书配制:每2 m L MTS溶液中加入100 L PMS,现用现配),37℃继续培养1~4 h,用酶标仪(Thermo Labsystems,Multiskan MK3)于490 nm处测定每个孔的A490值。实验设无药对照孔和无细胞对照孔,各3孔,按下面公式计算细胞的存活率:细胞存活率=(加药组A490值-空白组A490值)/(对照组A490值-空白组A490值)×100%。实验重复3次。为了研究JNK、p38 MAPK和ERK的激活在LDM抑制SP2/0细胞增殖中的作用,分为空白对照组、LDM组、SP600125、SB203580和U0126组(分别加入JNK抑制剂SP600125、p38抑制剂SB203580和 ERK 抑 制 剂 U0126)、LDM+SP600125组、LDM+SB203580组和LDM+U0126组,分别用相应的抑制剂(SP600125、SB203580和U0126)预处理SP2/0细胞2 h,再加入LDM(0.5 nmol·L-1)继续作 用 48 h,采用MTS法检测各组细胞增殖抑制率。
1.3 FITC-Annexin V/碘化丙碇(PI)双染流式细胞术检测细胞凋亡 取对数生长期细胞3 m L按5×104/孔接种于6孔板,2 h后加入分别用相应的抑制剂(SP600125、SB203580和U0126)预处理SP2/0细胞作用2 h,再加入LDM(0.5 nmol·L-1)继续作用48 h,收集细胞,并用磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤,将待测细胞数调整为(5~10)×108L-1,取1 m L细胞于4℃、1000 r·min-1离心10 min,弃上清液,PBS洗涤,将细胞重悬于Binding Buffer 300μL,加入Annexin V/FITC 10μL,轻轻摇匀,室温反应1 h,加入5μL PI轻轻摇匀,室温反应15 min,细胞经200目尼龙网过滤后,在流式细胞检测仪上进行检测。
1.4 蛋白质提取及 Western blotting检测 收集0.1、0.5、1.0、2.0 nmol·L-1LDM作用48 h及未加药处理的SP2/0细胞,用预冷的1×PBS洗3次,加入新鲜配制的细胞裂解液(50 mmol·L-1Tris-HCl,p H7.5;1%NP-40;150 mmol·L-1NaCl;1 mmol·L-1Na3VO4;1 mmol·L-1NaF,临用时加入3种蛋白酶抑制剂:1% 抑蛋白酶肽;10 g·L-1亮抑酶肽;1 mmol·L-1苯甲基磺酰氟)100μL,细胞与裂解液充分混合,冰浴20 min。于4℃、13000 r·min-1离心15 min,收集上清液于新的微量离心管中,采用BCA法测定蛋白表达水平。取各样品等量总蛋白30μg加入0.25倍体积的5×上样缓冲液,煮沸变性5 min后,在10%十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate-polyacrylamide gel electrophoresis,SDS-PAGE)胶上进行电泳。然后转移到硝酸纤维素膜上,1%BSA封闭1 h,一抗4℃孵育过夜后,加相应二抗孵育2 h,膜上滴加化学发光增强剂(Santa Cruz biotechnology SC-2048),按照试剂盒说明进行操作,通过凝胶成像系统拍照保存结果。
1.5 统计学分析 采用SPSS 13.0统计软件进行数据分析。各组细胞增殖率和凋亡率组间比较采用χ2检验。
2 结 果
2.1 Western blotting法检测LDM作用SP2/0细胞后MAPKs的表达水平 不同浓度LDM分别作用SP2/0细胞48 h后,不同浓度LDM组磷酸化的JNK、ERK和p38 MAPK的表达水平均高于空白对照组(P<0.05)。见图1。
2.2 LDM和JNK不同抑制剂作用后细胞增殖率0.5 nmol·L-1LDM对细胞的增殖抑制作用明显,细胞增殖率低于空白对照组(P<0.05);JNK 抑 制 剂 SP600125(14μmol·L-1)、p38 MAPK抑制剂 SB203580(12.5μmol·L-1)和MEK抑制剂U0126(10μmol·L-1)对细胞的增殖抑制作用均不明显,细胞增殖率与空白对照组比较差异无统计学意义(P>0.05);SP600125和SB203580分别联合LDM组细胞增殖率高于LDM组(P<0.05),即 SP600125和 SB03580 联合LDM后均降低了LDM对SP2/0细胞增殖抑制作用,与LDM组比较差异有统计学意义(P<0.05),而 U0126联合LDM组细胞增殖率低于LDM组(P<0.05),即U0126联合LDM作用后提高了LDM对SP2/0细胞增殖抑制作用。见表1。

图1 Western blotting法检测SP2/0细胞MAPKs蛋白表达电泳图Fig.1 Electrophoregram of expressions of MAPKs protein in SP2/0 cells detected by Western blotting method
2.3 LDM联合JNK不同抑制剂作用后细胞凋亡率 SP600125组细胞凋亡率为2.6%±0.7%,与空白对照组(2.3%±0.6%)比较差异无统计学意义(P>0.05),即凋亡诱导作用不明显;LDM组凋亡率为20.5%±1.3%,与空白对照组比较差异有统计学意义(P<0.05),LDM+SP600125组细胞凋亡率为10.3%±0.9% ,与LDM组凋亡率比较差异有统计学意义(P<0.05),表明SP600125联合LDM可降低LDM对SP2/0细胞凋亡诱导作用。见图2。
2.4 LDM联合p38 MAPK抑制剂作用后细胞凋亡率 空白对照组细胞凋亡率为3.1%±0.6%,SB203580组细胞凋亡率为3.6%±0.7%,二者比较差异无统计学意义(P>0.05),即凋亡诱导作用不明显;LDM组凋亡率为24.1±1.3%,与空白对照组比较差异有统计学意义(P<0.05);LDM+SB203580组凋亡诱导率为11.3%±0.9%,与LDM组比较差异有统计学意义(P<0.05),表明SB203580联合LDM可降低LDM对SP2/0细胞凋亡诱导作用。见图3。
表1 LDM和不同抑制剂作用后细胞增殖率Tab.1 The proliferation rates of SP2/0 cells after treated with LDMand different inhibitors (n=3,±s,η/%)

表1 LDM和不同抑制剂作用后细胞增殖率Tab.1 The proliferation rates of SP2/0 cells after treated with LDMand different inhibitors (n=3,±s,η/%)
*P<0.05 vs control group;△P<0.05 vs LDMgroup.
Group Proliferation rate Blank control 100.0±0.0 LDM 43.5±2.3*SP600125 98.9±5.8 SB203580 99.5±6.2 U0126 98.5±6.7 LDM+SP600125 61.9±5.2*△LDM+SB203580 66.0±4.3*△LDM+U0126 26.0±2.6*△
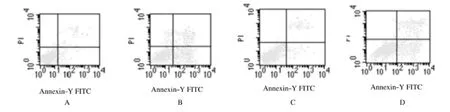
图2 LDM联合SP600125作用后SP2/0细胞凋亡率Fig.2 Apoptotic rates of SP2/0 cells after treated with LDMand SP600125
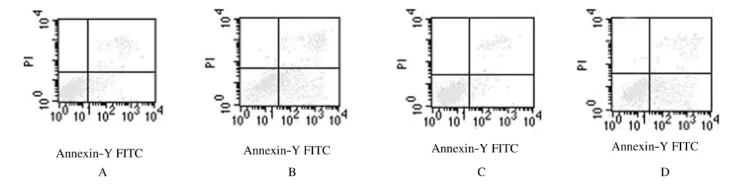
图3 LDM联合SB203580作用后SP2/0细胞凋亡率Fig.3 Apoptotic rates of SP2/0 cells after treated with LDMand SB203580
2.5 LDM联合MEK抑制剂作用后细胞凋亡率空白对照组细胞凋亡率为4.1%±0.8%,U0126组细胞凋亡率为4.3%±0.9%,二者比较差异无统计学意义(P>0.05),即凋亡诱导作用不明显;LDM组凋亡率为20.6%±1.3%,与空白对照组比较差异有统计学意义(P<0.05);LDM+U0126组凋亡率为39.8%±1.6%,与LDM组比较差异有统计学意义(P<0.05),表明U0126联合LDM可增强LDM对SP2/0细胞凋亡诱导作用。见图4。
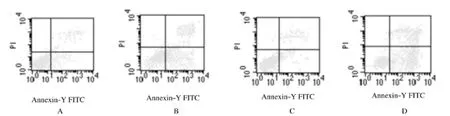
图4 LDM联合U0126作用后SP2/0细胞凋亡率Fig.4 Apoptotic rates of SP2/0 cells after treated with LDMand U0126
3 讨 论
尽管对多发性骨髓瘤的生物学研究取得了长足进展,并采用了大剂量化疗的治疗方案,对于绝大多数患者来说该病仍是一种难以治愈的致死性疾病。
LDM属于烯二炔类抗生素,可诱导DNA单、双链的断裂。大量研究[4-7]表明:LDM具有较强的抗肿瘤活性。本研究结果显示:LDM浓度依赖性激活 MAPK家族的3个主要成员:JNK、p38 MAPK和ERK1/2,磷酸化的JNK和p38 MAPK表达增加在LDM抑制SP2/0细胞增殖、诱导细胞凋亡中起主要作用,而磷酸化的ERK表达增加参与了SP2/0细胞的生存。
MAPK属于丝/苏氨酸蛋白激酶,广泛存在于哺乳动物细胞的胞质中,参与调节细胞生长、发育、分裂、死亡和细胞间的功能等一系列生命活动[8-9]。研究[10-12]表明:MAPK 家族中的这3个主要成员JNK、p38 MAPK和ERK1/2既有抗增殖、促凋亡作用,又有促增殖、抗凋亡作用,作用类型取决于细胞的类型、死亡刺激的性质、活化的持续时间和其他信号通路的活性。
本研究结果显示:单独应用3种抑制剂对细胞的增殖抑制和凋亡诱导作用均不明显,但JNK抑制剂SP600125或p38 MAPK抑制剂SB203580分别联合LDM作用后均降低了LDM对SP2/0细胞的凋亡诱导作用,提示JNK和p38 MAPK的激活参与了LDM对SP2/0的细胞生长抑制和凋亡诱导作用,而MEK抑制剂U0126与LDM合用后提高了LDM对SP2/0细胞生长抑制作用,提示ERK的激活参与了SP2/0细胞的生存。
MAPK信号传导通路是一个复杂的网络系统,在哺乳类细胞中各个MAPK信号通路之间通过复杂的机制既可相互区别,又可相互调节,既有自身的独立性,相互间又有千丝万缕的联系。JNK、p38 MAPK和ERK 3条通路,或是在上游蛋白激酶,或是在下游作用底物处,总是有其通路的交汇。这种复杂的、多联系的网络系统是确保细胞反应精确性和准确性的关键,细胞对外界刺激的反应是综合了各个信号通路之间的激活或(和)抑制效应而产生的。本研究显示:LDM可显著激活JNK、p38 MAPK、ERK通路,但LDM最终显示了强大的凋亡诱导作用,表明LDM作用下各信号通路的平衡倾向于诱导细胞凋亡。
综上所述,LDM能够通过激活JNK、p38 MAPK抑制鼠骨髓瘤细胞SP2/0细胞增殖,诱导其凋亡。
[1]Chiusolo P,Sica S,Piccirillo N,et al.Molecular and clinical follow-up after stem cell transplantation for multiple myeloma[J].Ann Hematol,2001,80(2):90-95.
[2]Leiba M,Jakubikova J,Klippel S,et al.Halofuginone inhibits multiple myeloma growthinvitroandinvivoand enhances cytotoxicity of conventional and novel agents[J].Br J Haematol,2012,157(6):718-731.
[3]Naik S,Nace R,Barber GN,et al.Potent systemic therapy of multiple myeloma utilizing oncolytic vesicular stomatitis virus coding for interferon-β[J].Cancer Gene Ther,2012,19(7):443-450.
[4]Zhen YS,Xue YC,Shao RG.Antitumor activity of the new enediyne antibiotic C1027[J].Chin J Antibiot,1994,19(2):164-168.
[5]Zhong GS,Guo XF,Zhang SH,et al.Optimization of the assembly efficiency for lidamycin chromophore bound to its apoprotein:a case study using orthogonal array[J].Biomed Environ Sci,2011,24(6):602-607.
[6]Zhang Q,Liu XJ,Hu L,et al.Factor VII light chaintargeted lidamycin targets tissue factor-overexpressing tumor cells for cancer therapy[J].Int J Mol Med,2012,29(3):409-415.
[7]Zhen HY,He QH,Zhen YZ,et al.Inhibition of mouse embryonic carcinoma cell growth by lidamycin through downregulation of embryonic stem cell-like genes Oct4,Sox2 and Myc[J].Invest New Drugs,2011,29(6):1188-1197.
[8]Pearson G,Robinson F,Beers Gibson T,et al.Mitogenactivated protein(MAP)kinase pathways:regulation and physiological functions[J].Endocr Rev,2001,22(2):153-183.
[9]Huang P,Han J,Hui L.MAPK signaling in inflammation-associated cancer development[J].Protein Cell,2010,1(3):218-226.
[10]Lu Z,Xu S.ERK1/2 MAP kinases in cell survival and apoptosis[J].IUBMB Life,2006,58(11):621-631.
[11]Wen J,Cheng HY,Feng Y,et al.p38 MAPK inhibition enhancing ATO-induced cytotoxicity against multiple myeloma cells[J].Br J Haematol,2008,140(2):169-180.
[12]Yan H,Wang YC,Li D,et al.Arsenic trioxide and proteasome inhibitor bortezomib synergistically induce apoptosis in leukemic cells:the role of protein kinase cdelta[J].Leukemia,2007,21(7):1488-1495.
Role of mitogen-activated protein kinases in proliferation inhibition and apoptosis induction of lidamycin on mouse myeloma cells
ZHEN Yong-zhan1,ZHANG Guang-ling1,ZHAO Yu-fang1,YAN Feng2,LIU Xue-jun2,LV Cui-ping1,XU Ai-jun1
(1.Department of Histology and Embryology,College of Basic Medical Sciences,Hebei United University,Tangshan 063000,China;2.Department of Oncology,Affiliated Hospital,Hebei United University,Tangshan 063000,China)
Objective To investigate the effect of lidamycin(LDM)on signal transmission pathway of mitogenactivated protein kinases(MAPKs)in mouse myeloma cells and the role of MAPKs in cell growth and apoptosis induced by LDM,and to provide basis for research on treatment of human multiple myeloma with LDM.Methods The mouse myeloma SP2/0 cells in logarithm growth phase were selected and randomly divided into blank control group and four different concentrations of LDMgroups.The expression levels of c-Jun amino-terminal kinase(JNK),extracellular signal-regulated kinase(ERK)and p38 MAPK were detected 48 h after culture by Western blotting.And then the SP2/0 cells in logarithm growth phase were selected and randomly divided into control group,LDMgroup,SP600125(JNK inhibitor)group,SB203580(p38 inhibitor)group,U0126 group(ERK inhibitor),LDM+SP600125 group,LDM+SB203580 group,and LDM+ U0126 group.MTS assay was used to detect SP2/0 cell proliferation and flow cytometry was used to analyze apoptosis in various groups.Results The expression levels of JNK,ERK and p38 MAPK in SP2/0 cells in different concentrations of LDMgroups were higher than those in blank control group(P<0.05)48 h after culture;Compared with blank control group,the apoptotic rates and proliferation rates in different inhibitors groups had no significant differences(P>0.05),in other words,the proliferation inhibition and apoptosis induction in SP600125 group,SB203580 group,and U0126 group were not obvious.The effects of LDMon the growth inhibition and apoptosis of cells were decreased in LDM+SP600125 group and LDM+SB203580 group(P<0.05)and increased in LDM+ U0126 group(P<0.05).Conclusion LDMcan inhibit the proliferation of mouse myeloma SP2/0 cells and induce apoptosis through activation of JNK and p38 MAPK.
lidamycin;apoptosis;myeloma;mitogen-activated protein kinases
R739.42
A
1671-587Ⅹ(2012)06-1129-06
2012-05-02
河北省自然科学基金资助课题(H2012401030)
甄永占(1970-),女,河北省唐山市人,副教授,医学博士,主要从事肿瘤分子药理学研究。
甄永占(Tel:0315-3725754,E-mail:yongzhanzhen@126.com)
