α-突触核蛋白功能片段对原代培养大鼠神经元突起的促生长作用
2012-12-06王鹏,许洁,李昕,于顺,何欣
王 鹏,许 洁,李 昕,于 顺,何 欣
(1.北华大学基础医学院人体解剖学教研室,吉林 吉林132013;2.吉林化工学院理学院,吉林 吉林132022;3.首都医科大学宣武医院 北京老年病研究所神经生物学研究室,北京100053)
α-突触核蛋白功能片段对原代培养大鼠神经元突起的促生长作用
王 鹏1,许 洁2,李 昕3,于 顺3,何 欣1
(1.北华大学基础医学院人体解剖学教研室,吉林 吉林132013;2.吉林化工学院理学院,吉林 吉林132022;3.首都医科大学宣武医院 北京老年病研究所神经生物学研究室,北京100053)
目的:研究人α-突触核蛋白(α-Syn)对原代培养大鼠神经元突起的促生长作用,阐明该蛋白质的功能片段,并探讨其作用机制。方法:获取新生Wistar大鼠大脑皮层神经元分组培养,分别加入α-Syn(添加α-Syn组)、α-Syn功能片段N端(添加N端组)、C端(添加C端组)和NAC段(添加NAC段组),对照组不添加功能片段。倒置相差显微镜观察各组神经元突起的长度,Western blotting法、免疫荧光法特异性鉴定各组α-Syn蛋白的表达水平。结果:在生长至1和2 h,添加C端组和α-Syn组的神经元突起平均长度长于对照组(P<0.05),而添加NAC段组和N端组与对照组比较差异无统计学意义(P>0.05);生长至4 h,添加α-Syn组和C端组的神经元突起平均长度明显长于对照组(P<0.01),而添加NAC段组和N端组与对照组比较差异无统计学意义(P>0.05)。Western blotting和免疫荧光法检测,N端和C端可以进入神经元,NAC段不能进入神经元。结论:α-Syn在原代神经元生长初期对其突起生长具有促进作用,具有这一功能的片段位于C端,其机制可能是其通过胞膜进入到神经元内,促进微管蛋白聚合形成微管,加速细胞骨架的形成和轴浆转运。
突触核蛋白;神经元;突起生长;细胞培养;帕金森病
帕金森病(Parkinson’s disease,PD)是临床常见的神经系统退行性疾病,临床表现呈进展性,目前尚无控制病程发展的有效措施。PD的病理特征为黑质多巴胺能神经元发生变性坏死和路易小体及路易轴索的形成[1-2]。多项研究[3]表明:人α-突触核蛋白(α-Synuclein,α-Syn)是参与形成路易小体和路易轴索的主要成分。已知α-Syn与细胞的信号转导有关,参与突触形成、维持和神经元的分化,对突触可塑性起一定作用。在PD病理中,α-Syn除了作为路易小体和路易轴索的主要成分存在于细胞间以外,尚存活多巴胺能神经元的胞体和轴突中也有分布,特别是在轴突中分布较胞体更为密集。α-Syn是1种具有140个氨基酸的蛋白质[4-6]。正常情况下,α-Syn空间构象不稳定,但与其他蛋白质作用后会形成比较稳定的构象。α-Syn功能片段包括:NAC段(第61~95位氨基酸),已被确定是α-Syn淀粉样变和纤维化过程重要片段;N端(第1~60位氨基酸),对微管形成无作用,含有2个PD突变位点(30和53);C端(第96~140位氨基酸),包含α-Syn有家族特征性信息,可促进微管蛋白在体外合成微管[7]。研究[8]发现:α-Syn与微管蛋白之间存在分子伴侣关系;α-Syn在体外实验中能够促进微管蛋白的聚合,加速微管的形成。有研究[9-10]显示:α-Syn可以调节突起发出并促进原代培养大鼠神经元突起生长。但国内外尚无α-Syn各功能片段对突起生长影响的报道。本研究分离大鼠大脑皮层神经元,进行分组培养,观察α-Syn各片段对神经元突起生长的影响,旨在确定具有促生长作用的片段,探讨其作用机制和PD的发病机制。
1 材料与方法
1.1 动物及主要试剂 新生24 h Wistar大鼠30只,雌雄不限,购自解放军军事医学科学院实验动物中心,许可证号:SCXK-(军)2002-001。BCA蛋白质定量试剂盒(BCA Protein Assay Kit)购自PIERCE Biotech公司;α-Syn单克隆抗体3D5和各片段的单克隆抗体由宣武医院神经生物研究室制备;FITC标记的羊抗鼠抗体购自中衫公司;细胞培养基DMEM(F-12)购自Gibco公司;胎牛血清(FBS)和马血清(HS)购自HyClone公司;蛋白相对分子质量标准购自Pharmacia公司;其他试剂均为化学分析纯试剂。
1.2 蛋白的纯化与定量 实验所用重组蛋白人α-Syn、N端(1~60)、NAC(61~95)和 C端(96~140)均采用亲和层析法进行纯化。采用SDSPAGE法进行鉴定,BCA法进行定量。
1.3 原代神经元培养 将Kohn创建的原代培养方法[11-12]进行改良。新生24 h大鼠断头,分离鼠脑,置于D-Hank’s缓冲液中,剥去大鼠血管脑膜,分离皮层,剪碎。胰酶消化45 min后吹散,筛网过滤。600 r·min-1离心3 min后弃上清,细胞沉淀用DMEM培养基悬浮,计数细胞密度。按每皿0.75×105个接种于培养皿中,加入相应蛋白进行分组培养。
1.4 神经元突起生长的观察和长度测量 培养至第1、2和4 h时,向培养皿中添加1%戊二醛。室温下固定1 h。随机挑选30个视野进行拍照,要求每个视野至少有5个存活的神经元。镜下观察神经元形态。应用Image-Pro Plus V2.0软件测量神经元突起的长度。
1.5 Western blotting法和免疫荧光法鉴定各组蛋白表达水平 吸弃培养皿中的培养基,冲洗。刮下细胞,超声破碎。功率200 W,破碎30 s、2次,间歇 30 s。破 碎 后 加 入 SDS-PAGE Running Buffer,沸水中煮5 min。4°C、12000 r·min-1离心20 min,转移上清液。取上清液30μL作为样品,进行SDS-PAGE。电泳结束后,转膜,脱脂奶溶液封闭,冲洗后,以1∶1000比例稀释的相应抗体反应过夜。洗膜,再与1∶5000稀释的生物素标记的羊抗鼠抗体溶液反应。冲洗后,ECL法显示条带。将培养细胞以1%戊二醛室温下固定1 h后,PBS冲洗培养皿。以含10%羊血清的PBST溶液室温封闭1 h。弃封闭液,加入1∶5000稀释的3D5抗体1.5 m L。4°C过夜,用PBST冲洗。加入1∶500稀释的FITC标记羊抗鼠抗体,37°C、2 h;吸弃反应液,PBST冲洗。荧光显微镜下观察照相。
1.6 神经元分组培养 向原代神经元培养基中添加α-Syn、N 端、NAC 段 和 C 端,至 浓 度 为20 mol·L-1。培养至第1、2和4 h进行观察。同时用未添加蛋白的正常生长组的神经元作为对照组,观察各组神经元突起生长情况。
1.7 统计学分析 采用SPSS 13.0软件对数据进行统计分析。各组神经元突起的生长长度以±s表示,组间比较用单因素方差分析。
2 结 果
2.1 各组蛋白纯化鉴定 经亲和层析法纯化,以BCA法鉴定得到纯度较高的α-Syn、NAC段、N端和C端。见图1。
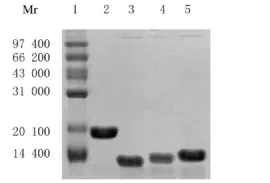
图1 纯化后蛋白的SDS-PAGE电泳图Fig.1 SDS-PAGE electrophoregram of purified proteins
2.2 各组神经元突起长度 在培养基内添加α-Syn和其他蛋白进行分组培养后,培养至1和2 h时添加α-Syn组和C端组的神经元突起平均长度大于对照组,添加N端组、NAC段组与对照组比较差异无统计学意义(P>0.05)。培养至4 h时,添加α-Syn组和添加C端组神经元突起长度明显大于对照组(P<0.01),而添加N端组、NAC段组与对照组比较差异无统计学意义(P>0.05)。添加C端具有与添加α-Syn相似的促突起生长功能,而添加NAC段和N端无促突起生长功能。见表1和图2。
表1 各组神经元突起生长长度Tab.1 Lengths of neurites of neurons in various groups(±s,l/μm)

表1 各组神经元突起生长长度Tab.1 Lengths of neurites of neurons in various groups(±s,l/μm)
*P<0.05,**P<0.01 vs control group.
Group Length of neurite(t/h)1 2 4 Control 22.31±1.2629.56±2.0338.12±3.62 Addingα-Syn 29.67±2.54*43.24±3.67*62.31±3.85**Adding N segment 22.62±3.1030.07±3.0237.09±2.72 Adding NAC 23.53±2.1129.27±3.5639.14±4.01 Adding C-Segment 28.46±1.73*42.16±2.68*61.22±3.96**
2.3 各组α-Syn蛋白表达水平 添加α-Syn组神经细胞裂解液经Western blotting检测,可见清晰条带,α-Syn蛋白表达阳性;添加N端组和C端组为弱阳性;对照组、添加NAC段组未见条带,α-Syn蛋白表达阴性。免疫荧光实验,添加α-Syn组、C端组和N端组神经元显色清晰,在细胞内呈广泛、均匀分布,添加C端组和对照组为阴性。见图3和4(插页二)。
3 讨 论
微管是中空管状结构,在胞质中形成网络结构[13]。微管广泛存在于各种细胞中,对细胞有明显的支持和定形作用,被认为是主要的 “细胞骨骼”。在神经细胞的轴突和树突中,微管束沿长轴排列,起支撑作用。在胚胎发育阶段,微管帮助轴突生长,突入周围组织;在成熟的轴突中,微管是物质运输的路轨,参与神经递质的传递。神经元生长的特点之一是突起(轴突和树突)自身缺乏合成蛋白的能力,其再生所需的结构和功能物质由胞体合成后经过长距离的转运到达轴突末梢,而担任此重要功能的物质之一即是微管,同时轴突的形成和径向生长也与微管密切相关。外源性α-Syn以某种尚未明确的方式进入到原代培养的神经元内[9],其能够与微管蛋白结合,促进微管蛋白聚合形成微管,既可以稳定突起形态,又能够加速轴浆转运,从而可以使神经元突起生长加速。这一作用提示该蛋白很可能参与神经系统早期发育阶段神经元突起的形成和中枢神经系统损伤后的修复。α-Syn的变异体A53T和A30P不具备微管有序组装功能,对突起生长无影响。本文作者认为:在家族PD患者的脑神经元受到某种致病因子损伤后,由于伴侣蛋白的突变,影响微管的合成和有序排列,致使神经元突起修复和重建障碍或轴浆转运紊乱,导致无定 形物的合成,这是PD发病原因之一。
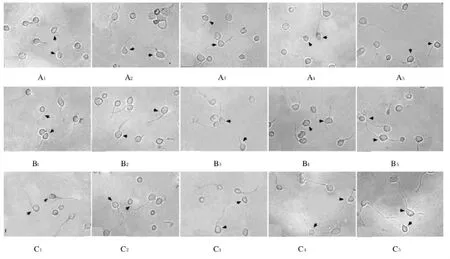
图2 镜下各组神经元突起的生长长度(×40)Fig.2 Lengths of neurites of neurons in various groups under microscope(×40)

图3 Western blotting法检测α-Syn蛋白表达Fig.3 The expressions of α-Syn proteins detected by Western blotting method
Alim等[7]发现:α-Syn与微管蛋白在结构上存在着伴侣关系;体外实验证实:微管蛋白对α-Syn纤维化聚合有启动和促进作用;α-Syn和微管蛋白共同分布在PD患者的病灶区域。Alim等[8]发现:α-Syn可以促进微管蛋白聚合组装成微管,并证实这一功能片断在α-Syn的C末端。这些发现也支持了本实验的结果。本研究结果显示:α-Syn可以进入神经元细胞,促进原代培养神经元突起的生长,其作用片段位于C端。整个α-Syn分子含有7个KTKEGV不完全重复序列,该序列能够介导α-Syn通 过细 胞 膜[14-15]。其 N 端 含 有 4 个 重 复 的KTKEGV残基,且含有极性的螺旋,能与载脂蛋白结合,进入神经元内部,引起Western blotting和免疫荧光印迹的阳性反应;但添加N端并没有促进突起生长的功能。而添加NAC段则不能进入细胞内,不能在突起内部促进微管骨架的合成,也不具有促突起生长的功能。失去穿梭能力可能是NAC成为PD患者脑组织间淀粉样变性的主要原因。α-Syn与微管蛋白之间的共同作用关系目前已成为PD病因的研究热点。
[1]Forno LS.Neuropathology of Parkinson’s disease[J].Neuropathol Exp Neurol,1996,55(3):259-272.
[2]Spillantini MG,Crowther RA,Jakes R,et al.alpha-Synuclein in filamentous inclusions of Lewy bodies from Parkinson’s disease and dementia with lewy bodies[J].Proc Nat Acad Sci USA,1998,95(11):6469-6473.
[3]Zarranz JJ,Alegre J,Gomez-Esteban JC,et al.The new mutation E46K of alpha-synuclein causes Parkinson and Lewy body dementia[J].Ann Neurol,2004,55(2):164-173.
[4]Maroteaux L,Campanelli JT,Scheller RH.Synuclein:a neuronspecific protein localized to the nucleus and presynaptic nerve terminal[J].Neuroscience,1988,8(8):2804-2815.
[5]Polymeropoulos MH,Higgins JJ,Golbe LI,et al.Mapping of a gene for Parkinson’s disease to chromosome q21-q23[J].Science,1996,274(5290):1197-1199.
[6]Kruger R,Muller T,Riess O.Involvement of alphasynuclein in Parkinson’s disease and other neurodegenerative disorders[J].Neural Transm,2000,107(1):31-40.
[7]Alim MA,Qiu LM,Kazuya T.Demonstration of a role for synuclein as a functional microtubule-associated protein[J].J Alzheimer’s Dis,2004,6(4):435-442.
[8]Alim MA,Hossain MS,Arima K.Tubulin seeds synuclein fibril formation[J].J Biol chem,2002(277):2112-2117.
[9]刘光伟,王 鹏,李尧华,等.α-突触核蛋白促进大鼠原代培养神经元突起生长[J].首都医科大学学报,2009,30(5):607-610.
[10]Lee HJ,Lee K,Im H.alpha-Synuclein modulates neurite outgrowth by interacting with SPTBN1[J].Biochem Biophys Res Commun,2012,424(3):497-502.
[11]Kohn JY.Quantitative determination of glutamate-mediated cortical neuronal injury in cell by lactate dehydrogenase efflux assay[J].J Neurosci Methods,1987,20(1):82.
[12]邓小云,杨 眉,蔡 芳,等.一种改进的原代神经元的制备方法[J].激光生物学报,2005,4(2):145-149.
[13]Meloni MA,Galleri G,Camboni MG.Modeled microgravity affects motility and cytoskeletal structures[J].Gravit Physiol,2004,11(2):197-198.
[14]Bussell R Jr,Eliezer D.A structural and functional role for 11-mer repeats in alpha-synuclein and other exchangeable lipid binding proteins[J].J Mol Biol,2003,329(4):763-778.
[15]Keun JA,Seung RP,Kwang CC,et al. Amino acid sequence motifs and mechanistic features of the membrane translocation of α-synuclein[J].J Neurochem,2006,97(1):265-279.
Growth-promoting effect ofα-Synuclein function fragment on neurites of primary cultured neurons of rats
WANG Peng1,XU Jie2,LI Xin3,YU Shun3,HE Xin1
(1.Department of Human Anatomy,School of Basic Medical Sciences,Beihua University,Jilin 132013,China;2.College of Science,Jilin Institute of Chemical Technology,Jilin 132022,China;3.Research Room of Neurobiology,Beijing Institute of Geriatrics,Xuanwu Hospital,Capital University of Medical Sciences,Beijing 100053,China)
Objective To study the growth-promoting effect ofα-Synuclein(α-Syn)function fragment on neurites of primary cultured neurons of rats and to clarify its physiological function fragment and to explore its mechanism.Methods The neurons in neocortex of newborn SD rats were cultured in various groups.Theα-syn(addingα-Syn group)and its function segments such as N segment(adding N segment group),C segment(adding C segment group)and NAC segment(adding NAC segment group)were added into the neural cells,and no protein was added into control group.The lengths of neurites of neurons were observed with inverted phase contrast microscope.Western blotting and immunofluorescence staining assay were used to confirm the expression levels of proteins in various groups.Results 1 and 2 h after culture,the average lengths of neurites in adding C segment group and addingα-Syn group were longer than that in control group(P<0.05);the average lengths of neuites in adding NAC and N segment groups had no significant differences compared with control group(P>0.05).4 h after culture,the average length of neurites in adding C segment group was significantly higher than that in control group(P<0.01);the average lengths of neuites in adding NAC and N segment groups had no significant difference compared with control group(P>0.05).The results of Western blotting and immunofluorescence staining assay showed that N segment and C segment could enter into the neuron,but NAC could not enter into the neuron.Conclusion α-Syn can enhance the outgrowth of neurite of primarily cultured neuron.The C segment ofα-Syn has the potential to enhance neurite outgrowth,and its possible mechanism may be that C segment ofα-Syn can enter into the neuron,and polymerize tubulin into microtubule,and accelerate the formation of cytoskeleton and axoplasmic transporting.
α-Synuclein;neuron;neurite outgrowth;cell culture;Parkinson’s disease
R741
A
2012-06-07
吉林省教育厅 “十二五”科学技术研究项目资助课题(吉教科合字[2012]第137号)
王 鹏(1977-),男,吉林省吉林市人,讲师,医学硕士,主要从事人体解剖学基础理论和老年病神经生物学研究。
何 欣(Tel:0432-64608003;E-mail:hexin8040@163.com)
1671-587Ⅹ(2012)06-1101-05
